
Гальванический элемент или гальванический элемент , названный в честь ученых Луиджи Гальвани и Алессандро Вольта , соответственно, представляет собой электрохимическую ячейку , в которой электрический ток генерируется из спонтанных окислительно-восстановительных реакций. Обычный аппарат обычно состоит из двух разных металлов, каждый из которых погружен в отдельные стаканы, содержащие соответствующие ионы металла в растворе, которые соединены солевым мостиком или разделены пористой мембраной. [1]
Вольта был изобретателем вольтова столба , первой электрической батареи . Общее использование слова « батарея» эволюционировало, включив в него один гальванический элемент, но первые батареи имели много гальванических элементов. [2]
В 1780 году Луиджи Гальвани обнаружил, что когда два разных металла (например, медь и цинк) находятся в контакте, а затем оба одновременно касаются двух разных частей мышцы лапки лягушки, чтобы замкнуть цепь, лапка лягушки сокращается. [3] Он назвал это « животным электричеством ». Лапка лягушки, помимо того, что была детектором электрического тока, также была электролитом (если использовать язык современной химии).
Через год после того, как Гальвани опубликовал свою работу (1790), Алессандро Вольта показал, что лягушка не нужна, используя вместо этого детектор на основе силы и пропитанную рассолом бумагу (в качестве электролита). (Ранее Вольта установил закон емкости C = В/В с датчиками на основе силы). В 1799 году Вольта изобрел вольтов столб, представляющий собой стопку гальванических элементов, каждый из которых состоит из металлического диска, слоя электролита и диска из другого металла. Он построил его полностью из небиологического материала, чтобы оспорить теорию животного электричества Гальвани (и более позднего экспериментатора Леопольдо Нобили ) в пользу своей собственной теории контактного электричества металл-металл. [4] Карло Маттеуччи, в свою очередь, построил батарею полностью из биологического материала в ответ на Вольту. [5] Точка зрения Вольты на контактное электричество характеризовала каждый электрод числом, которое мы теперь называем рабочей функцией электрода. Эта точка зрения игнорировала химические реакции на интерфейсах электрод-электролит, которые включают образование H 2 на более благородном металле в столбе Вольты.
Хотя Вольта не понимал работу батареи или гальванического элемента, эти открытия проложили путь для электрических батарей; элемент Вольта был назван IEEE Milestone в 1999 году. [6]
Примерно сорок лет спустя Фарадей (см. законы электролиза Фарадея ) показал, что гальванический элемент — теперь часто называемый гальваническим элементом — по своей природе является химическим. Фарадей ввел новую терминологию в язык химии: электрод ( катод и анод ), электролит и ион ( катион и анион ). Таким образом, Гальвани ошибочно считал, что источник электричества (или источник электродвижущей силы (ЭДС), или местонахождение ЭДС) находится в животном, Вольта ошибочно считал, что это физические свойства изолированных электродов, но Фарадей правильно определил источник ЭДС как химические реакции на двух интерфейсах электрод-электролит. Авторитетной работой по интеллектуальной истории гальванического элемента остается работа Оствальда. [7]
В 1940 году Вильгельм Кёниг предположил , что объект, известный как Багдадская батарея , может представлять собой технологию гальванических элементов из древней Парфии . Было показано, что копии, заполненные лимонной кислотой или виноградным соком, производят напряжение. Однако далеко не факт, что это было его предназначением — другие ученые указали, что он очень похож на сосуды, которые, как известно, использовались для хранения пергаментных свитков. [8]
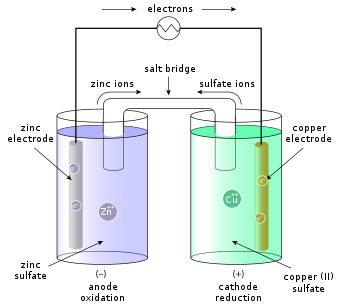
Гальванические элементы являются расширениями спонтанных окислительно-восстановительных реакций, но были разработаны только для использования энергии, получаемой в результате этой реакции. [1] Например, когда вы погружаете полоску цинкового металла (Zn) в водный раствор сульфата меди (CuSO 4 ), на поверхности цинкового металла будут собираться темные твердые отложения, а синий цвет, характерный для иона Cu 2+ , исчезает из раствора. Отложения на поверхности цинкового металла состоят из медного металла, и раствор теперь содержит ионы цинка. Эта реакция представлена следующим образом:
В этой окислительно-восстановительной реакции Zn окисляется до Zn 2+ , а Cu 2+ восстанавливается до Cu. Когда электроны передаются напрямую от Zn к Cu 2+ , энтальпия реакции теряется в окружающую среду в виде тепла. Однако ту же реакцию можно осуществить в гальваническом элементе, что позволяет преобразовать часть высвобождаемой химической энергии в электрическую энергию. В своей простейшей форме полуэлемент состоит из твердого металла (называемого электродом ), который погружен в раствор; раствор содержит катионы (+) металла электрода и анионы (−) для уравновешивания заряда катионов. [9] Полный элемент состоит из двух полуэлементов, обычно соединенных полупроницаемой мембраной или солевым мостиком , который предотвращает осаждение ионов более благородного металла на другом электроде. [9]
Конкретным примером является ячейка Даниэля (см. рисунок), с цинковым (Zn) полуэлементом, содержащим раствор ZnSO 4 (сульфат цинка), и медным (Cu) полуэлементом, содержащим раствор CuSO 4 (сульфат меди). Здесь для замыкания электрической цепи используется солевой мостик.
Если внешний электрический проводник соединяет медный и цинковый электроды, цинк из цинкового электрода растворяется в растворе в виде ионов Zn2 + (окисление), высвобождая электроны, которые поступают во внешний проводник. Чтобы компенсировать повышенную концентрацию ионов цинка, через солевой мостик ионы цинка (катионы) покидают цинковый полуэлемент, а сульфат-ионы (анионы) поступают в цинковый полуэлемент. В медном полуэлементе ионы меди оседают на медный электрод (восстановление), забирая электроны, которые покидают внешний проводник. Поскольку ионы Cu2 + (катионы) оседают на медный электрод, последний называется катодом . Соответственно цинковый электрод является анодом . Электрохимическая реакция:
Это та же реакция, что и в предыдущем примере. Кроме того, электроны текут через внешний проводник, что является основным применением гальванического элемента.
Как обсуждалось в разделе напряжение ячейки, электродвижущая сила ячейки представляет собой разницу потенциалов полуячейки, меру относительной легкости растворения двух электродов в электролите. ЭДС зависит как от электродов, так и от электролита, что указывает на то, что ЭДС имеет химическую природу.
Полуэлемент содержит металл в двух степенях окисления . Внутри изолированного полуэлемента происходит окислительно-восстановительная (окислительно-восстановительная) реакция, которая находится в химическом равновесии , состояние, которое символически записывается следующим образом (здесь «M» представляет собой катион металла, атом, имеющий дисбаланс заряда из-за потери « n » электронов):
Гальванический элемент состоит из двух полуэлементов, причем электрод одного полуэлемента состоит из металла А, а электрод другого полуэлемента состоит из металла В; окислительно-восстановительные реакции для двух отдельных полуэлементов следующие:
Общая сбалансированная реакция:
Другими словами, атомы металла одной полуячейки окисляются, а катионы металла другой полуячейки восстанавливаются. Разделяя металлы в двух полуячейках, их реакцию можно контролировать таким образом, чтобы заставить электроны переноситься через внешнюю цепь, где они могут выполнять полезную работу .
По определению:
Гальванические элементы по своей природе вырабатывают постоянный ток .
Ячейка Вестона имеет анод, состоящий из амальгамы кадмия и ртути , и катод, состоящий из чистой ртути. Электролит представляет собой (насыщенный) раствор сульфата кадмия . Деполяризатор представляет собой пасту сульфата ртути. Когда раствор электролита насыщен, напряжение ячейки очень воспроизводимо; поэтому в 1911 году он был принят в качестве международного стандарта напряжения.
Аккумулятор — это набор гальванических элементов, соединенных вместе для формирования единого источника напряжения. Например, типичная свинцово-кислотная батарея на 12 В имеет шесть гальванических элементов, соединенных последовательно, с анодами из свинца и катодами из диоксида свинца, оба погружены в серную кислоту . Большие аккумуляторные помещения , например, в телефонной станции, обеспечивающей центральное питание телефонов пользователей, могут иметь элементы, соединенные как последовательно, так и параллельно.
Напряжение ( электродвижущая сила E o ), создаваемое гальваническим элементом, можно оценить по стандартному изменению свободной энергии Гиббса в электрохимической реакции по формуле:
где ν e — число электронов, переданных в сбалансированных полуреакциях, а F — постоянная Фарадея . Однако ее можно определить более удобно, используя таблицу стандартных потенциалов для двух задействованных полуячеек . Первым шагом является идентификация двух металлов и их ионов, реагирующих в ячейке. Затем ищут стандартный электродный потенциал , E o , в вольтах , для каждой из двух полуреакций . Стандартный потенциал ячейки равен более положительному значению E o минус более отрицательное значение E o .
Например, на рисунке выше показаны растворы CuSO 4 и ZnSO 4. Каждый раствор имеет соответствующую металлическую полоску и солевой мостик или пористый диск, соединяющий два раствора и позволяющий SO2−
4ионы свободно течь между растворами меди и цинка. Для расчета стандартного потенциала можно посмотреть полуреакции меди и цинка и найти:
Таким образом, общая реакция имеет вид:
Стандартный потенциал реакции равен +0,34 В − (−0,76 В) = 1,10 В. Полярность ячейки определяется следующим образом. Металлический цинк сильнее восстанавливает, чем металлическая медь, поскольку стандартный (восстановительный) потенциал цинка более отрицателен, чем у меди. Таким образом, металлический цинк будет терять электроны в пользу ионов меди и приобретать положительный электрический заряд. Константа равновесия , K , для ячейки определяется по формуле:
где F — постоянная Фарадея , R — газовая постоянная , а T — температура в градусах Кельвина . Для ячейки Даниэля К приблизительно равен1,5 × 10 37 . Таким образом, в состоянии равновесия переносится несколько электронов, достаточных для того, чтобы вызвать зарядку электродов. [11]
Фактические потенциалы полуэлементов необходимо рассчитывать с использованием уравнения Нернста , поскольку растворенные вещества вряд ли будут находиться в своих стандартных состояниях:
где Q — коэффициент реакции . Когда заряды ионов в реакции равны, это упрощается до:
где {M n + } — активность иона металла в растворе. На практике вместо активности используется концентрация в моль/л. Металлический электрод находится в своем стандартном состоянии, поэтому по определению имеет единичную активность. Потенциал всей ячейки получается как разность потенциалов для двух полуячеек, поэтому он зависит от концентраций обоих растворенных ионов металла. Если концентрации одинаковы, и уравнение Нернста не требуется при принятых здесь условиях.
Значение 2,303 Р/Ф это1,9845 × 10−4 В /К , поэтому при 25 °C (298,15 К) потенциал полуэлемента изменится всего на 0,05918 В/ νe , если концентрация иона металла увеличится или уменьшится в 10 раз.
Эти расчеты основаны на предположении, что все химические реакции находятся в равновесии. Когда ток течет в цепи, условия равновесия не достигаются, и напряжение элемента обычно будет снижаться различными механизмами, такими как развитие перенапряжений . [12] Кроме того, поскольку химические реакции происходят, когда элемент вырабатывает энергию, концентрации электролита изменяются, и напряжение элемента снижается. Следствием температурной зависимости стандартных потенциалов является то, что напряжение, вырабатываемое гальваническим элементом, также зависит от температуры.
Гальваническая коррозия — это электрохимическая эрозия металлов. Коррозия происходит, когда два разнородных металла контактируют друг с другом в присутствии электролита , например, соленой воды. Это образует гальваническую ячейку, при этом на более благородном (менее активном) металле образуется газообразный водород. Результирующий электрохимический потенциал затем создает электрический ток, который электролитически растворяет менее благородный материал. Концентрационная ячейка может быть образована, если один и тот же металл подвергается воздействию двух различных концентраций электролита.