Hox-гены , подмножество гомеобоксных генов , представляют собой группу родственных генов , которые определяют области плана тела эмбриона вдоль оси голова-хвост животных. Белки Hox кодируют и определяют характеристики «положения», гарантируя, что правильные структуры формируются в правильных местах тела. Например, Hox-гены у насекомых определяют, какие придатки формируются на сегменте (например, ноги, усики и крылья у плодовых мух), а Hox-гены у позвоночных определяют типы и форму формирующихся позвонков. Таким образом, у сегментированных животных Hox-белки придают сегментарную или позиционную идентичность, но не образуют сами сегменты.
Исследования Hox-генов у реснитчатых личинок показали, что они экспрессируются только в тканях будущих взрослых особей. У личинок с постепенным метаморфозом Hox-гены активируются в тканях личиночного тела, обычно в области туловища, которые сохраняются за счет метаморфоза. У личинок с полным метаморфозом Hox-гены экспрессируются преимущественно в ювенильных зачатках и отсутствуют в транзиторных личиночных тканях. Личинки полухордовых видов Schizocardium Californicum и личинка пилидия Nemertea не экспрессируют Hox-гены. [1] [2]
Аналогию генам Hox можно провести с ролью режиссера, который определяет, какую сцену актеры должны разыграть следующей. Если режиссёр спектакля назовёт сцены не в том порядке, то и вся пьеса будет представлена в неправильном порядке. Точно так же мутации в генах Hox могут привести к тому, что части тела и конечности будут располагаться не в том месте. Как и режиссер пьесы, гены Hox сами не участвуют в пьесе и не участвуют в формировании конечностей.
Белковый продукт каждого Hox-гена является фактором транскрипции . Каждый ген Hox содержит хорошо консервативную последовательность ДНК , известную как гомеобокс, сокращением которого первоначально был термин «Hox». Однако в настоящее время термин Hox больше не эквивалентен гомеобоксу, поскольку гены Hox - не единственные гены, обладающие последовательностью гомеобокса; например, у людей имеется более 200 гомеобоксных генов, из которых 39 являются Hox-генами. [3] [4] Таким образом, Hox-гены представляют собой подмножество генов гомеобоксного фактора транскрипции. У многих животных организация Hox-генов в хромосоме такая же, как и порядок их экспрессии вдоль передне-задней оси развивающегося животного, и поэтому считается, что они демонстрируют коллинеарность. [5] [6] Продукция продуктов гена Hox в неправильном месте в организме связана с метаплазией и предрасполагает к онкологическим заболеваниям, например, пищевод Барретта является результатом изменения кодирования Hox и является предшественником рака пищевода . [7]
Продуктами Hox-генов являются Hox-белки. Hox-белки представляют собой подмножество факторов транскрипции, которые представляют собой белки, способные связываться со специфическими нуклеотидными последовательностями ДНК, называемыми энхансерами , посредством которых они либо активируют, либо подавляют сотни других генов. Один и тот же белок Hox может действовать как репрессор одного гена и активатор другого. Способность белков Hox связывать ДНК обеспечивается частью белка, называемой гомеодоменом . Гомеодомен представляет собой ДНК-связывающий домен длиной 60 аминокислот (кодируемый соответствующей последовательностью ДНК из 180 пар оснований , гомеобоксом). Эта аминокислотная последовательность складывается в мотив «спираль-поворот-спираль» (т.е. складка гомеодомена ), который стабилизируется третьей спиралью. Консенсусная полипептидная цепь показана ниже: [8] Белки Hox часто действуют в партнерстве с кофакторами, такими как белки PBC и Meis, кодируемые очень разными типами гомеобоксных генов. [9]
Спираль 1 Спираль 2 Спираль 3/4 ______________ __________ _________________RRRKRTAYTRYQLLELEKEFLFNRYLTRRRRRIELAHSLNLTERHIKIWFQNRRMKWKKEN....|....|....|....|....|....|....|....|....|....| ....|....| 10 20 30 40 50 60

Гены гомеобокса и, следовательно, мотив гомеодоменного белка обнаружены у большинства эукариот . Гены Hox, являющиеся подмножеством гомеобоксных генов, возникли совсем недавно в ходе эволюции в царстве животных или Metazoa . В животном мире Hox-гены присутствуют у билатерий [10] (животных с четкой осью от головы к хвосту), а также были обнаружены у книдарий , таких как морские анемоны . [11] Это означает, что гены Hox возникли более 550 миллионов лет назад. У билатерий Hox-гены часто располагаются в кластерах генов, хотя есть много исключений, когда гены были разделены хромосомными перестройками. [12] Сравнение последовательностей гомеодомена между Hox-белками часто выявляет большее сходство между видами, чем внутри вида; Это наблюдение привело к выводу, что кластеры генов Hox развились на ранних этапах эволюции животных из одного гена Hox посредством тандемной дупликации и последующей дивергенции, и что прототипный кластер генов Hox, содержащий по крайней мере семь различных генов Hox, присутствовал у общего предка всех билатеральных животных. животные. [10] [13]
У большинства двусторонних животных Hox-гены экспрессируются в шахматных доменах вдоль оси эмбриона от головы до хвоста, что указывает на то, что их роль в определении положения является общей древней особенностью. [14] Функциональная консервативность белков Hox может быть продемонстрирована тем фактом, что муха может в значительной степени функционировать с куриным белком Hox вместо своего собственного. [15] Таким образом, несмотря на то, что последний общий предок жил более 550 миллионов лет назад, [16] версия одного и того же Hox-гена у кур и мух достаточно схожа, чтобы воздействовать на одни и те же нижестоящие гены у мух.

Drosophila melanogaster — важная модель для понимания формирования и эволюции строения тела. Общие принципы и логика работы генов Hox, разъясненные на мухах, применимы ко всем двусторонним организмам, включая человека. У дрозофилы , как и у всех насекомых, имеется восемь Hox-генов. Они сгруппированы в два комплекса, оба из которых расположены на хромосоме 3. Комплекс Antennapedia (не путать с геном Antp ) состоит из пяти генов: лабиального ( lab ), хоботного ( pb ), деформированного ( Dfd ), полового. редуцированные гребни ( Sc ) и Антеннапедия ( Antp ). Комплекс Bithorax, названный в честь гена Ultrabithorax, состоит из оставшихся трех генов: Ultrabithorax ( Ubx ), брюшного-А ( abd-A ) и брюшного-В ( abd-B ).
Лабораторный ген является наиболее экспрессируемым геном . Он выражен в голове, прежде всего в интеркалярном сегменте (сегменте без придатков между антенной и нижней челюстью), а также в средней кишке. Потеря функции лаборатории приводит к неспособности эмбриона дрозофилы интернализировать структуры рта и головы, которые первоначально развиваются снаружи его тела (процесс, называемый инволюцией головы). Неудачная инволюция головы приводит к разрушению или удалению слюнных желез и глотки. Первоначально лабораторный ген был назван так потому , что он разрушал губной придаток; однако ген lab не экспрессируется в лабиальном сегменте, а фенотип лабиального придатка, вероятно, является результатом широкой дезорганизации, возникающей в результате неудачной инволюции головы. [17]
Ген pb отвечает за формирование губных и верхнечелюстных щупиков . Некоторые данные показывают, что pb взаимодействует с Scr . [18]
Ген Dfd отвечает за формирование верхнечелюстного и нижнечелюстного сегментов головы личинки. [19] Мутантные фенотипы Dfd аналогичны таковым у лабиальных. Потеря функции Dfd у эмбриона приводит к нарушению инволюции головы (см. лабиальный ген) с потерей личиночных структур головы. Мутации у взрослых вызывают либо делеции частей головы, либо трансформацию головы в торакальную. [17]
Ген Scr отвечает за развитие головного и грудного отделов эмбриона и взрослой особи дрозофилы . [20]
Второй грудной сегмент, или Т2, развивает пару ног и пару крыльев. Ген Antp определяет эту идентичность, способствуя формированию ног и позволяя (но не активируя напрямую) формирование крыльев. Доминантная мутация Antp , вызванная хромосомной инверсией , приводит к тому , что Antp экспрессируется в имагинальном диске усиков, так что вместо формирования антенны диск образует ножку, в результате чего нога выходит из головы мухи. [ нужна цитата ]

Третий грудной сегмент, или Т3, несет пару ног и пару жужжальца (сильно уменьшенные крылья, которые служат для балансирования во время полета). Ubx паттернирует T3 в основном за счет репрессии генов, участвующих в формировании крыльев. Лопатка крыла состоит из двух слоев клеток, которые плотно прилегают друг к другу и снабжаются питательными веществами несколькими жилками крыла. Один из многих генов, которые репрессирует Ubx, — это blistered, который активирует белки, участвующие в межклеточной адгезии, и spalt, который определяет расположение жилок крыльев. У мутантов с потерей функции Ubx Ubx больше не подавляет гены крыльев, и жужжальца развиваются как вторая пара крыльев, что приводит к появлению знаменитых четырехкрылых мух. Когда Ubx неправильно экспрессируется во втором грудном сегменте, как это происходит у мух с энхансерной мутацией «Cbx», он подавляет гены крыльев, и крылья развиваются как жужжальца, в результате чего образуется четырехдольная муха. [21]
У дрозофилы abd-A экспрессируется на большей части брюшка, от сегментов 1 (А1) до А8 . Экспрессия abd-A необходима для уточнения идентичности большинства сегментов брюшной полости. Основная функция abd-A у насекомых — подавление формирования конечностей. У мутантов abd-A с потерей функции брюшные сегменты от A2 до A8 трансформируются в идентичность, более похожую на A1. Когда abd-A эктопически экспрессируется по всему эмбриону, все сегменты перед A4 трансформируются в брюшную часть, подобную A4. [17] Ген abd -A также влияет на структуру образования кутикулы в эктодерме и структуру генерации мышц в мезодерме . [18]
Ген abd-B транскрибируется в двух разных формах: регуляторном белке и морфогенном белке. Регуляторный abd-B подавляет эмбриональные вентральные эпидермальные структуры в восьмом и девятом сегментах брюшка дрозофилы . В развитии хвостового сегмента участвуют как регуляторный белок, так и морфогенный белок. [18]
Обычно предполагается, что белки с высокой степенью сходства последовательностей обладают высокой степенью функционального сходства, т.е. предполагается, что Hox-белки с идентичными гомеодоменами обладают идентичными свойствами связывания ДНК (если только не известно, что дополнительные последовательности влияют на связывание ДНК). Чтобы определить набор белков двух разных видов, которые, скорее всего, будут наиболее похожи по функциям, используются схемы классификации. Для белков Hox существуют три различные схемы классификации: на основе филогенетического вывода, на основе синтении и на основе сходства последовательностей. [22] Три классификационные схемы предоставляют противоречивую информацию о белках Hox, экспрессируемых в середине оси тела ( Hox6-8 и Antp, Ubx и abd-A ). Комбинированный подход использовал информацию о различных видах, основанную на филогенетических выводах, и наносил типы последовательностей белков на филогенетическое дерево видов. Этот подход выявил белки, которые лучше всего представляют предковые формы ( Hox7 и Antp ), а также белки, которые представляют собой новые, производные версии (или были потеряны у предка и теперь отсутствуют у многих видов). [23]
Hox-гены действуют на многих уровнях в иерархиях генов развития: на «исполнительном» уровне они регулируют гены, которые, в свою очередь, регулируют большие сети других генов (например, генный путь, образующий придаток). Они также напрямую регулируют так называемые гены-реализаторы или эффекторные гены, которые действуют в нижней части таких иерархий, в конечном итоге формируя ткани, структуры и органы каждого сегмента. Сегментация включает в себя такие процессы, как морфогенез (дифференцировка клеток-предшественников в их терминальные специализированные клетки), тесная ассоциация групп клеток со сходной судьбой, формирование структур и границ сегментов посредством запрограммированной гибели клеток и перемещение клеток оттуда, где они находятся. первыми рождаются там, где они в конечном итоге будут функционировать, поэтому неудивительно, что гены-мишени Hox-генов способствуют делению клеток, клеточной адгезии, апоптозу и миграции клеток. [5]
Последовательность ДНК, связанная белком гомеодомена, содержит нуклеотидную последовательность ТААТ, причем 5'- концевой Т-конец является наиболее важным для связывания. [28] Эта последовательность консервативна почти во всех сайтах, распознаваемых гомеодоменами, и, вероятно, различает такие места как сайты связывания ДНК. Пары оснований, следующие за этой исходной последовательностью, используются для различения гомеодоменовых белков, все из которых имеют схожие сайты узнавания. Например, нуклеотид, следующий за последовательностью ТААТ, распознается аминокислотой в положении 9 гомеодоменного белка. В материнском белке Bicoid это положение занимает лизин , который узнает и связывается с нуклеотидом гуанином . У Antennapedia эту позицию занимает глутамин , который распознает аденин и связывается с ним . Если лизин в Bicoid заменить глютамином, полученный белок распознает сайты энхансеров, связывающихся с Antennapedia. [29] [30]
Однако все транскрипционные факторы, содержащие гомеодомен, связывают по существу одну и ту же последовательность ДНК. Последовательность, связанная с гомеодоменом белка Hox, имеет длину всего шесть нуклеотидов, и такую короткую последовательность можно было бы случайно обнаружить много раз по всему геному, что намного больше, чем количество фактических функциональных сайтов. Особенно в случае с Hox-белками, которые при неправильной экспрессии вызывают такие драматические изменения в морфологии, возникает вопрос о том, как каждый транскрипционный фактор может давать такие специфические и разные результаты, если все они связываются с одной и той же последовательностью. Одним из механизмов, который обеспечивает большую специфичность последовательностей ДНК для Hox-белков, является связывание белковых кофакторов. Двумя такими кофакторами Hox являются Extradenticle (Exd) и гомоторакс (Hth). Exd и Hth связываются с белками Hox и, по-видимому, вызывают конформационные изменения в белке Hox, которые повышают его специфичность. [31]
Точно так же, как гены Hox регулируют гены-реализаторы, они, в свою очередь, сами регулируются другими генами. У дрозофилы и некоторых насекомых (но не у большинства животных) Hox-гены регулируются генами разрывов и генами парного правила , которые, в свою очередь, регулируются мРНК , поставляемой материнским путем . Это приводит к каскаду транскрипционных факторов: материнские факторы активируют гены пробелов или парных правил; гены пробелов и парных правил активируют Hox-гены; затем, наконец, Hox-гены активируют гены-реализаторы, которые вызывают дифференцировку сегментов развивающегося эмбриона.
Регуляция достигается за счет градиентов концентрации белка, называемых морфогенными полями . Например, высокие концентрации одного материнского белка и низкие концентрации других активируют определенный набор генов пробелов или парных правил. У мух полоса 2 эмбриона активируется материнскими белками Bicoid и Hunchback, но репрессируется белками разрыва Giant и Kruppel. Таким образом, полоса 2 будет формироваться только там, где есть Бикоид и Горбун, но не там, где есть Великан и Круппель. [32]
Было показано, что нити микроРНК , расположенные в кластерах Hox, ингибируют большее количество передних генов hox («феномен задней распространенности»), возможно, для лучшей настройки характера его экспрессии. [33]
Было показано, что некодирующая РНК (нкРНК) содержится в большом количестве в Hox-кластерах. У человека может присутствовать 231 нкРНК. Один из них, HOTAIR , подавляет транс (он транскрибируется из кластера HOXC и ингибирует поздние гены HOXD) путем связывания с белками группы Polycomb (PRC2). [34]
Структура хроматина важна для транскрипции, но она также требует , чтобы кластер выходил за пределы территории хромосомы . [35]
У высших животных, включая человека, ретиноевая кислота регулирует дифференциальную экспрессию Hox-генов вдоль переднезадней оси. [36] Гены на 3'-концах Hox-кластеров индуцируются ретиноевой кислотой, в результате чего домены экспрессии простираются дальше в организме по сравнению с 5'-концами Hox-генов, которые не индуцируются ретиноевой кислотой, в результате чего домены экспрессии остаются более задними.
Количественная ПЦР показала несколько тенденций в отношении колинеарности: система находится в равновесии, а общее количество транскриптов зависит от количества присутствующих генов согласно линейной зависимости. [37]
У некоторых организмов, особенно у позвоночных, различные Hox-гены расположены очень близко друг к другу на хромосоме группами или кластерами. Порядок генов в хромосоме такой же, как и экспрессия генов в развивающемся эмбрионе, при этом первый ген экспрессируется в переднем конце развивающегося организма. Причина этой колинеарности еще полностью не ясна, но может быть связана с активацией Hox-генов во временной последовательности путем постепенной распаковки хроматина вдоль кластера генов.
Гены Hox названы в честь гомеотических фенотипов, возникающих при нарушении их функции, когда один сегмент развивается аналогично другому (например, ноги там, где должны быть усики). Hox-генам в разных типах были присвоены разные названия, что привело к путанице в номенклатуре. Комплект Hox-генов у дрозофилы состоит из двух кластеров: комплекса Antennapedia и комплекса Bithorax, которые вместе исторически назывались HOM-C (от гомеотического комплекса). Хотя исторически гены HOM-C относились к гомологам дрозофилы , а гены Hox относились к гомологам позвоночных, это различие больше не проводится, и гены HOM-C и Hox называются Hox-генами. [ нужна цитата ]
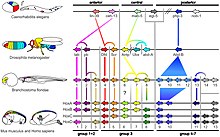
Мыши и люди имеют 39 Hox-генов в четырех кластерах: [38] [39]
У предков позвоночных животных был один кластер генов Hox, [40] [41] [ нужна ссылка ] , который был дублирован (дважды) на ранних этапах эволюции позвоночных путем дупликации всего генома , чтобы дать четыре кластера генов Hox: Hoxa, Hoxb, Hoxc и Hoxd. В настоящее время неясно, произошли ли эти дупликации до или после отделения миног и миксин от других позвоночных. [42] Большинство четвероногих имеют четыре кластера HOX, в то время как большинство костистых рыб , включая рыбок данио и медаку , имеют семь или восемь кластеров генов Hox из-за дополнительной дупликации генома , которая произошла в их эволюционной истории. [43] [38] У рыбок данио один из восьми кластеров генов Hox (кластер Hoxd) потерял все гены, кодирующие белки, и только один ген микроРНК отмечает местоположение исходного кластера. [44] У некоторых костистых рыб, таких как лосось, произошла еще более недавняя дупликация генома, в результате которой семь или восемь кластеров Hox-генов удвоились, что дало как минимум 13 кластеров [45]
Тела позвоночных сегментированы не так, как у насекомых; в среднем они намного сложнее, что приводит к большей инфраструктуре их тела по сравнению с насекомыми. Гены HOX контролируют регуляцию и развитие многих ключевых структур организма, таких как сомиты , которые образуют позвонки и ребра, дерму кожи спины, скелетные мышцы спины, а также скелетные мышцы стенки тела и конечностей. . Гены HOX помогают дифференцировать сомитные клетки в более специфические и направляют их развитие по-разному в зависимости от того, где они находятся в организме. [46] Большая разница между позвоночными и беспозвоночными заключается в расположении и расположении слоев HOX-генов. Фундаментальные механизмы развития прочно консервативны у позвоночных, от рыб до млекопитающих.
Из-за того, что гены НОХ настолько консервативны, большинство исследований было проведено на гораздо более простых модельных организмах, таких как мыши. Одно из основных различий, которое было замечено при сравнении мышей и дрозофилы , в частности, связано с расположением и наслаиванием генов НОХ внутри генома . У позвоночных действительно есть гены HOX, гомологичные генам мух, поскольку это один из наиболее консервативных генов , но их расположение другое. Например, на 5'-стороне сегмента мыши находится больше генов НОХ, чем у беспозвоночных. [47] Эти гены соответствуют экспрессии в хвосте, что имеет смысл, поскольку у мух нет ничего похожего на хвост, который есть у всех позвоночных. Кроме того, у большинства позвоночных имеется 39 членов, разделенных на четыре отдельных плотно сгруппированных массива генов (A–D) на четырех отдельных хромосомах , тогда как у дрозофилы всего восемь генов HOX. [48] Кластеры гораздо более избыточны и с меньшей вероятностью вызывают мутации . У мух один ген может мутировать, в результате чего жужжальца , что-то фундаментальное для их способности летать, превращается в крыло, или антенна превращается в ногу; у мыши необходимо одновременно удалить от двух до четырех генов, чтобы получить аналогичную полную трансформацию. Некоторые исследователи полагают, что из-за избыточности плана HOX-кластеров позвоночных и большей ограниченности по сравнению с HOX-кластерами беспозвоночных способность к развитию HOX-кластеров позвоночных по какой-то структурной или функциональной причине намного ниже, чем у их аналогов у беспозвоночных. [49] Такая быстрая эволюция отчасти объясняется тем, что беспозвоночные пережили гораздо более драматические эпизоды адаптивной радиации и мутаций. Более 20 основных клад беспозвоночных настолько радикально различаются по организации тела, отчасти из-за более высокой частоты мутаций, что их стали формально классифицировать как разные типы . [50] Все паралогичные гены должны быть нокаутированы, чтобы по большей части произошли какие-либо фенотипические изменения. Это также одна из причин, почему гомеотические мутации у позвоночных наблюдаются так редко.
У эмбрионов мышей гены HOX10, один из генов, расположенных в хвостовой части животного, отключают систему «строительства ребер», когда ген активируется. Гены активны в нижней части спины, где из позвонков не растут ребра, и неактивны в средней части спины, позволяя формироваться ребрам. Когда паралоги HOX10 экспериментально инактивируются, в позвонках нижней части спины растут ребра. [51] Это исследование побудило эволюционный поиск этих мутаций среди всех животных. Примером этого являются ящерицы и змеи. Таким образом, у змей гены HOX10 утратили способность блокировать ребра. [52]
Amphioxus , такие как Branchiostoma floridae, имеют один Hox-кластер с 15 генами, известный от AmphiHox1 до AmphiHox15 . [53]
Шесть Hox-генов рассеяны в геноме круглого червя Caenorhabditis elegans . [10] : рис. 3 Hydra и Nematostella vectensis , принадлежащие к типу Cnidaria , имеют несколько Hox/ParaHox-подобных гомеобоксных генов. [54] [11]
Экспрессия Hox-гена также изучалась у брахиопод , [55] кольчатых червей , [56] и ряда моллюсков . [57]
Гены Hox названы так потому, что мутации в них вызывают гомеотические трансформации . Гомеотические трансформации были впервые идентифицированы и изучены Уильямом Бейтсоном в 1894 году, который ввел термин «гомеозис». После повторного открытия генетических принципов Менделя Бейтсон и другие поняли, что некоторые примеры гомеозиса в органах цветков и скелетах животных можно объяснить вариациями генов.
Окончательные доказательства генетической основы некоторых гомеотических трансформаций были получены путем выделения гомеозисных мутантов. Первый гомеозисный мутант был обнаружен Кэлвином Бриджесом в лаборатории Томаса Ханта Моргана в 1915 году. Этот мутант демонстрирует частичное дублирование грудной клетки и поэтому был назван Битораксом ( bx ). Он трансформирует третий грудной сегмент (Т3) в сторону второго (Т2). Биторакс возник спонтанно в лаборатории и с тех пор постоянно поддерживается в качестве лабораторного фонда. [58]
Генетические исследования Моргана и других легли в основу систематического анализа Эдварда Б. Льюиса и Томаса Кауфмана, который дал предварительные определения многих гомеотических генов комплексов Bithorax и Antennapedia, а также показал, что мутантные фенотипы для большинства из них Гены могут быть связаны с дефектами паттерна строения эмбрионального тела.
Эд Льюис , Кристиана Нюсляйн-Фольхард и Эрик Ф. Вишаус идентифицировали и классифицировали 15 генов, имеющих ключевое значение в определении строения тела и формировании сегментов тела плодовой мухи D. melanogaster в 1980 году . [59] За свою работу Льюис, Нюсляйн-Фольхард и Вишаус были удостоены Нобелевской премии по физиологии и медицине в 1995 году . [60]
В 1983 году гомеобокс был независимо открыт исследователями в двух лабораториях: Эрнстом Хафеном, Майклом Левином и Уильямом Макгиннисом (в лаборатории Уолтера Геринга в Базельском университете , Швейцария) и Мэтью П. Скоттом и Эми Вайнер (в работе Томаса Кауфмана). лаборатории Университета Индианы в Блумингтоне ).
Hox-гены играют решающую роль в развитии таких структур, как конечности, легкие, нервная система и глаза. Как заметили в 2006 году Т. Р. Лаппин и его коллеги: «Эволюционная консервация предоставляет неограниченные возможности для экспериментального исследования функционального контроля сети генов Hox, что дает важную информацию о болезнях человека». В будущем могут быть проведены дополнительные исследования по изучению роли Hox-генов в лейкемии и раке (например, EOC). [38]