Гидриды переходных металлов представляют собой химические соединения , содержащие переходный металл, связанный с водородом . Большинство переходных металлов образуют гидридные комплексы, а некоторые играют важную роль в различных каталитических и синтетических реакциях. Термин «гидрид» используется широко: некоторые из них являются кислыми (например, H 2 Fe(CO) 4 ), тогда как некоторые другие являются гидридными, имеющими H - подобный характер (например, ZnH 2 ).
Многие переходные металлы образуют соединения с водородом. Эти материалы называются бинарными гидридами, поскольку они содержат только два элемента. Предполагается, что водородный лиганд имеет гидридный (H -- подобный) характер. Эти соединения неизменно нерастворимы во всех растворителях, что отражает их полимерную структуру. Они часто обладают металлоподобной электропроводностью. Многие из них являются нестехиометрическими соединениями . Электроположительные металлы ( Ti , Zr , Hf , Zn ) и некоторые другие металлы образуют гидриды со стехиометрией MH или иногда MH 2 (M = Ti , Zr , Hf, V, Zn ). Наиболее изучены бинарные гидриды палладия , легко образующие предельный моногидрид. Фактически, газообразный водород диффундирует через окна Pd через посредство PdH. [1]
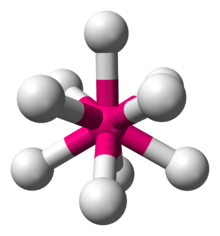
Гидриды тройных металлов имеют формулу A x MH n , где A + представляет собой катион щелочного или щелочноземельного металла, например K + и Mg 2+ . Знаменитым примером является K 2 ReH 9 , соль, содержащая два иона K + и анион ReH 9 2- . Другие гомолептические гидриды металлов включают анионы Mg 2 FeH 6 и Mg 2 NiH 4 . Некоторые из этих анионных полигидридов удовлетворяют правилу 18 электронов , многие — нет. Из-за высокой энергии решетки эти соли обычно не растворяются ни в каких растворителях, за исключением K 2 ReH 9 . [3]
Наиболее распространенными гидридами переходных металлов являются металлокомплексы , которые помимо гидрида содержат смесь лигандов. Диапазон колигандов широк. Практически все металлы образуют такие производные. К основным исключениям относятся поздние металлы серебро, золото, кадмий и ртуть , которые образуют малочисленные или нестабильные комплексы с прямыми связями MH. Примерами промышленно полезных гидридов являются HCo(CO) 4 и HRh (CO)(PPh 3 ) 3 , которые являются катализаторами гидроформилирования .

О первых молекулярных гидридах переходных металлов впервые сообщили в 1930-х годах Уолтер Хибер и его коллеги. Они описали H 2 Fe(CO) 4 и HCo(CO) 4 . После нескольких лет перерыва и после публикации немецких военных документов о постулируемой роли HCo(CO) 4 в гидроформилировании , в середине 1950-х годов три известные группы металлоорганической химии сообщили о нескольких новых гидридах: HRe(C 5 H 5 ) 2 Джеффри Уилкинсона , HMo(C 5 H 5 )(CO) 3 Э.О. Фишера и HPtCl(PEt 3 ) 2 Джозефа Чатта . [4] Сейчас известны тысячи таких соединений.
Подобно координационным комплексам гидрида, многие кластеры содержат концевые (связанные одной связью M–H) гидридные лиганды. Гидридные лиганды также могут соединять пары металлов, как показано на примере [HW 2 (CO) 10 ] - . Кластер H 2 Os 3 (CO) 10 содержит как концевые, так и двумостиковые гидридные лиганды. Гидриды также могут охватывать треугольную грань кластера, как в [Ag 3 {(PPh 2 ) 2 CH 2 } 3 (μ 3 -H)(μ 3 -Cl)]BF 4 . [5] В кластере [Co 6 H(CO) 15 ] − гидрид является «межузельным», занимая положение в центре октаэдра Co 6 . Отнесение кластерных гидридов может оказаться затруднительным, как иллюстрируют исследования реагента Страйкера [Cu 6 (PPh 3 ) 6 H 6 ]. [6]
Нуклеофильные гидриды основной группы превращают многие галогениды и катионы переходных металлов в соответствующие гидриды:
Эти превращения представляют собой реакции метатезиса, и гидридность продукта обычно меньше, чем у донора гидрида. Классические (и относительно дешевые) реагенты-доноры гидрида включают боргидрид натрия и алюмогидрид лития . В лаборатории больший контроль часто обеспечивают «смешанные гидриды», такие как триэтилборгидрид лития и Red-Al . Гидриды щелочных металлов, например гидрид натрия , обычно не являются полезными реагентами.
Удаление бета-гидрида и удаление альфа-гидрида - это процессы, в результате которых образуются гидриды. Первый - общий путь обрыва при гомогенной полимеризации . Это также позволяет синтезировать некоторые гидридные комплексы переходных металлов из литийорганических соединений и реактивов Гриньяра :
Окислительное присоединение диводорода к низковалентному центру переходного металла является обычным явлением. Некоторые металлы напрямую реагируют с H 2 , хотя обычно требуется нагревание до нескольких сотен градусов. Одним из примеров является дигидрид титана , который образуется при нагревании губки титана до 400–700 °C в атмосфере водорода. Эти реакции обычно требуют металлов с большой площадью поверхности. Прямая реакция металлов с H 2 является стадией каталитического гидрирования .
Классический пример решения — комплекс Васьки : [7]
Окислительное присоединение также может происходить к диметаллическим комплексам, например:
Многие кислоты участвуют в окислительном присоединении, о чем свидетельствует добавление HCl к комплексу Васки:
Некоторые гидриды металлов образуются при обработке металлокомплекса водородом в присутствии основания. Реакция не сопровождается изменением степени окисления металла и может рассматриваться как расщепление H 2 на гидрид (который связывается с металлом) и протон (который связывается с основанием).
Предполагается, что в такой реакции участвуют диводородные комплексы . Бифункциональные катализаторы таким образом активируют H 2 .
Значения смещаются на <6 кДж/моль при замене CO на фосфиновый лиганд.
Связь MH в принципе может расщепляться с образованием протона, водородного радикала или гидрида. [9]
Хотя эти свойства взаимосвязаны, они не являются взаимозависимыми. Гидрид металла может быть термодинамически слабой кислотой и слабым донором H - ; он также может быть силен в одной категории, но не в другой, или силен в обеих. Сила H - гидрида, также известная как его способность донора гидрида или гидридность, соответствует силе основания гидрида по Льюису. Не все гидриды являются мощными основаниями Льюиса. Сила основания гидридов варьируется так же, как и pK a протонов. Эту гидроксидность можно измерить путем гетеролитического расщепления водорода между металлокомплексом и основанием с известным pK a и последующим измерением полученного равновесия. Это предполагает, что гидрид не реагирует гетеролитически или гомолитически сам с собой с реформированием водорода. Комплекс будет гомолитически реагировать сам с собой, если гомолитическая связь MH стоит менее половины гомолитической связи HH. Даже если прочность гомолитической связи превышает этот порог, комплекс все равно восприимчив к радикальным реакциям.
Комплекс будет гетеролитически реагировать сам с собой, если он одновременно является сильной кислотой и сильным гидридом. Это преобразование приводит к диспропорционированию с образованием пары комплексов со степенями окисления , отличающимися двумя электронами. Возможны дальнейшие электрохимические реакции .
Как отмечалось, некоторые комплексы гетеролитически расщепляют диводород в присутствии основания. Часть этих комплексов образует гидридные комплексы, достаточно кислые, чтобы их можно было депротонировать во второй раз основанием. В этой ситуации исходный комплекс может быть восстановлен двумя электронами с водородом и основанием. Даже если гидрид недостаточно кислый, чтобы его можно было депротонировать, он может гомолитически реагировать сам с собой, как обсуждалось выше, с общим одноэлектронным восстановлением.
Сродство гидридного лиганда к кислоте Льюиса называется его гидридностью:
Поскольку гидрид не существует в виде стабильного аниона в растворе, эта константа равновесия (и связанная с ней свободная энергия) рассчитывается на основе измеримых равновесий. Ориентиром является гидричность протона, которая в растворе ацетонитрила рассчитывается как -76 ккал моль -1 : [10]
По сравнению с протоном большинство катионов проявляют меньшее сродство к H − . Вот некоторые примеры:
Эти данные позволяют предположить, что [HPt(dmpe) 2 ] + может быть сильным донором гидрида, что отражает относительно высокую стабильность [Pt(dmpe) 2 ] 2+ . [11]
Скорость переноса протона к металлокомплексам и между ними часто бывает низкой. [12] Многие гидриды недоступны для изучения с помощью термодинамических циклов Бордвелла . В результате кинетические исследования используются для выяснения обоих соответствующих термодинамических параметров. Обычно гидриды, полученные из переходных металлов первого ряда, демонстрируют наиболее быструю кинетику, за ней следуют комплексы металлов второго и третьего ряда.
Определение структуры гидридов металлов может быть сложной задачей, поскольку гидридные лиганды плохо рассеивают рентгеновские лучи, особенно по сравнению с присоединенным металлом. Следовательно, расстояния MH часто недооцениваются, особенно в ранних исследованиях. Часто наличие гидридного лиганда определялось по отсутствию лиганда в очевидном координационном сайте. Традиционно структуру гидридов металлов изучали с помощью нейтронографии, поскольку водород сильно рассеивает нейтроны. [13]
Металлокомплексы, содержащие концевые гидриды, распространены. В би- и полиядерных соединениях гидриды обычно являются мостиковыми лигандами . Многие из этих мостиковых гидридов являются олигомерными, например, реагент Страйкера . [14] [(Ph 3 P)CuH] 6 и кластеры, такие как [Rh 6 (PR 3 ) 6 H 12 ] 2+ . [15] Конечным связующим мотивом является неклассический дигидрид, также известный как диводородные аддукты сигма-связи или просто диводородные комплексы. Комплекс [W(PR 3 ) 2 (CO) 3 (H 2 )] был первым хорошо охарактеризованным примером как неклассического дигидрида, так и комплекса сигма-связей в целом. [16] [17] Рентгеновская дифракция, как правило, недостаточна для обнаружения гидридов в кристаллических структурах, поэтому их расположение необходимо предполагать. Чтобы однозначно кристаллографически определить местонахождение гидрида вблизи тяжелого атома, требуется дифракция нейтронов . Неклассические гидриды также изучались с помощью различных методов ЯМР с переменной температурой и HD-соединений.
Гидриды поздних переходных металлов характерно демонстрируют сдвиги в сильное поле в своих спектрах ЯМР протонов . Обычно сигнал M- H появляется в диапазоне от δ-5 до -25, причем многие примеры выходят за пределы этого диапазона, но обычно все они появляются при значениях ниже 0 ppm. Большие сдвиги возникают из-за влияния возбужденных состояний и сильной спин-орбитальной связи [18] (напротив, для органических соединений сдвиги 1 H ЯМР обычно происходят в диапазоне δ12-1). На одном полюсе находится комплекс 16e IrHCl 2 (PMe( t -Bu) 2 ) 2 со сдвигом -50,5. Сигналы часто демонстрируют спин-спиновую связь с другими лигандами, например фосфинами. [19]
Гидриды металлов демонстрируют ИК-полосы около 2000 см -1 для ν M-H , хотя их интенсивности варьируются. [4] Эти сигналы можно идентифицировать по маркировке дейтерием.
В 1844 году был описан плохо определенный гидрид меди, образовавшийся в результате обработки солей меди фосфорноватистой кислотой . Впоследствии было обнаружено, что газообразный водород поглощается смесями солей переходных металлов и реактивами Гриньяра . [20]
Первым четко определенным комплексом гидрида металла был H 2 Fe(CO) 4 , полученный низкотемпературным протонированием карбонильного аниона железа. Следующим описанным гидридным комплексом был (C 5 H 5 ) 2 ReH. Последний комплекс был охарактеризован методом ЯМР-спектроскопии , что продемонстрировало полезность этого метода при изучении металлогидридных комплексов. [20] В 1957 году Джозеф Чатт, Бернард Л. Шоу и Л. А. Дункансон описали транс -PtHCl(PEt 3 ) 2 первый неметаллоорганический гидрид (т.е. не имеющий связи металл-углерод). Было показано, что он устойчив на воздухе, что исправило давнее предубеждение о нестабильности гидридов металлов. [21]