В органической химии енолы являются типом функциональной группы или промежуточного соединения в органической химии, содержащего группу с формулой C=C(OH) (R = много заместителей). Термин енол является аббревиатурой от алкенола , портманто, полученного из "-ен"/"алкен" и "-ол". Известно много видов енолов. [1]
Кето-енольная таутомерия относится к химическому равновесию между «кето»-формой ( карбонил , названный в честь распространенного случая кетона ) и енолом. Взаимопревращение двух форм включает перенос альфа-атома водорода и реорганизацию связывающих электронов . Кето- и енольная формы являются таутомерами друг друга. [2]
Органические эфиры , кетоны и альдегиды с α-водородом ( связь C−H, примыкающая к карбонильной группе ) часто образуют енолы. Реакция включает миграцию протона ( H ) от углерода к кислороду: [1]
В случае кетонов превращение называется кето-енольной таутомерией, хотя это название часто применяется в более общем смысле ко всем таким таутомеризациям. Обычно константа равновесия настолько мала, что енол не обнаруживается спектроскопически.
В некоторых соединениях с двумя (или более) карбонилами енольная форма становится доминирующей. Поведение 2,4-пентандиона иллюстрирует этот эффект: [3]
Енолы являются производными винилового спирта с C=C−OH связью. Депротонирование органических карбонилов дает енолят-анион , который является сильным нуклеофилом . Классический пример в пользу кето-формы можно увидеть в равновесии между виниловым спиртом и ацетальдегидом (K = [енол]/[кето] ≈ 3 × 10−7 ). В 1,3-дикетонах , таких как ацетилацетон (2,4-пентандион), предпочтительна енольная форма.
Катализируемое кислотой превращение енола в кетоформу происходит путем переноса протона от O к углероду. Процесс не происходит внутримолекулярно, а требует участия растворителя или других медиаторов.
Если R 1 и R 2 (обратите внимание на уравнение в верхней части страницы) являются разными заместителями, то при преобразовании енола в кето-форму в альфа-положении образуется новый стереоцентр. В зависимости от природы трех групп R, в этой ситуации получающиеся продукты будут диастереомерами или энантиомерами . [ необходима цитата ]
Энедиолы — это алкены с гидроксильной группой на каждом атоме углерода двойной связи C=C. Обычно такие соединения являются нежелательными компонентами в равновесии с ацилоинами . Одним из особых случаев является катехол , где субъединица C=C является частью ароматического кольца. Однако в некоторых других случаях энедиолы стабилизируются фланкирующими карбонильными группами. Эти стабилизированные энедиолы называются редуктонами . Такие виды важны в гликохимии, например, в преобразовании Лобри де Брюйна-ван Экенштейна . [5]

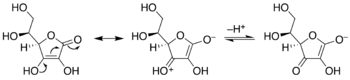
Рибулозо-1,5-бисфосфат является ключевым субстратом в цикле Кальвина фотосинтеза . В цикле Кальвина рибулоза уравновешивается энедиолом, который затем связывает углекислый газ . Тот же энедиол также подвержен атаке кислорода (O 2 ) в (нежелательном) процессе, называемом фотодыхание .
Фенолы представляют собой разновидность енола. Для некоторых фенолов и родственных соединений кето-таутомер играет важную роль. Многие реакции резорцина включают кето-таутомер, например. Нафталин-1,4-диол существует в наблюдаемом равновесии с дикетоном тетрагидронафталин-1,4-дионом. [6]
Кето-енольная таутомерия важна в нескольких областях биохимии . [ необходима ссылка ]
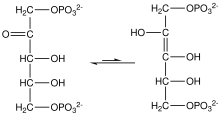
Высокий потенциал переноса фосфата фосфоенолпируватом обусловлен тем, что фосфорилированное соединение «заключается» в менее термодинамически выгодной енольной форме, тогда как после дефосфорилирования оно может принять кето-форму. [ необходима цитата ]
Фермент енолаза катализирует дегидратацию 2-фосфоглицериновой кислоты до енолфосфатного эфира. Метаболизм PEP в пировиноградную кислоту пируваткиназой (PK) генерирует аденозинтрифосфат (АТФ) через фосфорилирование на уровне субстрата . [7]
Конец двойной связи в енолах является нуклеофильным . Его реакции с электрофильными органическими соединениями важны как в биохимии, так и в синтетической органической химии . В первой области фиксация диоксида углерода включает присоединение CO2 к енолу. [ необходима цитата ]
Депротонирование енолизируемых кетонов, альдегидов и эфиров дает еноляты . [8] [9] Еноляты можно захватить путем добавления электрофилов к кислороду. Силилирование дает эфир силил енола . [10] Ацилирование дает эфиры, такие как винилацетат . [11]
В целом, енолы менее стабильны, чем их кето-эквиваленты из-за предпочтительности двойной связи C=O по сравнению с двойной связью C=C. Однако енолы могут быть стабилизированы кинетически или термодинамически. [ необходима цитата ]
Некоторые енолы достаточно стабилизированы кинетически, чтобы их можно было охарактеризовать. [ необходима цитата ]
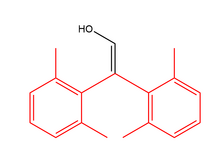
Делокализация может стабилизировать енольный таутомер. Таким образом, очень стабильные енолы — это фенолы . [13] Другим стабилизирующим фактором в 1,3-дикарбонилах является внутримолекулярная водородная связь. [14] Оба эти фактора влияют на равновесие енол-дион в ацетилацетоне.