Заживление ран относится к замене живым организмом разрушенной или поврежденной ткани новой тканью. [1]
В неповрежденной коже эпидермис (поверхностный, эпителиальный слой) и дерма (более глубокий, соединительный слой) образуют защитный барьер от внешней среды. Когда барьер нарушается, запускается регулируемая последовательность биохимических событий для восстановления повреждения. [1] [2] Этот процесс делится на предсказуемые фазы: свертывание крови ( гемостаз ), воспаление , рост ткани ( пролиферация клеток ) и ремоделирование ткани (созревание и дифференциация клеток ). Свертывание крови можно считать частью стадии воспаления, а не отдельной стадией. [3]

Процесс заживления ран не только сложен, но и хрупок, и он подвержен прерыванию или сбою, что приводит к образованию незаживающих хронических ран . Факторами, способствующими образованию незаживающих хронических ран, являются диабет, венозные или артериальные заболевания, инфекции и метаболические нарушения в пожилом возрасте. [4]
Уход за ранами способствует и ускоряет заживление ран посредством очистки и защиты от повторного повреждения или инфекции. В зависимости от потребностей каждого пациента, он может варьироваться от простейшей первой помощи до целых сестринских специальностей, таких как уход за ранами, стомой и недержанием, а также уход в ожоговом центре .
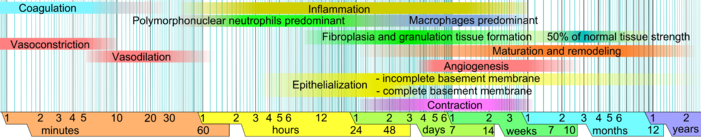
Время имеет важное значение для заживления ран. Критически важно, что время реэпителизации раны может определить исход заживления. [11] Если эпителизация ткани на оголенной области происходит медленно, рубец будет формироваться в течение многих недель или месяцев; [12] [13] Если эпителизация раневой области происходит быстро, заживление приведет к регенерации. [13]

Заживление ран классически делится на гемостаз , воспаление, пролиферацию и ремоделирование. Хотя эта модель является полезной конструкцией, она использует значительное перекрытие между отдельными фазами. Недавно была описана дополнительная модель [1] , в которой более четко очерчены многие элементы заживления ран. Важность этой новой модели становится более очевидной благодаря ее полезности в областях регенеративной медицины и тканевой инженерии (см. раздел «Исследования и разработки» ниже). В этой конструкции процесс заживления ран делится на две основные фазы: раннюю фазу и клеточную фазу : [1]
Ранняя фаза, которая начинается сразу после повреждения кожи, включает каскад молекулярных и клеточных событий, приводящих к гемостазу и формированию раннего временного внеклеточного матрикса, который обеспечивает структурную стадию для прикрепления клеток и последующей клеточной пролиферации.
Клеточная фаза включает в себя несколько типов клеток, работающих вместе для создания воспалительной реакции, синтеза грануляционной ткани и восстановления эпителиального слоя. [1] Подразделения клеточной фазы:
Непосредственно перед началом воспалительной фазы происходит каскад свертывания крови для достижения гемостаза или остановки потери крови посредством фибринового сгустка. После этого высвобождаются различные растворимые факторы (включая хемокины и цитокины), привлекающие клетки, которые фагоцитируют мусор, бактерии и поврежденную ткань, а также высвобождают сигнальные молекулы, которые инициируют пролиферативную фазу заживления ран.
Когда ткань впервые повреждается, кровь вступает в контакт с коллагеном , заставляя тромбоциты выделять воспалительные факторы. [15] Тромбоциты также экспрессируют липкие гликопротеины на своих клеточных мембранах , которые позволяют им агрегировать , образуя массу. [7]
Фибрин и фибронектин сшиваются вместе и образуют пробку, которая улавливает белки и частицы и предотвращает дальнейшую потерю крови. [16] Эта фибрин-фибронектиновая пробка также является основной структурной опорой раны до тех пор, пока не отложится коллаген. [7] Мигрирующие клетки используют эту пробку в качестве матрицы для перемещения, а тромбоциты прилипают к ней и секретируют факторы. [7] Сгусток в конечном итоге лизируется и заменяется грануляционной тканью , а затем коллагеном.
Тромбоциты, клетки, присутствующие в наибольшем количестве вскоре после возникновения раны, выделяют в кровь медиаторы, включая цитокины и факторы роста . [15] Факторы роста стимулируют клетки, чтобы ускорить их деление. Тромбоциты выделяют другие провоспалительные факторы, такие как серотонин , брадикинин , простагландины , простациклины , тромбоксан и гистамин , [3] , которые служат нескольким целям, включая усиление пролиферации и миграции клеток в эту область и заставляя кровеносные сосуды становиться расширенными и пористыми . Во многих отношениях экстравазированные тромбоциты при травме выполняют функцию, аналогичную тканевым макрофагам и тучным клеткам, подвергающимся воздействию микробных молекулярных сигнатур при инфекции: они активируются и секретируют молекулярные медиаторы — вазоактивные амины, эйкозаноиды и цитокины , — которые инициируют воспалительный процесс.
Сразу после разрыва кровеносного сосуда разорванные клеточные мембраны высвобождают воспалительные факторы, такие как тромбоксаны и простагландины , которые вызывают спазм сосуда, чтобы предотвратить потерю крови и собрать воспалительные клетки и факторы в этой области. [3] Это сужение сосудов длится от пяти до десяти минут и сопровождается вазодилатацией , расширением кровеносных сосудов, которое достигает пика примерно через 20 минут после ранения. [3] Вазодилатация является результатом факторов, высвобождаемых тромбоцитами и другими клетками. Основным фактором, вызывающим вазодилатацию, является гистамин . [3] [15] Гистамин также делает кровеносные сосуды пористыми, позволяя тканям становиться отечными, поскольку белки из кровотока просачиваются во внесосудистое пространство, что увеличивает его осмолярную нагрузку и притягивает воду в эту область. [3] Повышенная пористость кровеносных сосудов также облегчает проникновение воспалительных клеток, таких как лейкоциты, в место раны из кровотока . [17] [18]
В течение часа после ранения полиморфноядерные нейтрофилы (ПМН) прибывают в место ранения и становятся преобладающими клетками в ране в течение первых двух дней после получения травмы, с особенно большим количеством на второй день. [19] Их привлекают к месту фибронектин, факторы роста и такие вещества, как кинины . Нейтрофилы фагоцитируют мусор и убивают бактерии, высвобождая свободные радикалы в так называемом респираторном взрыве . [20] [21] Они также очищают рану, секретируя протеазы , которые разрушают поврежденную ткань. Функциональные нейтрофилы в месте раны имеют продолжительность жизни только около двух дней, поэтому они обычно подвергаются апоптозу после того, как они выполнили свои задачи и были поглощены и разрушены макрофагами . [22]
Другие лейкоциты, которые попадают в эту область, включают хелперные Т-клетки , которые секретируют цитокины , чтобы заставить больше Т-клеток делиться и усилить воспаление, а также усилить вазодилатацию и проницаемость сосудов. [17] [23] Т-клетки также повышают активность макрофагов. [17]
Одной из функций макрофагов является фагоцитирование других отработанных фагоцитов , [24] бактерий и поврежденных тканей, [19] а также они очищают поврежденные ткани, высвобождая протеазы. [25]
Макрофаги функционируют в регенерации [26] [27] и необходимы для заживления ран. [19] Они стимулируются низким содержанием кислорода в окружающей среде для выработки факторов, которые вызывают и ускоряют ангиогенез [20] , а также стимулируют клетки, которые реэпителизируют рану, создают грануляционную ткань и закладывают новый внеклеточный матрикс . [28] Секретируя эти факторы, макрофаги способствуют переходу процесса заживления ран на следующую фазу. Они заменяют ПМН как преобладающие клетки в ране через два дня после травмы. [24]
Селезенка содержит половину моноцитов организма в резерве, готовых к развертыванию в поврежденной ткани. [29] [30] Привлеченные к месту раны факторами роста, выделяемыми тромбоцитами и другими клетками, моноциты из кровотока проникают в эту область через стенки кровеносных сосудов. [31] Количество моноцитов в ране достигает пика через один-полтора дня после получения травмы. [23] Оказавшись в месте раны, моноциты созревают в макрофаги. Макрофаги также выделяют ряд факторов, таких как факторы роста и другие цитокины, особенно в течение третьего и четвертого дня после ранения. Эти факторы привлекают клетки, участвующие в стадии пролиферации заживления, в эту область. [15]
При заживлении ран, которое приводит к неполному восстановлению, происходит сокращение рубца, что приводит к различным градациям структурных дефектов, деформаций и проблем с гибкостью. [32] Макрофаги могут сдерживать фазу сокращения. [27] Ученые сообщили, что удаление макрофагов из саламандры привело к неспособности типичной реакции регенерации (регенерации конечностей), вместо этого вызвав реакцию восстановления (рубцевания). [33] [34]
По мере того, как воспаление стихает, выделяется меньше воспалительных факторов, существующие разрушаются, а количество нейтрофилов и макрофагов в месте раны уменьшается. [19] Эти изменения указывают на то, что воспалительная фаза заканчивается и начинается пролиферативная фаза. [19] Данные in vitro, полученные с использованием модели эквивалента дермы , свидетельствуют о том, что присутствие макрофагов фактически задерживает сокращение раны, и, таким образом, исчезновение макрофагов из раны может быть необходимым для наступления последующих фаз. [27]
Поскольку воспаление играет роль в борьбе с инфекцией, очищении от мусора и инициировании фазы пролиферации, оно является необходимой частью заживления. Однако воспаление может привести к повреждению тканей , если оно длится слишком долго. [7] Таким образом, уменьшение воспаления часто является целью в терапевтических условиях. Воспаление длится до тех пор, пока в ране есть мусор. Таким образом, если иммунная система человека ослаблена и неспособна очистить рану от мусора и/или если в ране присутствует избыточное количество детрита, нежизнеспособной ткани или микробной биопленки , эти факторы могут вызвать длительную воспалительную фазу и помешать ране должным образом начать фазу пролиферации заживления. Это может привести к хронической ране .
Примерно через два-три дня после возникновения раны фибробласты начинают проникать в место раны, отмечая начало пролиферативной фазы еще до окончания воспалительной фазы. [35] Как и в других фазах заживления ран, этапы пролиферативной фазы не происходят последовательно, а частично перекрываются во времени.
Также называемый неоваскуляризацией, процесс ангиогенеза происходит одновременно с пролиферацией фибробластов, когда эндотелиальные клетки мигрируют в область раны. [36] Поскольку активность фибробластов и эпителиальных клеток требует кислорода и питательных веществ, ангиогенез необходим для других стадий заживления ран, таких как эпидермальная и фибробластная миграция. Ткань, в которой произошел ангиогенез, обычно выглядит красной ( эритематозной ) из-за наличия капилляров . [36]
Ангиогенез происходит в перекрывающихся фазах в ответ на воспаление:
Стволовые клетки эндотелиальных клеток , происходящие из частей неповрежденных кровеносных сосудов, развивают псевдоподии и продвигаются через внеклеточный матрикс в место раны, чтобы создать новые кровеносные сосуды. [20]
Эндотелиальные клетки привлекаются к области раны фибронектином, обнаруженным на фибриновой корке, и хемотаксически ангиогенными факторами, высвобождаемыми другими клетками, [37] например, макрофагами и тромбоцитами в среде с низким содержанием кислорода. Рост и пролиферация эндотелия также напрямую стимулируются гипоксией и присутствием молочной кислоты в ране. [35] Например, гипоксия стимулирует эндотелиальный фактор транскрипции , индуцируемый гипоксией фактор (HIF) для трансактивации набора пролиферативных генов, включая фактор роста эндотелия сосудов (VEGF) и транспортер глюкозы 1 (GLUT1).
Для миграции эндотелиальным клеткам необходимы коллагеназы и активатор плазминогена для разрушения сгустка и части ВКМ. [3] [19] Цинк -зависимые металлопротеиназы переваривают базальную мембрану и ВКМ, обеспечивая миграцию клеток, пролиферацию и ангиогенез. [38]
Когда макрофаги и другие клетки, продуцирующие факторы роста, больше не находятся в гипоксической среде, заполненной молочной кислотой, они прекращают вырабатывать ангиогенные факторы. [20] Таким образом, когда ткань адекватно перфузируется , миграция и пролиферация эндотелиальных клеток снижается. В конце концов, кровеносные сосуды, которые больше не нужны, умирают из-за апоптоза . [37]
Одновременно с ангиогенезом в месте раны начинают накапливаться фибробласты . Фибробласты начинают поступать в место раны через два-пять дней после ранения, когда заканчивается воспалительная фаза, и их количество достигает пика через одну-две недели после ранения. [19] К концу первой недели фибробласты становятся основными клетками в ране. [3] Фиброплазия заканчивается через две-четыре недели после ранения.
В качестве модели механизм фиброплазии можно концептуализировать как аналогичный процесс ангиогенеза (см. выше) - только вовлеченный тип клеток - фибробласты, а не эндотелиальные клетки. Первоначально существует латентная фаза, когда рана подвергается плазменной экссудации, воспалительной деконтаминации и дебридменту. Отек увеличивает гистологическую доступность раны для последующей фибропластической миграции. Во-вторых, по мере того, как воспаление приближается к завершению, макрофаги и тучные клетки выделяют факторы роста фибробластов и хемотаксиса для активации фибробластов из прилегающих тканей. Фибробласты на этой стадии отсоединяются от окружающих клеток и ВКМ. Фагоциты далее выделяют протеазы, которые разрушают ВКМ соседних тканей, освобождая активированные фибробласты для пролиферации и миграции к ране. Разница между сосудистым прорастанием и пролиферацией фибробластов заключается в том, что первое усиливается гипоксией, тогда как второе ингибируется гипоксией. Отложенная фибробластическая соединительная ткань созревает, секретируя ECM во внеклеточное пространство, образуя грануляционную ткань (см. ниже). Наконец, коллаген откладывается в ECM.
В первые два-три дня после травмы фибробласты в основном мигрируют и размножаются, а позже они становятся основными клетками, которые формируют коллагеновую матрицу в месте раны. [3] Считается, что эти фибробласты происходят из прилегающей неповрежденной кожной ткани (хотя новые данные свидетельствуют о том, что некоторые из них происходят из циркулирующих в крови взрослых стволовых клеток/предшественников). [39] Первоначально фибробласты используют фибриновые сшивающие волокна (хорошо сформированные к концу воспалительной фазы) для миграции через рану, впоследствии прикрепляясь к фибронектину. [37] Затем фибробласты откладывают основное вещество в раневое ложе, а затем коллаген, к которому они могут прикрепиться для миграции. [15]
Грануляционная ткань функционирует как рудиментарная ткань и начинает появляться в ране уже во время воспалительной фазы, через два-пять дней после ранения, и продолжает расти до тех пор, пока ложе раны не будет покрыто. Грануляционная ткань состоит из новых кровеносных сосудов, фибробластов, воспалительных клеток, эндотелиальных клеток, миофибробластов и компонентов нового, временного внеклеточного матрикса (ВКМ). Временный ВКМ отличается по составу от ВКМ нормальной ткани, и его компоненты происходят из фибробластов. [28] К таким компонентам относятся фибронектин, коллаген, гликозаминогликаны , эластин , гликопротеины и протеогликаны . [37] Его основными компонентами являются фибронектин и гиалуронан , которые создают очень гидратированную матрицу и облегчают миграцию клеток. [31] Позже этот временный матрикс заменяется ВКМ, который больше похож на тот, что находится в неповрежденной ткани.
Факторы роста ( PDGF , TGF-β ) и фибронектин стимулируют пролиферацию, миграцию в раневое ложе и выработку молекул ECM фибробластами. Фибробласты также секретируют факторы роста, которые привлекают эпителиальные клетки к месту раны. Гипоксия также способствует пролиферации фибробластов и выделению факторов роста, хотя слишком мало кислорода будет подавлять их рост и отложение компонентов ECM и может привести к чрезмерному фиброзному рубцеванию .
Одной из важнейших обязанностей фибробластов является выработка коллагена . [36]
Отложение коллагена важно, поскольку оно увеличивает прочность раны; до того, как она заживет, единственное, что удерживает рану закрытой, — это фибрин-фибронектиновый сгусток, который не обеспечивает большой устойчивости к травматическому повреждению . [20] Кроме того, клетки, участвующие в воспалении, ангиогенезе и построении соединительной ткани, прикрепляются, растут и дифференцируются на коллагеновой матрице, образованной фибробластами. [40]
Коллаген типа III и фибронектин обычно начинают вырабатываться в заметных количествах где-то между 10 часами [41] и 3 днями, [37] в зависимости, главным образом, от размера раны. Их отложение достигает пика через одну-три недели. [28] Они являются преобладающими растягивающими веществами до более поздней фазы созревания, в которой они заменяются более сильным коллагеном типа I.
Даже когда фибробласты производят новый коллаген, коллагеназы и другие факторы разрушают его. Вскоре после ранения синтез превышает деградацию, поэтому уровень коллагена в ране повышается, но позже производство и деградация становятся равными, поэтому нет чистого прироста коллагена. [20] Этот гомеостаз сигнализирует о начале более поздней фазы созревания. Грануляция постепенно прекращается, и количество фибробластов в ране уменьшается после того, как их работа выполнена. [42] В конце фазы грануляции фибробласты начинают совершать апоптоз, преобразуя грануляционную ткань из среды, богатой клетками, в среду, состоящую в основном из коллагена. [3]
Образование грануляционной ткани в открытой ране позволяет осуществиться фазе реэпителизации, поскольку эпителиальные клетки мигрируют через новую ткань, образуя барьер между раной и окружающей средой. [37] Базальные кератиноциты из краев раны и дермальных придатков, таких как волосяные фолликулы , потовые железы и сальные (масляные) железы, являются основными клетками, ответственными за фазу эпителизации заживления ран. [42] Они продвигаются пластом через место раны и размножаются по ее краям, прекращая движение, когда встречаются посередине. При заживлении, которое приводит к образованию рубца, потовые железы, волосяные фолликулы [43] [44] и нервы не образуются. При отсутствии волосяных фолликулов, нервов и потовых желез рана и образовавшийся заживающий рубец представляют собой проблему для организма в отношении контроля температуры. [44]
Кератиноциты мигрируют без предварительной пролиферации. [45] Миграция может начаться уже через несколько часов после ранения. Однако эпителиальным клеткам требуется жизнеспособная ткань для миграции, поэтому, если рана глубокая, ее сначала нужно заполнить грануляционной тканью. [46] Таким образом, время начала миграции варьируется и может произойти примерно через день после ранения. [47] Клетки на краях раны пролиферируют на второй и третий день после ранения, чтобы обеспечить больше клеток для миграции. [28]
Если базальная мембрана не нарушена, эпителиальные клетки заменяются в течение трех дней путем деления и восходящей миграции клеток в базальном слое таким же образом, как это происходит в неповрежденной коже. [37] Однако, если базальная мембрана разрушена в месте раны, реэпителизация должна происходить от краев раны и от придатков кожи, таких как волосяные фолликулы, потовые и сальные железы, которые входят в дерму и выстланы жизнеспособными кератиноцитами. [28] Если рана очень глубокая, придатки кожи также могут быть разрушены, и миграция может происходить только от краев раны. [46]
Миграция кератиноцитов через место раны стимулируется отсутствием контактного торможения и такими химическими веществами, как оксид азота . [48] Прежде чем они начнут мигрировать, клетки должны растворить свои десмосомы и гемидесмосомы , которые обычно прикрепляют клетки промежуточными филаментами в их цитоскелете к другим клеткам и к ВКМ. [23] Трансмембранные рецепторные белки , называемые интегринами , которые состоят из гликопротеинов и обычно прикрепляют клетку к базальной мембране ее цитоскелетом , высвобождаются из промежуточных филаментов клетки и перемещаются к актиновым филаментам, чтобы служить прикреплениями к ВКМ для псевдоподий во время миграции. [23] Таким образом, кератиноциты отсоединяются от базальной мембраны и могут войти в раневое ложе. [35]
Перед тем, как начать миграцию, кератиноциты меняют форму, становясь длиннее и площе, и удлиняют клеточные отростки, такие как ламеллиподии и широкие отростки, которые выглядят как оборки. [31] Формируются актиновые нити и псевдоподии . [35] Во время миграции интегрины на псевдоподии прикрепляются к ВКМ, а актиновые нити в выступе тянут клетку за собой. [23] Взаимодействие с молекулами в ВКМ через интегрины дополнительно способствует образованию актиновых нитей, ламеллиподий и филоподий . [23]
Эпителиальные клетки перелезают друг через друга, чтобы мигрировать. [42] Этот растущий слой эпителиальных клеток часто называют эпителиальным языком. [45] Первые клетки, которые прикрепляются к базальной мембране, образуют базальный слой . Эти базальные клетки продолжают мигрировать по раневому ложу, и эпителиальные клетки над ними также скользят по нему. [45] Чем быстрее происходит эта миграция, тем меньше будет рубец. [49]
Фибрин , коллаген и фибронектин в ECM могут дополнительно сигнализировать клеткам о необходимости деления и миграции. Подобно фибробластам, мигрирующие кератиноциты используют фибронектин, связанный с фибрином, который был отложен при воспалении, в качестве места прикрепления для перемещения. [25] [31] [42]

По мере миграции кератиноциты перемещаются по грануляционной ткани, но остаются под струпом, тем самым отделяя струп от подлежащей ткани. [42] [47] Эпителиальные клетки обладают способностью фагоцитировать остатки, такие как мертвая ткань и бактериальный материал, которые в противном случае препятствовали бы их пути. Поскольку они должны растворять любой образующийся струп, миграция кератиноцитов лучше всего усиливается во влажной среде, поскольку сухая среда приводит к образованию более крупного и жесткого струпа. [25] [37] [42] [50] Чтобы проложить свой путь по ткани, кератиноциты должны растворить сгусток, остатки и части ВКМ, чтобы пройти. [47] [51] Они секретируют активатор плазминогена , который активирует плазминоген , превращая его в плазмин для растворения струпа. Клетки могут мигрировать только по живой ткани, [42] поэтому они должны выделять коллагеназы и протеазы, такие как матриксные металлопротеиназы (ММП), чтобы растворять поврежденные части ВКМ на своем пути, особенно в передней части мигрирующего слоя. [47] Кератиноциты также растворяют базальную мембрану, используя вместо этого новый ВКМ, отложенный фибробластами, чтобы ползать по нему. [23]
По мере того, как кератиноциты продолжают мигрировать, на краях раны должны образовываться новые эпителиальные клетки, чтобы заменить их и обеспечить больше клеток для продвигающегося слоя. [25] Пролиферация за мигрирующими кератиноцитами обычно начинается через несколько дней после ранения [46] и происходит со скоростью, которая в 17 раз выше на этой стадии эпителизации, чем в нормальных тканях. [25] Пока вся область раны не будет восстановлена, единственные эпителиальные клетки, которые будут пролиферировать, находятся на краях раны. [45]
Факторы роста, стимулируемые интегринами и ММП, заставляют клетки размножаться на краях раны. Сами кератиноциты также производят и секретируют факторы, включая факторы роста и белки базальной мембраны, которые способствуют как эпителизации, так и другим фазам заживления. [52] Факторы роста также важны для врожденной иммунной защиты кожных ран, стимулируя выработку антимикробных пептидов и нейтрофильных хемотаксических цитокинов в кератиноцитах.
Кератиноциты продолжают мигрировать по ложу раны до тех пор, пока клетки с обеих сторон не встретятся посередине, и в этот момент контактное торможение заставит их прекратить миграцию. [31] Когда они закончат миграцию, кератиноциты секретируют белки, которые образуют новую базальную мембрану. [31] Клетки обращают вспять морфологические изменения, которые они претерпели, чтобы начать миграцию; они восстанавливают десмосомы и гемидесмосомы и снова прикрепляются к базальной мембране. [23] Базальные клетки начинают делиться и дифференцироваться таким же образом, как они это делают в нормальной коже, чтобы восстановить слои, обнаруженные в реэпителизированной коже. [31]
Сокращение является ключевой фазой заживления ран с восстановлением. Если сокращение продолжается слишком долго, это может привести к обезображиванию и потере функции. [32] Таким образом, существует большой интерес к пониманию биологии сокращения ран, которое может быть смоделировано in vitro с использованием анализа сокращения коллагенового геля или дермальной эквивалентной модели. [27] [53]
Сокращение начинается примерно через неделю после ранения, когда фибробласты дифференцируются в миофибробласты . [54] В ранах полной толщины сокращение достигает пика через 5–15 дней после ранения. [37] Сокращение может длиться несколько недель [46] и продолжается даже после полной реэпителизации раны. [3] Большая рана может стать на 40–80% меньше после сокращения. [31] [42] Раны могут сокращаться со скоростью до 0,75 мм в день, в зависимости от того, насколько рыхлая ткань в области ранения. [37] Сокращение обычно происходит несимметрично; скорее, большинство ран имеют «ось сокращения», которая обеспечивает большую организацию и выравнивание клеток с коллагеном. [54]
Сначала сокращение происходит без участия миофибробластов. [55] Позже фибробласты, стимулированные факторами роста, дифференцируются в миофибробласты. Миофибробласты, которые похожи на гладкомышечные клетки, отвечают за сокращение. [55] Миофибробласты содержат тот же тип актина, что и гладкомышечные клетки. [32]
Миофибробласты привлекаются фибронектином и факторами роста, и они движутся вдоль фибронектина, связанного с фибрином в предварительном ECM, чтобы достичь краев раны. [25] Они образуют связи с ECM на краях раны и прикрепляются друг к другу и к краям раны десмосомами . Кроме того, в адгезии, называемой фибронексус, актин в миофибробласте связан через клеточную мембрану с молекулами во внеклеточном матриксе, такими как фибронектин и коллаген. [55] Миофибробласты имеют много таких адгезий, которые позволяют им тянуть ECM при сокращении, уменьшая размер раны. [32] В этой части сокращения закрытие происходит быстрее, чем в первой, независимой от миофибробластов части. [55]
Когда актин в миофибробластах сокращается, края раны стягиваются. Фибробласты откладывают коллаген, чтобы укрепить рану, когда миофибробласты сокращаются. [3] Стадия сокращения в пролиферации заканчивается, когда миофибробласты перестают сокращаться и совершают апоптоз. [32] Распад временной матрицы приводит к уменьшению гиалуроновой кислоты и увеличению хондроитинсульфата, что постепенно заставляет фибробласты прекращать миграцию и пролиферацию. [19] Эти события сигнализируют о начале стадии созревания заживления ран.
Когда уровни выработки и деградации коллагена выравниваются, говорят, что началась фаза созревания восстановления ткани. [20] Во время созревания коллаген типа III , который преобладает во время пролиферации, заменяется коллагеном типа I. [17] Первоначально дезорганизованные коллагеновые волокна перестраиваются, сшиваются и выравниваются вдоль линий натяжения . [31] Начало фазы созревания может значительно варьироваться в зависимости от размера раны и от того, была ли она изначально закрыта или оставлена открытой, [28] в пределах приблизительно от трех дней [41] до трех недель. [56] Фаза созревания может длиться год или дольше, аналогично в зависимости от типа раны. [28]
По мере развития фазы прочность раны на разрыв увеличивается. [28] Коллаген достигнет примерно 20% своей прочности на разрыв через три недели, увеличиваясь до 80% через 12 месяцев. Максимальная прочность рубца составляет 80% от прочности неповрежденной кожи. [57] Поскольку активность в месте раны снижается, рубец теряет свой красный вид, поскольку кровеносные сосуды , которые больше не нужны, удаляются путем апоптоза . [20]
Фазы заживления ран обычно развиваются предсказуемым и своевременным образом; если этого не происходит, заживление может развиваться ненадлежащим образом, либо приводя к хронической ране [7], такой как венозная язва , либо к патологическому рубцеванию, такому как келоидный рубец . [58] [59]
Многие факторы, контролирующие эффективность, скорость и характер заживления ран, делятся на два типа: местные и системные факторы. [2]
В 2000-х годах появились первые математические модели процесса заживления, основанные на упрощенных предположениях и на системе дифференциальных уравнений, решенных с помощью MATLAB . Модели показывают, что «скорость процесса заживления», по-видимому, «сильно зависит от активности и размера самой травмы, а также активности лечебного агента». [69]
Вплоть до 2000 года классическая парадигма заживления ран, включающая стволовые клетки, ограниченные органоспецифичными линиями, никогда серьезно не оспаривалась. С тех пор в качестве альтернативного объяснения появилась идея о том, что взрослые стволовые клетки обладают клеточной пластичностью или способностью дифференцироваться в нелинейные клетки. [1] Если говорить точнее, то гемопоэтические клетки-предшественники (дающие начало зрелым клеткам в крови) могут обладать способностью дедифференцироваться обратно в гемопоэтические стволовые клетки и/или трансдифференцироваться в нелинейные клетки, такие как фибробласты. [39]
Мультипотентные взрослые стволовые клетки обладают способностью к самообновлению и дают начало различным типам клеток. Стволовые клетки дают начало клеткам-предшественникам, которые являются клетками, которые не являются самообновляющимися, но могут генерировать несколько типов клеток. Степень участия стволовых клеток в заживлении кожных ран сложна и не до конца изучена. [ необходима цитата ] Инъекция стволовых клеток приводит к заживлению ран в первую очередь за счет стимуляции ангиогенеза. [70]
Считается, что эпидермис и дерма восстанавливаются митотически активными стволовыми клетками, которые находятся на вершине гребней рете (базальные стволовые клетки или БСК), выпуклости волосяных фолликулов (стволовые клетки волосяного фолликула или ВФСК) и сосочковой дерме (дермальные стволовые клетки). [1] Более того, костный мозг также может содержать стволовые клетки, которые играют важную роль в заживлении кожных ран. [39]
В редких случаях, таких как обширное повреждение кожи, самообновляющиеся субпопуляции в костном мозге индуцируются для участия в процессе заживления, в результате чего они дают начало клеткам, секретирующим коллаген, которые, по-видимому, играют роль в заживлении ран. [1] Эти две самообновляющиеся субпопуляции представляют собой (1) мезенхимальные стволовые клетки, полученные из костного мозга (MSC), и (2) гемопоэтические стволовые клетки (HSC). Костный мозг также содержит субпопуляцию предшественников ( эндотелиальные клетки-предшественники или EPC), которые в тех же условиях мобилизуются для помощи в восстановлении кровеносных сосудов. [39] Более того, считается, что обширное повреждение кожи также способствует раннему перемещению уникального подкласса лейкоцитов (циркулирующих фиброцитов ) в травмированную область, где они выполняют различные функции, связанные с заживлением ран. [1]
Травма — это нарушение морфологии и/или функциональности данной ткани. После травмы структурная ткань заживает с неполной или полной регенерацией. [71] [72] Ткань без нарушения морфологии почти всегда полностью регенерирует. Примером полной регенерации без нарушения морфологии является неповрежденная ткань, такая как кожа. [73] Неповрежденная кожа имеет постоянную замену и регенерацию клеток, что всегда приводит к полной регенерации. [73]
Существует тонкое различие между «ремонтом» и «регенерацией». [1] [71] [72] Ремонт означает неполную регенерацию . [71] Ремонт или неполная регенерация относится к физиологической адаптации органа после травмы в попытке восстановить непрерывность без учета точной замены утраченной/поврежденной ткани. [71] Истинная регенерация ткани или полная регенерация [72] относится к замене утраченной/поврежденной ткани «точной» копией, так что и морфология, и функциональность полностью восстанавливаются. [ 72] Хотя после травмы млекопитающие могут полностью регенерировать спонтанно, они обычно не регенерируют полностью. Примером ткани, полностью регенерирующей после прерывания морфологии, является эндометрий ; эндометрий после процесса распада через менструальный цикл заживает с полной регенерацией. [73]
В некоторых случаях после распада ткани, например, кожи, регенерация, близкая к полной регенерации, может быть вызвана использованием биоразлагаемых ( коллаген - гликоаминогликановых ) каркасов. Эти каркасы структурно аналогичны внеклеточному матриксу (ECM), обнаруженному в нормальной/неповрежденной дерме. [74] Фундаментальные условия, необходимые для регенерации ткани, часто противостоят условиям, которые способствуют эффективному заживлению ран, включая ингибирование (1) активации тромбоцитов, (2) воспалительной реакции и (3) сокращения раны. [1] Помимо обеспечения поддержки прикрепления фибробластов и эндотелиальных клеток, биоразлагаемые каркасы ингибируют сокращение раны, тем самым позволяя процессу заживления перейти к более регенеративному/менее рубцовому пути. Были исследованы фармацевтические агенты, которые могут быть способны отключить дифференциацию миофибробластов . [75]
Новый способ мышления, основанный на представлении о том, что гепарансульфаты играют ключевую роль в гомеостазе тканей: процессе, который заставляет ткань заменять мертвые клетки идентичными клетками. В раневых областях гомеостаз тканей теряется, поскольку гепарансульфаты деградируют, предотвращая замену мертвых клеток идентичными клетками. Аналоги гепарансульфата не могут быть деградированы всеми известными гепараназами и гликаназами и связываются со свободными точками связывания гепаринсульфата на ВКМ, тем самым сохраняя нормальный гомеостаз тканей и предотвращая образование рубцов. [76] [77] [78]
Ремонт или регенерация в отношении гипоксией-индуцируемого фактора 1-альфа (HIF-1a). В нормальных условиях после травмы HIF-1a разрушается пролилгидроксилазами (PHD). Ученые обнаружили, что простая регуляция HIF-1a с помощью ингибиторов PHD восстанавливает утраченную или поврежденную ткань у млекопитающих, которые имеют реакцию восстановления; а продолжающаяся регуляция Hif-1a приводит к заживлению с рубцеванием у млекопитающих с предыдущей регенеративной реакцией на потерю ткани. Акт регулирования HIF-1a может либо выключить, либо включить ключевой процесс регенерации млекопитающих. [79] [80]
Заживление ран без рубцов — это концепция, основанная на заживлении или восстановлении кожи (или других тканей/органов) после травмы с целью заживления с субъективно и относительно меньшим количеством рубцовой ткани, чем обычно ожидается. Заживление без рубцов иногда путают с концепцией заживления без рубцов , которая представляет собой заживление ран, в результате которого не остается абсолютно никаких рубцов ( без рубцов). Однако это разные концепции.
Обратной стороной безрубцового заживления ран является скарификация (заживление ран с образованием большего рубца). Исторически сложилось так, что некоторые культуры считают скарификацию привлекательной; [81] однако, это, как правило, не относится к современному западному обществу, в котором многие пациенты обращаются в клиники пластической хирургии с нереалистичными ожиданиями. В зависимости от типа рубца лечение может быть инвазивным (внутриочаговые инъекции стероидов, хирургия) и/или консервативным ( компрессионная терапия , местный силиконовый гель , брахитерапия , фотодинамическая терапия ). [82] Клиническое суждение необходимо для успешного баланса потенциальных преимуществ различных доступных методов лечения с вероятностью плохого ответа и возможных осложнений в результате этих методов лечения. Многие из этих методов лечения могут иметь только эффект плацебо , а доказательная база для использования многих современных методов лечения плохая. [83]
С 1960-х годов понимание основных биологических процессов, вовлеченных в заживление ран и регенерацию тканей, расширилось благодаря достижениям в клеточной и молекулярной биологии . [84] В настоящее время основными целями в лечении ран являются достижение быстрого закрытия раны функциональной тканью с минимальным эстетическим рубцеванием. [85] Однако конечной целью биологии заживления ран является более совершенная реконструкция области раны. Заживление ран без рубцов происходит только в эмбриональных тканях млекопитающих [86] , а полная регенерация ограничена низшими позвоночными, такими как саламандры и беспозвоночные . [87] У взрослых людей поврежденные ткани восстанавливаются путем отложения коллагена , ремоделирования коллагена и в конечном итоге образования рубцов, где заживление ран плода, как полагают, является скорее регенеративным процессом с минимальным или отсутствующим образованием рубцов. [86] Таким образом, заживление ран плода можно использовать для обеспечения доступной модели млекопитающих оптимального ответа на заживление в тканях взрослого человека. Подсказки относительно того, как этого можно достичь, получены в ходе исследований заживления ран у эмбрионов, где восстановление происходит быстро и эффективно и приводит к практически идеальной регенерации любой утраченной ткани.
Этимология термина «заживление ран без рубцов» имеет долгую историю. [88] [89] [90] В печати устаревшая концепция заживления без рубцов была выдвинута в начале 20-го века и появилась в статье, опубликованной в London Lancet. Этот процесс включал разрезание под хирургическим наклоном к поверхности кожи, а не под прямым углом к ней; процесс был описан в различных газетах. [88] [89] [90]
После воспаления восстановление нормальной целостности и функции тканей сохраняется за счет обратных взаимодействий между различными типами клеток, опосредованных молекулами адгезии и секретируемыми цитокинами. Нарушение нормальных механизмов обратной связи при раке угрожает целостности тканей и позволяет злокачественной опухоли избежать иммунной системы. [91] [92] Пример важности реакции заживления ран в опухолях проиллюстрирован в работе Говарда Чанга и его коллег из Стэнфордского университета, изучающих рак молочной железы. [8]
Предварительные результаты являются многообещающими для краткосрочного и долгосрочного использования оральных коллагеновых добавок для заживления ран и старения кожи. Оральные коллагеновые добавки также повышают эластичность кожи, увлажнение и плотность дермального коллагена. Коллагеновые добавки, как правило, безопасны, не сообщалось о побочных эффектах. Необходимы дальнейшие исследования для выяснения медицинского использования при заболеваниях кожного барьера, таких как атопический дерматит, и для определения оптимальных режимов дозирования. [93]
Современные повязки для заживления ран подверглись значительным исследованиям и разработкам в последние годы. Ученые стремятся разработать повязки для ран, которые обладают следующими характеристиками: [94]
Хлопковые марлевые повязки были стандартом ухода, несмотря на их сухие свойства, которые могут прилипать к раневым поверхностям и вызывать дискомфорт при снятии. Недавние исследования были направлены на улучшение хлопковых марлевых повязок, чтобы приблизить их к достижению современных свойств раневых повязок, покрывая хлопковые марлевые повязки нанокомпозитом хитозан / Ag / ZnO . Эти обновленные повязки обеспечивают повышенную впитываемость воды и улучшенную антибактериальную эффективность . [94]
Грязь или пыль на поверхности раны, бактерии, отмершие ткани и жидкость из раны можно очистить. Доказательства, подтверждающие наиболее эффективную методику, неясны, и недостаточно доказательств, чтобы сделать вывод о том, полезна ли очистка ран для содействия заживлению или растворы для очистки ран ( полигексаметиленбигуанид , водный перекись водорода и т. д.) лучше, чем стерильная вода или солевые растворы, для заживления венозных язв ног. [95] Неясно, влияет ли выбор очищающего раствора или метода нанесения на заживление венозных язв ног . [95]
Значительные усилия были направлены на понимание физических взаимосвязей, управляющих заживлением ран и последующим рубцеванием, с математическими моделями и симуляциями, разработанными для выяснения этих взаимосвязей. [96] Рост ткани вокруг места раны является результатом миграции клеток и отложения коллагена этими клетками. Выравнивание коллагена описывает степень рубцевания; ориентация коллагена в виде переплетения корзин характерна для нормальной кожи, тогда как выровненные коллагеновые волокна приводят к значительному рубцеванию. [97] Было показано, что рост ткани и степень образования рубца можно контролировать, модулируя напряжение в месте раны. [98]
Рост ткани можно моделировать, используя вышеупомянутые соотношения с биохимической и биомеханической точки зрения. Биологически активные химические вещества, которые играют важную роль в заживлении ран, моделируются с помощью фикковской диффузии для создания профилей концентрации. Уравнение баланса для открытых систем при моделировании заживления ран включает рост массы за счет миграции и пролиферации клеток. Здесь используется следующее уравнение:
D t ρ 0 = Div (R) + R 0 ,
где ρ представляет собой плотность массы, R представляет собой поток массы (от миграции клеток), а R 0 представляет собой источник массы (от пролиферации клеток, деления или увеличения). [99] Подобные отношения могут быть включены в модели на основе агентов , где можно проверить чувствительность к отдельным параметрам, таким как начальное выравнивание коллагена, свойства цитокинов и скорость пролиферации клеток. [100]
Успешное заживление ран зависит от различных типов клеток, молекулярных медиаторов и структурных элементов. [101]
Первичное намерение — заживление чистой раны без потери ткани. [101] В этом процессе края раны сближаются так, чтобы они прилегали друг к другу (повторное сближение). Закрытие раны выполняется с помощью швов (стежков), скоб или лейкопластыря или клея.
Первичное натяжение может быть реализовано только в том случае, если рана точная и имеется минимальное нарушение местной ткани и эпителиальной базальной мембраны, например, хирургические разрезы. [102]
Этот процесс происходит быстрее, чем заживление вторичным натяжением. [101] Также при первичном натяжении меньше рубцов, поскольку нет больших потерь ткани, которые можно было бы заполнить грануляционной тканью, хотя некоторое количество грануляционной ткани все же образуется. [101]
(Отсроченное первичное закрытие):
Если края раны не сближаются немедленно, происходит замедленное первичное заживление ран. Этот тип заживления может быть желательным в случае загрязненных ран. К четвертому дню фагоцитоз загрязненных тканей идет полным ходом, и происходят процессы эпителизации, отложения коллагена и созревания. Инородные материалы отгораживаются макрофагами, которые могут метаморфизироваться в эпителиоидные клетки, которые окружаются мононуклеарными лейкоцитами, образуя гранулемы. Обычно рану закрывают хирургическим путем на этом этапе, или струп съедают, и если «очищение» раны неполное, может возникнуть хроническое воспаление, приводящее к выраженному рубцеванию.
Ниже приведены основные факторы роста, участвующие в заживлении ран:
Основных осложнений много:
Другие осложнения могут включать инфекцию и язву Маржолина .
Достижения в клиническом понимании ран и их патофизиологии привели к значительным биомедицинским инновациям в лечении острых, хронических и других типов ран. Было разработано множество биологических препаратов, заменителей кожи , биомембран и каркасов для облегчения заживления ран с помощью различных механизмов. [108] Сюда входит ряд продуктов под такими торговыми наименованиями, как Epicel , Laserskin , Transcyte, Dermagraft, AlloDerm/Strattice, Biobrane, Integra, Apligraf, OrCel, GraftJacket и PermaDerm. [109]
толстого струпа, медленное заживление (>1 месяца), очевидное рубцевание,
в течение 2 недель – минимальный или отсутствующий рубец; Заживление в течение 3 недель – минимальный или отсутствующий рубец, за исключением пациентов с высоким риском образования рубцов; Заживление в течение 4 недель или более – гипертрофический у более чем 50% пациентов
Макрофаги присутствуют по существу во всех тканях, начиная с эмбрионального развития, и, в дополнение к их роли в защите хозяина и в очистке от апоптотических клеток, все больше признаются за их трофическую функцию и роль в регенерации.
Исследователи идентифицировали клетку, которая помогает отрастать конечностям у саламандр. Макрофаги — это тип восстанавливающих клеток, которые пожирают мертвые клетки и патогены и заставляют другие иммунные клетки реагировать на патогены.
дерма разрушается, рубцы не восстанавливают волосы, нервы или потовые железы, что создает дополнительные проблемы для контроля температуры тела.
Новая ткань не такая же, как ткань, которая была утрачена. После завершения процесса восстановления происходит потеря структуры или функции поврежденной ткани. При этом типе восстановления обычно грануляционная ткань (стромальная соединительная ткань) разрастается, чтобы заполнить дефект, созданный некротическими клетками. Затем некротические клетки заменяются рубцовой тканью.
(1) Полная регенерация: новая ткань такая же, как и утраченная. После завершения процесса восстановления структура и функция поврежденной ткани полностью нормальны
После завершения процесса восстановления структура и функция поврежденной ткани полностью нормальны. Этот тип регенерации распространен в физиологических ситуациях. Примерами физиологической регенерации являются постоянная замена клеток кожи и восстановление эндометрия после менструации. Полная регенерация может происходить в патологических ситуациях в тканях, которые обладают хорошей регенеративной способностью.