Магнетохимия занимается магнитными свойствами химических соединений . Магнитные свойства возникают из спина и орбитального углового момента электронов, содержащихся в соединении. Соединения являются диамагнитными, когда они не содержат неспаренных электронов . Молекулярные соединения, которые содержат один или несколько неспаренных электронов, являются парамагнитными . Величина парамагнетизма выражается как эффективный магнитный момент, μ eff . Для переходных металлов первого ряда величина μ eff является, в первом приближении, простой функцией числа неспаренных электронов, формулой только для спина. В общем случае спин-орбитальная связь заставляет μ eff отклоняться от формулы только для спина. Для более тяжелых переходных металлов, лантаноидов и актинидов , спин-орбитальную связь нельзя игнорировать. Обменное взаимодействие может происходить в кластерах и бесконечных решетках, что приводит к ферромагнетизму , антиферромагнетизму или ферримагнетизму в зависимости от относительной ориентации отдельных спинов.
Основным измерением в магнетохимии является магнитная восприимчивость. Она измеряет силу взаимодействия при помещении вещества в магнитное поле. Объемная магнитная восприимчивость , представленная символом, определяется соотношением
где, — намагниченность материала ( магнитный дипольный момент на единицу объема), измеряемая в амперах на метр ( единицы СИ ), а — напряженность магнитного поля , также измеряемая в амперах на метр. Восприимчивость — безразмерная величина . Для химических применений предпочтительной величиной является молярная магнитная восприимчивость (χ моль ). Она измеряется в м 3 ·моль −1 (СИ) или см 3 ·моль −1 (СГС) и определяется как
где ρ — плотность в кг·м −3 (СИ) или г·см −3 (СГС), а M — молярная масса в кг·моль −1 (СИ) или г·моль −1 (СГС).

Для измерения магнитной восприимчивости существует множество методов.
Когда изолированный атом помещается в магнитное поле, возникает взаимодействие, поскольку каждый электрон в атоме ведет себя как магнит, то есть электрон имеет магнитный момент . Существует два типа взаимодействия.
Когда атом присутствует в химическом соединении, его магнитное поведение изменяется под воздействием его химического окружения. Измерение магнитного момента может дать полезную химическую информацию.
В некоторых кристаллических материалах отдельные магнитные моменты могут быть выровнены друг с другом (магнитный момент имеет как величину, так и направление). Это приводит к ферромагнетизму , антиферромагнетизму или ферримагнетизму . Это свойства кристалла в целом, мало влияющие на химические свойства.
Диамагнетизм является универсальным свойством химических соединений, поскольку все химические соединения содержат электронные пары. Соединение, в котором нет неспаренных электронов, называется диамагнитным. Эффект слабый, поскольку он зависит от величины индуцированного магнитного момента. Он зависит от числа электронных пар и химической природы атомов, к которым они принадлежат. Это означает, что эффекты являются аддитивными, и можно составить таблицу «диамагнитных вкладов», или констант Паскаля . [6] [7] [8] В случае парамагнитных соединений наблюдаемую восприимчивость можно скорректировать, добавив к ней так называемую диамагнитную поправку, которая представляет собой диамагнитную восприимчивость, рассчитанную с использованием значений из таблицы. [9]

Ион металла с одним неспаренным электроном, такой как Cu2 + , в координационном комплексе представляет собой простейшую иллюстрацию механизма парамагнетизма. Отдельные ионы металла удерживаются лигандами далеко друг от друга, так что между ними нет магнитного взаимодействия. Говорят, что система магнитно разбавлена. Магнитные диполи атомов направлены в случайных направлениях. При приложении магнитного поля происходит расщепление Зеемана первого порядка . Атомы со спинами, выровненными по полю, немного превосходят по численности атомы с невыровненными спинами. В эффекте Зеемана первого порядка разность энергий между двумя состояниями пропорциональна напряженности приложенного поля. Обозначая разность энергий как Δ E , распределение Больцмана дает отношение двух популяций как , где k — постоянная Больцмана , а T — температура в градусах Кельвина . В большинстве случаев Δ E намного меньше kT , и экспоненту можно разложить как 1 – Δ E/kT . Из наличия 1/ T в этом выражении следует, что восприимчивость обратно пропорциональна температуре. [10]
Это известно как закон Кюри , а константа пропорциональности C известна как константа Кюри , значение которой для молярной восприимчивости рассчитывается как [11]
где N — постоянная Авогадро , g — g-фактор Ланде , а μ B — магнетон Бора . В этой трактовке предполагалось, что основное электронное состояние не вырождено, что магнитная восприимчивость обусловлена только спином электрона и что только основное состояние термически заселено.
В то время как некоторые вещества подчиняются закону Кюри, другие подчиняются закону Кюри-Вейсса .
T c — температура Кюри . Закон Кюри-Вейсса будет применяться только при температуре, значительно превышающей температуру Кюри. При температурах ниже температуры Кюри вещество может стать ферромагнитным . Более сложное поведение наблюдается с более тяжелыми переходными элементами.
При соблюдении закона Кюри произведение молярной восприимчивости и температуры является константой. Эффективный магнитный момент μ eff тогда определяется [12] как
Где C имеет единицы СГС см 3 моль −1 К, μ эфф равен
Где C имеет единицы СИ м 3 моль −1 К, μ эфф равен
Величина μ eff фактически безразмерна, но часто указывается в единицах магнетон Бора (μ B ). [12]
Для веществ, подчиняющихся закону Кюри, эффективный магнитный момент не зависит от температуры. Для других веществ μ eff зависит от температуры, но эта зависимость мала, если выполняется закон Кюри-Вейсса и температура Кюри низкая.
Соединения, которые, как ожидается, будут диамагнитными, могут проявлять этот тип слабого парамагнетизма. Он возникает из-за эффекта Зеемана второго порядка, в котором происходит дополнительное расщепление, пропорциональное квадрату напряженности поля. Его трудно наблюдать, поскольку соединение неизбежно также взаимодействует с магнитным полем в диамагнитном смысле. Тем не менее, имеются данные для перманганат- иона. [13] Его легче наблюдать в соединениях более тяжелых элементов, таких как соединения уранила .



Обменные взаимодействия происходят, когда вещество не является магнитно-разбавленным и существуют взаимодействия между отдельными магнитными центрами. Одной из простейших систем, демонстрирующих результат обменных взаимодействий, является кристаллический ацетат меди(II) , Cu2 ( OAc) 4 (H2O ) 2 . Как следует из формулы, он содержит два иона меди(II). Ионы Cu2 + удерживаются вместе четырьмя ацетатными лигандами, каждый из которых связывается с обоими ионами меди. Каждый ион Cu2 + имеет электронную конфигурацию ad9 , и поэтому должен иметь один неспаренный электрон. Если бы между ионами меди была ковалентная связь, электроны бы объединялись в пары, и соединение было бы диамагнитным. Вместо этого существует обменное взаимодействие, при котором спины неспаренных электронов частично выстраиваются друг относительно друга. Фактически создаются два состояния, одно с параллельными спинами, а другое с противоположными спинами. Разница в энергии между двумя состояниями настолько мала, что их заселенности значительно меняются с температурой. В результате магнитный момент изменяется с температурой по сигмоидальной схеме. Состояние с противоположными спинами имеет более низкую энергию, поэтому взаимодействие в этом случае можно классифицировать как антиферромагнитное. [14] Считается, что это пример сверхобмена , опосредованного атомами кислорода и углерода ацетатных лигандов. [15] Другие димеры и кластеры демонстрируют обменное поведение. [16]
Обменные взаимодействия могут действовать на бесконечных цепях в одном измерении, плоскостях в двух измерениях или на всем кристалле в трех измерениях. Это примеры дальнего магнитного упорядочения. Они приводят к ферромагнетизму , антиферромагнетизму или ферримагнетизму в зависимости от природы и относительной ориентации отдельных спинов. [17]
Соединения при температурах ниже температуры Кюри проявляют дальний магнитный порядок в форме ферромагнетизма. Другая критическая температура — температура Нееля , ниже которой возникает антиферромагнетизм. Гексагидрат хлорида никеля, NiCl2 · 6H2O , имеет температуру Нееля 8,3 К. Восприимчивость максимальна при этой температуре. Ниже температуры Нееля восприимчивость уменьшается, и вещество становится антиферромагнитным. [18]
Эффективный магнитный момент для соединения, содержащего ион переходного металла с одним или несколькими неспаренными электронами, зависит от полного орбитального и спинового углового момента неспаренных электронов, и , соответственно. «Полный» в данном контексте означает « векторную сумму ». В приближении, что электронные состояния ионов металла определяются связью Рассела-Саундерса и что спин-орбитальная связь пренебрежимо мала, магнитный момент определяется выражением [19]
Орбитальный угловой момент генерируется, когда электрон на орбитали вырожденного набора орбиталей перемещается на другую орбиталь в наборе путем вращения. В комплексах с низкой симметрией определенные вращения невозможны. В этом случае орбитальный угловой момент называется «погашенным» и меньше, чем можно было бы ожидать (частичное гашение), или равен нулю (полное гашение). Полное гашение происходит в следующих случаях. Обратите внимание, что электрон в вырожденной паре орбиталей d x 2 –y 2 или d z 2 не может вращаться на другую орбиталь из-за симметрии. [20]
Когда орбитальный угловой момент полностью погашен, и парамагнетизм можно отнести только к электронному спину. Полный спиновый угловой момент просто равен половине числа неспаренных электронов, и получается формула только для спина.
где n — число неспаренных электронов. Формула только спина является хорошим первым приближением для высокоспиновых комплексов переходных металлов первого ряда . [21]
Небольшие отклонения от формулы только для спина могут быть результатом пренебрежения орбитальным угловым моментом или спин-орбитальной связью. Например, тетраэдрические комплексы d 3 , d 4 , d 8 и d 9 имеют тенденцию показывать большие отклонения от формулы только для спина, чем октаэдрические комплексы того же иона, поскольку «гашение» орбитального вклада менее эффективно в тетраэдрическом случае. [22]
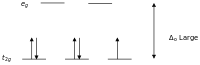
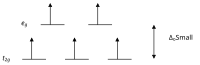
Согласно теории кристаллического поля, d- орбитали иона переходного металла в октаэдрическом комплексе расщепляются на две группы в кристаллическом поле. Если расщепление достаточно велико, чтобы преодолеть энергию, необходимую для размещения электронов на той же орбитали с противоположным спином, получится низкоспиновый комплекс.
При одном неспаренном электроне значения μ eff находятся в диапазоне от 1,8 до 2,5 μ B , а при двух неспаренных электронах — в диапазоне от 3,18 до 3,3 μ B. Обратите внимание, что низкоспиновые комплексы Fe 2+ и Co 3+ являются диамагнитными. Другая группа комплексов, которые являются диамагнитными, — это квадратно-плоские комплексы ионов d 8 , таких как Ni 2+ и Rh + и Au 3+ .
Когда разница энергий между высокоспиновыми и низкоспиновыми состояниями сравнима с kT ( k — постоянная Больцмана , а T — температура), между спиновыми состояниями устанавливается равновесие, включающее то, что было названо «электронными изомерами». Трис- дитиокарбамо железа(III), Fe(S2CNR2 ) 3 , является хорошо документированным примером. Эффективный момент варьируется от типичного значения d5 для низкоспинового состояния 2,25 μB при 80 K до более чем 4 μB выше 300 K. [23]
Расщепление кристаллического поля больше для комплексов более тяжелых переходных металлов, чем для переходных металлов, обсуждавшихся выше. Следствием этого является то, что низкоспиновые комплексы встречаются гораздо чаще. Константы спин-орбитальной связи, ζ, также больше и не могут игнорироваться даже при элементарных обработках. Магнитное поведение было обобщено, как показано ниже, вместе с обширной таблицей данных. [24]
Связь Рассела-Саундерса , связь LS, применяется к ионам лантаноидов, эффекты кристаллического поля можно игнорировать, но спин-орбитальная связь не является пренебрежимо малой. Следовательно, спин и орбитальный угловой момент должны быть объединены
и рассчитанный магнитный момент определяется как
В актинидах спин-орбитальная связь сильна и приближается к связи j j .
Это означает, что трудно рассчитать эффективный момент. Например, уран(IV), f 2 , в комплексе [UCl 6 ] 2− имеет измеренный эффективный момент 2,2 μ B , который включает вклад от температурно-независимого парамагнетизма. [26]


Очень немногие соединения основных групп элементов являются парамагнитными. Известные примеры включают: кислород , O 2 ; оксид азота , NO; диоксид азота , NO 2 и диоксид хлора , ClO 2 . В органической химии соединения с неспаренным электроном называются свободными радикалами . Свободные радикалы, за некоторыми исключениями, являются короткоживущими, потому что один свободный радикал будет быстро реагировать с другим, поэтому их магнитные свойства трудно изучать. Однако, если радикалы хорошо отделены друг от друга в разбавленном растворе в твердой матрице при низкой температуре, их можно изучать с помощью электронного парамагнитного резонанса (ЭПР). Такие радикалы генерируются при облучении. Обширные исследования ЭПР выявили много информации о делокализации электронов в свободных радикалах. Смоделированный спектр радикала CH 3 • показывает сверхтонкое расщепление из-за взаимодействия электрона с 3 эквивалентными ядрами водорода, каждое из которых имеет спин 1/2. [27] [28]
Спиновые метки представляют собой долгоживущие свободные радикалы, которые можно вставлять в органические молекулы, чтобы их можно было изучать с помощью ЭПР. [29] Например, нитроксид MTSL , функционализированное производное оксида тетраметилпиперидина, TEMPO , используется в направленной спиновой маркировке .
Ион гадолиния , Gd3 + , имеет электронную конфигурацию f7 , со всеми параллельными спинами. Соединения иона Gd3 + являются наиболее подходящими для использования в качестве контрастного вещества для МРТ-сканирования . [30] Магнитные моменты соединений гадолиния больше, чем у любого иона переходного металла. Гадолиний предпочтительнее других ионов лантаноидов, некоторые из которых имеют большие эффективные моменты, из-за того, что он имеет невырожденное электронное основное состояние . [31]
В течение многих лет природа оксигемоглобина , Hb-O 2 , была весьма спорной. Экспериментально было обнаружено, что он диамагнитен. Дезоксигемоглобин, как правило, считается комплексом железа в степени окисления +2 , то есть системой ad 6 с высокоспиновым магнитным моментом, близким к значению только спина 4,9 μ B . Было высказано предположение, что железо окисляется, а кислород восстанавливается до супероксида.
Затем было предложено, что спаривание электронов от Fe 3+ и O 2 − происходит посредством обменного механизма. Теперь было показано, что на самом деле железо(II) меняется с высокоспинового на низкоспиновое, когда молекула кислорода отдает пару электронов железу. В то время как в дезоксигемоглобине атом железа лежит над плоскостью гема, в низкоспиновом комплексе эффективный ионный радиус уменьшается, и атом железа лежит в плоскости гема. [32]
Эта информация имеет важное значение для исследований по поиску искусственных переносчиков кислорода .
Соединения галлия(II) были неизвестны до недавнего времени. Поскольку атомный номер галлия — нечетное число (31), Ga2 + должен иметь неспаренный электрон. Предполагалось, что он будет действовать как свободный радикал и иметь очень короткое время жизни. Отсутствие соединений Ga(II) было частью так называемого эффекта инертной пары . Когда были синтезированы соли аниона с эмпирической формулой, такой как [GaCl3 ] − , было обнаружено, что они являются диамагнитными . Это подразумевало образование связи Ga-Ga и димерной формулы, [Ga2Cl6 ] 2− . [ 33]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )