
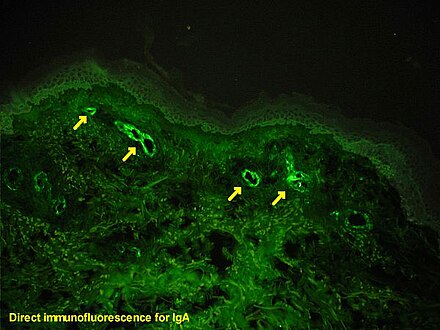

Иммуногистохимия — это форма иммуноокрашивания . Она включает в себя процесс селективной идентификации антигенов (белков) в клетках и тканях, используя принцип связывания антител с антигенами в биологических тканях . Альберт Хьюитт Кунс , Эрнест Берлинер , Норман Джонс и Хью Дж. Крич были первыми, кто разработал иммунофлуоресценцию в 1941 году. Это привело к последующему развитию иммуногистохимии. [2] [3]
Иммуногистохимическое окрашивание широко используется в диагностике аномальных клеток, таких как те, что обнаруживаются в раковых опухолях. В некоторых раковых клетках экспрессируются определенные опухолевые антигены, которые позволяют обнаружить. Иммуногистохимия также широко используется в фундаментальных исследованиях, чтобы понять распределение и локализацию биомаркеров и дифференциально экспрессируемых белков в различных частях биологической ткани. [4]
Иммуногистохимию можно проводить на тканях, которые были зафиксированы и залиты в парафин , а также на криоконсервированных (замороженных) тканях. В зависимости от способа консервации ткани существуют различные этапы подготовки ткани к иммуногистохимии, но общий метод включает надлежащую фиксацию, инкубацию для извлечения антигена с первичным антителом, затем инкубацию со вторичным антителом. [5] [6]
Фиксация ткани важна для сохранения ткани и поддержания клеточной морфологии. Формула фиксации, соотношение фиксатора к ткани и время в фиксаторе повлияют на результат. Фиксирующий раствор (фиксатор) часто представляет собой 10% нейтральный буферный формалин . Обычное время фиксации составляет 24 часа при комнатной температуре. Соотношение фиксатора к ткани колеблется от 1:1 до 1:20. После фиксации ткани ее можно залить парафином. [5] [6]
Для замороженных срезов фиксация обычно выполняется после срезов, если не собираются тестировать новые антитела. Затем можно использовать ацетон или формалин. [6]
Разделение образца ткани выполняется с помощью микротома. Для залитой парафином ткани нормальная толщина составляет 4 мкм, а для замороженных срезов — 4–6 мкм. [6] Толщина нарезанных срезов имеет значение и является важным фактором в иммуногистохимии. Если сравнить срез мозговой ткани толщиной 4 мкм с срезом толщиной 7 мкм, то часть того, что вы видите в срезе толщиной 7 мкм, может отсутствовать в срезе толщиной 4 мкм. Это показывает важность подробных методов, связанных с этой методологией. [7] Залитые парафином ткани следует депарафинировать, чтобы удалить весь парафин на образце ткани и вокруг него в ксилоле или хорошем заменителе, а затем в спирте. [8]
Извлечение антигена необходимо для того, чтобы сделать эпитопы доступными для иммуногистохимического окрашивания большинства срезов тканей, фиксированных формалином. Эпитопы являются сайтами связывания для антител, используемых для визуализации целевого антигена, который может быть замаскирован из-за фиксации. Фиксация ткани может вызвать образование метиленовых мостиков или сшивание аминогрупп, так что эпитопы больше не будут доступны. Извлечение антигена может восстановить замаскированную антигенность, возможно, путем разрушения сшивок, вызванных фиксацией. [9] Наиболее распространенным способом выполнения извлечения антигена является использование высокотемпературного нагрева при замачивании слайдов в буферном растворе. [10] Это можно сделать разными способами, например, с помощью микроволновой печи, автоклавов, нагревательных пластин или водяных бань. Для замороженных срезов извлечение антигена, как правило, не требуется, но для замороженных срезов, фиксированных в ацетоне или формалине, извлечение антигена может улучшить иммуногистохимический сигнал. [6]
Неспецифическое связывание антител может вызвать фоновое окрашивание. Хотя антитела связываются со специфическими эпитопами, они также могут частично или слабо связываться с участками на неспецифических белках, которые похожи на участок связывания на целевом белке. Инкубируя ткань с нормальной сывороткой, выделенной из вида, который был произведен вторичным антителом, фоновое окрашивание можно уменьшить. Также можно использовать коммерчески доступные универсальные блокирующие буферы. Другие распространенные блокирующие буферы включают нормальную сыворотку, обезжиренное сухое молоко, BSA или желатин. [5] [6] Эндогенная активность ферментов также может вызвать фоновое окрашивание, но ее можно уменьшить, если ткань обработать перекисью водорода. [5]
После подготовки образца, цель может быть визуализирована с помощью антител, меченых флуоресцентными соединениями, металлами или ферментами. Существуют прямые и косвенные методы маркировки образца. [6] [11]
Антитела, используемые для обнаружения, могут быть поликлональными или моноклональными. Поликлональные антитела производятся с использованием животных, таких как морская свинка, кролик, мышь, крыса или коза. Животному вводят интересующий антиген, и он вызывает иммунный ответ. Антитела можно выделить из всей сыворотки животного. Производство поликлональных антител приведет к образованию смеси различных антител и будет распознавать несколько эпитопов. Моноклональные антитела производятся путем инъекции животному интересующего антигена и последующего выделения продуцирующей антитело В-клетки, как правило, из селезенки. Затем продуцирующая антитело клетка сливается с линией раковых клеток. Это заставляет антитела проявлять специфичность к одному эпитопу. [12]
Для иммуногистохимических стратегий обнаружения антитела классифицируются как первичные или вторичные реагенты. Первичные антитела вырабатываются против интересующего антигена и обычно неконъюгированы (немаркированы). Вторичные антитела вырабатываются против иммуноглобулинов первичных видов антител. Вторичное антитело обычно конъюгируется с линкерной молекулой, такой как биотин, которая затем рекрутирует репортерные молекулы, или само вторичное антитело напрямую связывается с репортерной молекулой. [11]
Прямой метод представляет собой одношаговый метод окрашивания, включающий меченое антитело, реагирующее непосредственно с антигеном в срезах тканей. Хотя этот метод использует только одно антитело и поэтому является простым и быстрым, его чувствительность ниже из-за небольшого усиления сигнала, в отличие от непрямых подходов. [11]
Косвенный метод включает немеченое первичное антитело, которое связывается с целевым антигеном в ткани. Затем вторичное антитело, которое связывается с первичным антителом, добавляется в качестве второго слоя. Как уже упоминалось, вторичное антитело должно быть получено против антитела IgG того вида животных, у которого было получено первичное антитело. Этот метод более чувствителен, чем стратегии прямого обнаружения, из-за усиления сигнала из-за связывания нескольких вторичных антител с каждым первичным антителом. [11]
Косвенный метод, помимо большей чувствительности, также имеет то преимущество, что необходимо генерировать только относительно небольшое количество стандартных конъюгированных (меченых) вторичных антител. Например, меченое вторичное антитело, полученное против IgG кролика, полезно с любым первичным антителом, полученным у кролика. Это особенно полезно, когда исследователь маркирует более одного первичного антитела, будь то из-за поликлонального отбора, производящего массив первичных антител для одного антигена, или когда есть интерес к нескольким антигенам. При прямом методе необходимо маркировать каждое первичное антитело для каждого интересующего антигена. [11]

Репортерные молекулы различаются в зависимости от природы метода обнаружения, наиболее распространенными из которых являются хромогенное и флуоресцентное обнаружение. В хромогенной иммуногистохимии антитело конъюгируется с ферментом, таким как щелочной фосфат и пероксидаза хрена, который может катализировать реакцию, производящую цвет, в присутствии хромогенного субстрата, такого как диаминобензидин. [5] Окрашенный продукт можно проанализировать с помощью обычного светового микроскопа. [13] В иммунофлуоресценции антитело помечается флуорофором , таким как изотиоцианат флуоресцеина , изотиоцианат тетраметилродамина, ацетат аминометилкумарина или цианин5. Также обычно используются синтетические флуорохромы от Alexa Fluors. [13] [14] Флуорохромы можно визуализировать с помощью флуоресцентного или конфокального микроскопа. [13]
Для хромогенных и флуоресцентных методов обнаружения денситометрический анализ сигнала может предоставить полу- и полностью количественные данные, соответственно, для корреляции уровня сигнала репортера с уровнем экспрессии или локализации белка. [6]
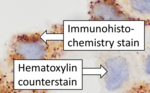
После иммуногистохимического окрашивания целевого антигена часто применяется другое окрашивание. Контрастное окрашивание обеспечивает контраст, который помогает выделить первичное окрашивание и облегчает изучение морфологии ткани. Оно также помогает с ориентацией и визуализацией среза ткани. Обычно используется гематоксилин. [6] [15]
В иммуногистохимических методах существует несколько этапов, предшествующих окончательному окрашиванию ткани, которые могут вызвать множество проблем. Это может быть сильное фоновое окрашивание, слабое окрашивание целевого антигена и наличие артефактов. Важно, чтобы качество антител и методы иммуногистохимии были оптимизированы. [16] Эндогенный биотин, репортерные ферменты или первичная/вторичная перекрестная реактивность антител являются частыми причинами сильного фонового окрашивания. [11] [13] Слабое или отсутствующее окрашивание может быть вызвано неточной фиксацией ткани или низким уровнем антигена. Эти аспекты подготовки ткани для иммуногистохимии и окрашивания антител должны систематически рассматриваться для выявления и устранения проблем окрашивания. [5] [6]

Методы устранения фонового окрашивания включают разбавление первичных или вторичных антител, изменение времени или температуры инкубации и использование другой системы обнаружения или другого первичного антитела. Контроль качества должен как минимум включать ткань, о которой известно, что она экспрессирует антиген, в качестве положительного контроля и отрицательные контроли ткани, о которой известно, что она не экспрессирует антиген, а также тестовую ткань, исследованную таким же образом с исключением первичного антитела (или лучше, абсорбцией первичного антитела). [5] [18]

Иммуногистохимия является прекрасным методом обнаружения и имеет огромное преимущество, поскольку позволяет точно показать, где именно находится данный белок в исследуемой ткани. Это также эффективный способ исследования тканей. Это сделало его широко используемым методом в нейронауке , позволяя исследователям изучать экспрессию белка в определенных структурах мозга. Его основным недостатком является то, что в отличие от методов иммуноблоттинга , где окрашивание проверяется по шкале молекулярной массы , в иммуногистохимии невозможно показать, что окрашивание соответствует интересующему белку. По этой причине первичные антитела должны быть хорошо проверены в вестерн-блоте или аналогичной процедуре. Этот метод еще более широко используется в диагностической хирургической патологии для иммунофенотипирования опухолей (например, иммуноокрашивание на e-кадгерин для дифференциации протоковой карциномы in situ (окрашивание положительное) и дольковой карциномы in situ (не окрашивание положительное) [19] ). В последнее время иммуногистохимические методы стали полезными в дифференциальной диагностике множественных форм карцином слюнных желез, головы и шеи. [20]
Разнообразие иммуногистохимических маркеров, используемых в диагностической хирургической патологии, является значительным. Многие клинические лаборатории в больницах третьего уровня будут иметь меню из более чем 200 антител, используемых в качестве диагностических, прогностических и предиктивных биомаркеров. Примеры некоторых часто используемых маркеров включают:

Разнообразие молекулярных путей изменяется при раке, и некоторые изменения могут быть направлены на терапию рака. Иммуногистохимия может быть использована для оценки того, какие опухоли, скорее всего, будут реагировать на терапию, путем обнаружения наличия или повышенных уровней молекулярной мишени. [ необходима цитата ]
Биология опухолей допускает ряд потенциальных внутриклеточных мишеней. Многие опухоли зависят от гормонов. Наличие гормональных рецепторов может быть использовано для определения того, является ли опухоль потенциально восприимчивой к антигормональной терапии. Одним из первых методов лечения был антиэстроген тамоксифен , используемый для лечения рака молочной железы. Такие гормональные рецепторы можно обнаружить с помощью иммуногистохимии. [23] Иматиниб , внутриклеточный ингибитор тирозинкиназы , был разработан для лечения хронического миелоидного лейкоза , заболевания, характеризующегося образованием специфической аномальной тирозинкиназы. Имитаниб оказался эффективным в опухолях, которые экспрессируют другие тирозинкиназы, в первую очередь KIT. Большинство желудочно-кишечных стромальных опухолей экспрессируют KIT, который можно обнаружить с помощью иммуногистохимии. [24]
Многие белки, которые, как показала иммуногистохимия, сильно активируются при патологических состояниях, являются потенциальными мишенями для терапии с использованием моноклональных антител . Моноклональные антитела, благодаря своему размеру, используются против мишеней на поверхности клеток. Среди сверхэкспрессируемых мишеней есть члены семейства EGFR , трансмембранные белки с внеклеточным рецепторным доменом, регулирующим внутриклеточную тирозинкиназу. [25] Из них HER2/neu (также известный как Erb-B2) был разработан первым. Молекула сильно экспрессируется в различных типах раковых клеток, в частности, в клетках рака молочной железы. Таким образом, антитела против HER2/neu были одобрены FDA для клинического лечения рака под лекарственным названием Herceptin . Существуют коммерчески доступные иммуногистохимические тесты, Dako HercepTest, Leica Biosystems Oracle [26] и Ventana Pathway. [27]
Аналогично, рецептор эпидермального фактора роста (HER-1) сверхэкспрессируется при различных видах рака, включая рак головы и шеи и толстой кишки. Иммуногистохимия используется для определения пациентов, которым могут помочь терапевтические антитела, такие как Эрбитукс (цетуксимаб). [28] Коммерческие системы для обнаружения рецептора эпидермального фактора роста с помощью иммуногистохимии включают Dako pharmDx.
Иммуногистохимия также может использоваться для более общего профилирования белков при условии наличия антител, проверенных для иммуногистохимии. Атлас белков человека отображает карту экспрессии белков в нормальных органах и тканях человека. Сочетание иммуногистохимии и тканевых микрочипов обеспечивает паттерны экспрессии белков в большом количестве различных типов тканей. Иммуногистохимия также используется для профилирования белков в наиболее распространенных формах рака человека. [29] [30]
{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка )Последнее обновление состава: 25 января 2024 г.{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )