
Вестерн -блоттинг (иногда называемый белковым иммуноблоттингом ) или вестерн-блоттингом — это широко используемый аналитический метод в молекулярной биологии и иммуногенетике для обнаружения специфических белков в образце гомогената или экстракта ткани. [1] Помимо обнаружения белков, этот метод также используется для визуализации, различения и количественной оценки различных белков в сложной комбинации белков. [2]
Метод вестерн-блоттинга использует три элемента для достижения своей задачи по отделению определенного белка от комплекса: разделение по размеру, перенос белка на твердую подложку и маркировка целевого белка с использованием первичного и вторичного антитела для визуализации. [1] Создается синтетическое или животное антитело (известное как первичное антитело ), которое распознает и связывается с определенным целевым белком. Электрофорезная мембрана промывается в растворе, содержащем первичное антитело, перед тем как избыток антитела смывается. [3] Добавляется вторичное антитело , которое распознает и связывается с первичным антителом. Вторичное антитело визуализируется с помощью различных методов, таких как окрашивание , иммунофлуоресценция и радиоактивность, что позволяет косвенно обнаруживать определенный целевой белок. [3]
Другие родственные методы включают анализ дот-блоттинга , количественный дот-блоттинг , иммуногистохимию и иммуноцитохимию , где антитела используются для обнаружения белков в тканях и клетках с помощью иммуноокрашивания , а также иммуноферментный анализ (ИФА).
Название вестерн-блот является игрой слов « саузерн-блот » , метод обнаружения ДНК , названный в честь его изобретателя, английского биолога Эдвина Саузерна . Аналогично, обнаружение РНК называется « северный блот » . [4] Термин «вестерн-блот» был предложен У. Нилом Бернеттом в 1981 году, [5] хотя сам метод был независимо изобретен в 1979 году Хайме Ренартом, Якобом Райзером и Джорджем Старком в Стэнфордском университете , [6] и Гарри Тоубином, Теофилом Штеелином и Джулианом Гордоном в Институте Фридриха Мишера в Базеле , Швейцария . [7] Группа Тоубина также использовала вторичные антитела для обнаружения, таким образом напоминая фактический метод, который почти повсеместно используется сегодня. В период с 1979 по 2019 год «он упоминался в заголовках, аннотациях и ключевых словах более чем 400 000 публикаций, перечисленных в PubMed », и, возможно, по-прежнему является наиболее используемым методом анализа белков. [8]

Вестерн-блот широко используется в биохимии для качественного обнаружения отдельных белков и модификаций белков (таких как посттрансляционные модификации ). По оценкам, по крайней мере 8–9% всех публикаций, связанных с белками, используют вестерн-блот. [8] Он используется как общий метод для определения наличия определенного отдельного белка в сложной смеси белков. Полуколичественная оценка белка может быть получена из размера и интенсивности цвета полосы белка на мембране блота. Кроме того, применение серии разведений очищенного белка известных концентраций может использоваться для более точной оценки концентрации белка. Вестерн-блот обычно используется для проверки продукции белка после клонирования . Он также используется в медицинской диагностике, например, в тесте на ВИЧ или тесте на губчатую энцефалопатию крупного рогатого скота (ГЭКРС) . [9]
Подтверждающий тест на ВИЧ использует вестерн-блот для обнаружения антител к ВИЧ в образце сыворотки человека . Белки из известных ВИЧ -инфицированных клеток разделяются и наносятся на мембрану, как указано выше. Затем сыворотка для тестирования применяется на этапе инкубации первичных антител; свободное антитело смывается, и добавляется вторичное античеловеческое антитело, связанное с сигналом фермента. Окрашенные полосы затем указывают на белки, к которым сыворотка пациента содержит антитела. [10] Вестерн-блот также используется в качестве окончательного теста на вариант болезни Крейтцфельдта-Якоба , тип прионного заболевания, связанного с потреблением зараженной говядины от крупного рогатого скота с губчатой энцефалопатией крупного рогатого скота (ГЭКРС, обычно называемой «коровьим бешенством»). [11] Другое применение — диагностика туляремии . Оценка способности вестерн-блота обнаруживать антитела против F. tularensis показала, что его чувствительность составляет почти 100%, а специфичность — 99,6%. [12] Некоторые формы тестирования на болезнь Лайма используют вестерн-блоттинг. [13] Вестерн-блоттинг также может использоваться в качестве подтверждающего теста на инфекцию гепатита B и инфекцию HSV-2 (герпес типа 2). [14] [15] В ветеринарии вестерн-блоттинг иногда используется для подтверждения статуса FIV + у кошек. [16]
Дальнейшие применения метода вестерн-блоттинга включают его использование Всемирным антидопинговым агентством (WADA). Кровяной допинг — это злоупотребление определенными методами и/или веществами для увеличения массы эритроцитов, что позволяет организму переносить больше кислорода к мышцам и, следовательно, повышать выносливость и производительность. Существует три широко известных вещества или метода, используемых для кровяного допинга, а именно эритропоэтин (ЭПО), синтетические переносчики кислорода и переливание крови. Каждый из них запрещен в Списке запрещенных веществ и методов ВАДА. Метод вестерн-блоттинга использовался во время чемпионата мира по футболу FIFA 2014 года в антидопинговой кампании для этого события. [17] В общей сложности Райхель и др. [18] собрали и проанализировали более 1000 образцов в аккредитованной ВАДА лаборатории Лозанны, Швейцария . Недавние исследования с использованием метода вестерн-блоттинга показали улучшенное обнаружение ЭПО в крови и моче на основе новых горизонтальных гелей Velum SAR, оптимизированных для рутинного анализа. [19] Благодаря использованию горизонтального SAR-PAGE в сочетании с предварительно отлитыми пленочными гелями Velum SAR дискриминационная способность микродозового применения рЭПО значительно улучшилась.
Помимо применения вестерн-блоттинга в научных исследованиях, он также используется в областях клинических исследований. Поскольку его можно применять для прямого процесса идентификации белков, вестерн-блоттинг считается мощным диагностическим инструментом, который часто используется в клинических условиях. Методы обнаружения ВБ и белков можно использовать для поиска биомаркеров заболеваний, таких как специфические белки или антитела. Считается, что это жизнеспособный метод для идентификации определенных белков во время диагностики таких заболеваний, как рак, аутоиммунные заболевания и прионные расстройства. Обнаружение нескольких биомаркеров, используемых в диагностике неврологических и онкологических заболеваний, с помощью вестерн-блоттинга является обычной процедурой. [2] [20] [21] Например, широко распространено мнение, что появление множественной лекарственной устойчивости (МЛУ) сделало эффективную терапию рака чрезвычайно сложной. Поэтому раннее, точное и чувствительное обнаружение механизма МЛУ имеет важное значение, как и поиск более эффективных химиотерапевтических подходов для применения в клинических условиях. Экспрессия MDR1/P-гликопротеина в линиях клеток P388/ADR, P388 и HCT-15 исследована с использованием техники WB. WB также определил уровни MRP1. [2] [22] [23]
С другой стороны, поскольку вестерн-блот может различать различные изоформы белков, его можно использовать для диагностики заболеваний, связанных с прионами и изоформами белков, таких как рак. Например, анализ вестерн-блоттинга изоформного паттерна белков 14-3-3 в мозговой жидкости может идентифицировать болезнь Крейтцфельдта-Якоба. [2] [24] Кроме того, болезнь легких фермеров является легочным заболеванием, вызванным вдыханием антигенных частиц, и исследования показали, что вестерн-блоттинг может быть полезным вариантом для идентификации иммунореактивных белков, связанных с болезнью легких фермеров. [2] Кроме того, вестерн-блоттинг также используется для идентификации белков в синовиальной жидкости и сыворотке, что позволяет диагностировать клинические симптомы остеоартрита и ревматоидного артрита. [2] [25] вестерн-блоттинг используется для оценки уровней экспрессии белка FSTL1 у людей с остеоартритом коленного сустава, который служит потенциальным биомаркером повреждения суставов. [2] [26] Кроме того, он используется для идентификации белков в синовиальной жидкости и сыворотке, что позволяет диагностировать клинические симптомы остеоартрита и ревматоидного артрита. Он используется для оценки уровней экспрессии белка FSTL1 у людей с остеоартритом колена, который служит потенциальным биомаркером повреждения суставов. [2] [27] [28]
Для разработки лекарств, идентификации терапевтических мишеней и биологических исследований важно понимать, где белки находятся внутри клетки. [2] [29] Субклеточное расположение белков внутри клетки и их функции тесно связаны. Связь между функцией белка и локализацией предполагает, что когда белки перемещаются, их функции могут изменяться или приобретать новые характеристики. Субклеточное размещение белка можно определить с помощью различных методов. Были созданы и использованы многочисленные эффективные и надежные вычислительные инструменты и стратегии для определения субклеточной локализации белка. [30] С помощью методов субклеточного фракционирования WB продолжает оставаться важным фундаментальным методом для исследования и понимания локализации белка. [2]
Благодаря своим различным эпитопам антитела привлекли внимание как в фундаментальных, так и в клинических исследованиях. Основой характеристики и проверки антител является картирование эпитопов. Процедура идентификации участков связывания антител (эпитопов) на целевом белке называется «картированием эпитопов». Нахождение связывающего эпитопа антитела имеет важное значение для открытия и создания новых вакцин, диагностических и терапевтических средств. [2] В результате были созданы различные методы картирования эпитопов антител. На данный момент специфичность вестерн-блоттинга является главной особенностью, которая отличает его от других методов картирования эпитопов. Существует несколько применений вестерн-блоттинга для картирования эпитопов на образцах кожи человека, вирусе геморрагического заболевания. [2] [31] [32]

Метод вестерн-блоттинга состоит из гель-электрофореза для разделения нативных белков по трехмерной структуре или денатурированных белков по длине полипептида с последующим электрофоретическим переносом на мембрану (чаще всего ПВДФ или нитроцеллюлозу ) и процедурой иммуноокрашивания для визуализации определенного белка на мембране блота.
Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) обычно используется для денатурирующего электрофоретического разделения белков. Додецилсульфат натрия (SDS) обычно используется в качестве буфера (а также в геле), чтобы придать всем присутствующим белкам однородный отрицательный заряд, поскольку белки могут быть заряжены положительно, отрицательно или нейтрально. Перед электрофорезом образцы белков часто кипятят для денатурации присутствующих белков. Это гарантирует разделение белков по размеру и предотвращает деградацию образцов протеазами (ферментами, расщепляющими белки). После электрофоретического разделения белки переносятся на мембрану (обычно нитроцеллюлозную или PVDF). Затем мембрану часто окрашивают Ponceau S , чтобы визуализировать белки на блоте и обеспечить надлежащий перенос. Затем белки блокируют молоком (или другими блокирующими агентами), чтобы предотвратить неспецифическое связывание антител, а затем окрашивают антителами, специфичными для целевого белка. [7] [6] Наконец, мембрана будет окрашена вторичным антителом, которое распознает первое окрашивание антитела, которое затем может быть использовано для обнаружения различными методами. Этап гель-электрофореза включен в анализ вестерн-блоттинга для решения проблемы перекрестной реактивности антител.
В качестве важного шага в проведении вестерн-блоттинга подготовка образца должна быть выполнена эффективно, поскольку на интерпретацию этого анализа влияет подготовка белка, которая состоит из процессов экстракции и очистки белка. [33] [3] Для достижения эффективной экстракции белка необходимо выбрать правильный метод гомогенизации, поскольку он отвечает за разрыв клеточной мембраны и высвобождение внутриклеточных компонентов. [3] [34] Кроме того, необходим идеальный буфер лизиса для получения значительных количеств целевого содержания белка, поскольку буфер руководит процессом солюбилизации белка и предотвращает деградацию белка. После завершения подготовки образца содержимое белка готово к разделению с использованием гель-электрофореза. [3]

Белки образца разделяются с помощью гель-электрофореза . Разделение белков может осуществляться по изоэлектрической точке (pI), молекулярной массе , электрическому заряду или комбинации этих факторов. Характер разделения зависит от обработки образца и природы геля.
Наиболее распространенный тип гель-электрофореза использует полиакриламидные гели и буферы, загруженные додецилсульфатом натрия (SDS). SDS-PAGE (электрофорез в полиакриламидном геле с SDS) поддерживает полипептиды в денатурированном состоянии после того, как они были обработаны сильными восстановителями для удаления вторичной и третичной структуры (например, дисульфидных связей [SS] с сульфгидрильными группами [SH и SH]), и, таким образом, позволяет разделять белки по их молекулярной массе . Отобранные белки покрываются отрицательно заряженным SDS, фактически становясь анионными , и мигрируют к положительно заряженному (более высокому напряжению) аноду (обычно имеющему красный провод) через акриламидную сетку геля. Более мелкие белки мигрируют быстрее через эту сетку, и, таким образом, белки разделяются в соответствии с размером (обычно измеряемым в килодальтонах, кДа ). Концентрация акриламида определяет разрешение геля — чем больше концентрация акриламида, тем лучше разрешение белков с более низкой молекулярной массой. Чем ниже концентрация акриламида, тем лучше разрешение белков с более высокой молекулярной массой. Для большинства пятен белки перемещаются только в одном измерении вдоль геля.
Образцы загружаются в лунки геля. Одна полоса обычно резервируется для маркера или лестницы , которая представляет собой коммерчески доступную смесь белков с известным молекулярным весом, обычно окрашенную таким образом, чтобы образовывать видимые цветные полосы. Когда вдоль геля подается напряжение , белки мигрируют через него с разной скоростью в зависимости от их размера. Эти разные скорости продвижения (разные электрофоретические подвижности ) разделяются на полосы внутри каждой полосы . Затем полосы белка можно сравнить с полосами лестницы, что позволяет оценить молекулярный вес белка.
Также возможно использовать двумерный гель , который распределяет белки из одного образца в двух измерениях. Белки разделяются в соответствии с изоэлектрической точкой ( pH , при котором они имеют нейтральный суммарный заряд) в первом измерении и в соответствии с их молекулярной массой во втором измерении.

Чтобы сделать белки доступными для обнаружения антителами, их перемещают из геля на мембрану, твердую подложку, которая является неотъемлемой частью процесса. Существует два типа мембран: нитроцеллюлоза (NC) или поливинилидендифторид (PVDF ). Мембрана NC имеет высокое сродство к белку и его удерживающие способности. Однако NC хрупкая и не позволяет использовать блот для повторного зондирования, тогда как мембрана PVDF позволяет повторно зондировать блот. [1] Наиболее часто используемый метод переноса белков называется электроблоттингом . Электроблоттинг использует электрический ток для вытягивания отрицательно заряженных белков из геля к положительно заряженному аноду и в мембрану PVDF или NC. Белки перемещаются из геля на мембрану, сохраняя при этом организацию, которую они имели внутри геля. Более старый метод переноса заключается в размещении мембраны поверх геля и стопки фильтровальной бумаги поверх нее. Вся стопка помещается в буферный раствор, который перемещается по бумаге капиллярным путем , увлекая за собой белки. На практике этот метод нечасто используется из-за длительности процедуры.
В результате любого из процессов переноса белки экспонируются на тонком слое мембраны для обнаружения. Оба типа мембран выбраны из-за их неспецифических свойств связывания белков (т. е. связывают все белки одинаково хорошо). Связывание белков основано на гидрофобных взаимодействиях, а также на заряженных взаимодействиях между мембраной и белком. Мембраны из нитроцеллюлозы дешевле, чем ПВДФ, но они гораздо более хрупкие и не выдерживают повторных зондирований.
Окрашивание общего белка позволяет визуализировать общий белок, который был успешно перенесен на мембрану, что позволяет пользователю проверить однородность переноса белка и выполнить последующую нормализацию целевого белка с фактическим количеством белка на дорожку. Нормализация с так называемым «контролем загрузки» была основана на иммуноокрашивании белков домашнего хозяйства в классической процедуре, но в последнее время движется к окрашиванию общего белка из-за многочисленных преимуществ. [35] Было описано по крайней мере семь различных подходов к окрашиванию общего белка для нормализации вестерн-блоттинга: Ponceau S , методы без окрашивания, Sypro Ruby, Epicocconone , Coomassie R-350 , Amido Black и Cy5 . [35] Чтобы избежать шума сигнала, окрашивание общего белка следует проводить до блокирования мембраны. Тем не менее, были описаны также и пост-антителовые окрашивания. [36]
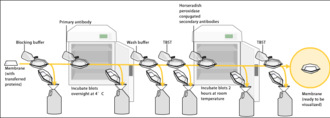
Поскольку мембрана была выбрана из-за ее способности связывать белок, а также поскольку и антитела, и мишень являются белками, необходимо предпринять шаги для предотвращения взаимодействия между мембраной и антителом, используемым для обнаружения целевого белка. Блокирование неспецифического связывания достигается путем помещения мембраны в разбавленный раствор белка — обычно 3–5% бычьего сывороточного альбумина (БСА) или обезжиренного сухого молока (оба недорогие) в трис-буферном физиологическом растворе (TBS) или I-Block, с незначительным процентом (0,1%) детергента, такого как Tween 20 или Triton X-100 . Хотя обезжиренное сухое молоко является предпочтительным из-за его доступности, необходим соответствующий блокирующий раствор, поскольку не все белки в молоке совместимы со всеми полосами обнаружения. [1] Белок в разбавленном растворе прикрепляется к мембране во всех местах, где не прикрепились целевые белки. Таким образом, при добавлении антитела оно не может связаться с мембраной, и, следовательно, единственным доступным местом связывания является специфический целевой белок. Это снижает фоновый уровень в конечном продукте вестерн-блота, что приводит к получению более четких результатов и исключает ложноположительные результаты.

В процессе обнаружения мембрана «зондируется» на наличие интересующего белка с помощью модифицированного антитела, связанного с репортерным ферментом; при воздействии соответствующего субстрата этот фермент запускает колориметрическую реакцию и производит цвет. По разным причинам это традиционно происходит в двухэтапном процессе, хотя в настоящее время для определенных приложений доступны одноэтапные методы обнаружения.
Первичные антитела вырабатываются , когда вид хозяина или культура иммунных клеток подвергается воздействию интересующего белка (или его части). Обычно это часть иммунного ответа, тогда как здесь они собираются и используются как чувствительные и специфичные инструменты обнаружения, которые связывают белок напрямую.
После блокировки раствор первичного антитела (обычно от 0,5 до 5 мкг/мл), разведенный в промывочном буфере PBS или TBST, инкубируют с мембраной при осторожном перемешивании в течение часа при комнатной температуре или в течение ночи при 4 ° C. Его также можно инкубировать при разных температурах, причем более низкие температуры связаны с большим связыванием, как специфическим (к целевому белку, «сигнал»), так и неспецифическим («шум»). После инкубации мембрану несколько раз промывают в промывочном буфере для удаления несвязанного первичного антитела и, таким образом, минимизации фона. [1] Обычно промывочный буферный раствор состоит из буферного физиологического раствора с небольшим процентом детергента, а иногда и с порошковым молоком или BSA.
После промывки мембраны для удаления несвязанного первичного антитела мембрана подвергается воздействию другого антитела, известного как вторичное антитело . Антитела поступают из животных источников (или из культур гибридом животного происхождения ). Вторичное антитело распознает и связывается с видоспецифической частью первичного антитела. Поэтому вторичное антитело против мыши будет связываться практически с любым первичным антителом мышиного происхождения и может называться «антивидовым» антителом (например, против мыши, против козла и т. д.). Чтобы обеспечить обнаружение целевого белка, вторичное антитело обычно связывают с биотином или репортерным ферментом, таким как щелочная фосфатаза или пероксидаза хрена . Это означает, что несколько вторичных антител будут связываться с одним первичным антителом и усиливать сигнал, позволяя обнаруживать белки гораздо более низкой концентрации, чем было бы видно только с помощью SDS-PAGE.
Пероксидаза хрена обычно связана со вторичными антителами, чтобы обеспечить обнаружение целевого белка с помощью хемилюминесценции . Хемилюминесцентный субстрат расщепляется пероксидазой хрена, что приводит к образованию люминесценции . Таким образом, образование люминесценции пропорционально количеству конъюгированного с пероксидазой хрена вторичного антитела, и, следовательно, косвенно измеряет наличие целевого белка. Чувствительный лист фотопленки помещается напротив мембраны, и воздействие света от реакции создает изображение антител, связанных с пятном. Более дешевый, но менее чувствительный подход использует окрашивание 4-хлорнафтолом с 1% перекисью водорода ; реакция пероксидных радикалов с 4-хлорнафтолом дает темно-фиолетовое окрашивание, которое можно сфотографировать без использования специальной фотопленки.
Как и в процедурах ELISPOT и ELISA , фермент может быть снабжен молекулой субстрата, которая будет преобразована ферментом в окрашенный продукт реакции, который будет виден на мембране (см. рисунок ниже с синими полосами).
Другой метод обнаружения вторичных антител использует антитело, связанное с флуорофором в ближнем инфракрасном диапазоне. Свет, возникающий при возбуждении флуоресцентного красителя, является статическим, что делает флуоресцентное обнаружение более точным и аккуратным измерением разницы в сигнале, создаваемом мечеными антителами, связанными с белками на вестерн-блоте. Белки могут быть точно количественно определены, поскольку сигнал, создаваемый различным количеством белков на мембранах, измеряется в статическом состоянии, в отличие от хемилюминесценции, при которой свет измеряется в динамическом состоянии. [37]
Третья альтернатива — использовать радиоактивную метку вместо фермента, связанного со вторичным антителом, например, маркировать связывающий антитело белок, такой как белок А стафилококка или стрептавидин, радиоактивным изотопом йода. Поскольку другие методы безопаснее, быстрее и дешевле, этот метод сейчас используется редко; однако преимуществом этого подхода является чувствительность визуализации на основе авторадиографии, которая позволяет проводить высокоточную количественную оценку белка в сочетании с оптическим программным обеспечением (например, Optiquant).
Исторически процесс зондирования выполнялся в два этапа из-за относительной простоты получения первичных и вторичных антител в отдельных процессах. Это дает исследователям и корпорациям огромные преимущества с точки зрения гибкости, снижения затрат и добавляет этап амплификации к процессу обнаружения. Однако, учитывая появление высокопроизводительного анализа белков и более низких пределов обнаружения, возник интерес к разработке одноэтапных систем зондирования, которые позволили бы процессу происходить быстрее и с меньшим количеством расходных материалов. Для этого требуется зондовое антитело, которое и распознает интересующий белок, и содержит обнаруживаемую метку, зонды, которые часто доступны для известных белковых меток . Первичный зонд инкубируется с мембраной способом, аналогичным тому, который используется для первичного антитела в двухэтапном процессе, а затем готов к прямому обнаружению после серии этапов промывки.

После того, как несвязанные зонды смываются, вестерн-блот готов к обнаружению зондов, которые помечены и связаны с интересующим белком. С практической точки зрения, не все вестерны выявляют белок только в одной полосе в мембране. Приблизительные размеры берутся путем сравнения окрашенных полос с полосами маркера или лестницы, загруженными во время электрофореза. Процесс обычно повторяется для структурного белка, такого как актин или тубулин , который не должен меняться между образцами. Количество целевого белка нормализуется по структурному белку для контроля между группами. Превосходная стратегия — нормализация по общему белку, визуализированному с помощью трихлорэтанола [38] [39] или эпикоконона . [40] Такая практика обеспечивает коррекцию количества общего белка на мембране в случае ошибок или неполных переносов. (см. нормализацию вестерн-блота )
Метод колориметрического обнаружения основан на инкубации вестерн-блота с субстратом, который реагирует с ферментом-репортером (например, пероксидазой ), связанным со вторичным антителом. Это преобразует растворимый краситель в нерастворимую форму другого цвета, которая осаждается рядом с ферментом и тем самым окрашивает мембрану. Затем развитие блота останавливают, смывая растворимый краситель. Уровни белка оценивают с помощью денситометрии (насколько интенсивно пятно) или спектрофотометрии .
Методы хемилюминесцентного обнаружения основаны на инкубации вестерн-блота с субстратом, который будет люминесцировать при воздействии репортера на вторичном антителе. Затем свет обнаруживается камерами CCD , которые захватывают цифровое изображение вестерн-блота или фотопленки. Использование пленки для обнаружения вестерн-блота постепенно исчезает из-за нелинейности изображения (неточное количественное определение). Изображение анализируется с помощью денситометрии, которая оценивает относительное количество окрашивания белка и количественно определяет результаты с точки зрения оптической плотности. Более новое программное обеспечение позволяет проводить дальнейший анализ данных, такой как анализ молекулярной массы, если используются соответствующие стандарты.
Радиоактивные метки не требуют ферментных субстратов, а вместо этого позволяют размещать медицинскую рентгеновскую пленку непосредственно против вестерн-блота, который проявляется при воздействии метки и создает темные области, которые соответствуют интересующим белковым полосам (см. изображение выше). Важность методов радиоактивного обнаружения снижается из-за его опасного излучения [ необходима цитата ] , поскольку это очень дорого, риски для здоровья и безопасности высоки, а ECL (усиленная хемилюминесценция) обеспечивает полезную альтернативу.

Флуоресцентно меченый зонд возбуждается светом, а затем излучение возбуждения обнаруживается фотосенсором, таким как ПЗС-камера, оснащенная соответствующими эмиссионными фильтрами, которая захватывает цифровое изображение вестерн-блота и позволяет проводить дальнейший анализ данных, такой как анализ молекулярной массы и количественный вестерн-блот-анализ. Флуоресценция считается одним из лучших методов количественной оценки, но она менее чувствительна, чем хемилюминесценция. [41]
Одно из основных различий между мембранами из нитроцеллюлозы и ПВДФ связано со способностью каждой из них поддерживать «удаление» антител и повторное использование мембраны для последующих зондов антител. Хотя существуют хорошо зарекомендовавшие себя протоколы для удаления нитроцеллюлозных мембран, более прочный ПВДФ позволяет легче удалять и чаще использовать повторно до того, как фоновый шум ограничит эксперименты. Другое отличие заключается в том, что, в отличие от нитроцеллюлозы, ПВДФ необходимо замачивать в 95% этаноле, изопропаноле или метаноле перед использованием. Мембраны из ПВДФ также, как правило, толще и более устойчивы к повреждениям во время использования. [42]
Чтобы гарантировать воспроизводимость результатов вестерн-блоттинга, важно сообщать о различных параметрах, упомянутых выше, включая подготовку образца, концентрацию белка, используемого для загрузки, процент геля и условия работы, различные методы переноса, попытки блокировать условия, концентрацию антител, а также методы идентификации и количественного определения. Многие из опубликованных статей не охватывают все эти переменные. Следовательно, крайне важно описывать различные экспериментальные обстоятельства или параметры, чтобы повысить повторяемость и точность WB. Таким образом, для повышения повторяемости WB требуются минимальные критерии отчетности. [2] [43]
Двумерный SDS-PAGE использует принципы и методы, описанные выше. 2-D SDS-PAGE, как следует из названия, включает миграцию полипептидов в 2 измерениях. Например, в первом измерении полипептиды разделяются в соответствии с изоэлектрической точкой , в то время как во втором измерении полипептиды разделяются в соответствии с их молекулярной массой . Изоэлектрическая точка данного белка определяется относительным числом положительно (например, лизин, аргинин) и отрицательно (например, глутамат, аспартат) заряженных аминокислот, причем отрицательно заряженные аминокислоты способствуют низкой изоэлектрической точке, а положительно заряженные аминокислоты способствуют высокой изоэлектрической точке. Образцы также можно сначала разделить в невосстанавливающих условиях с помощью SDS-PAGE, а затем в восстанавливающих условиях во втором измерении, при которых разрываются дисульфидные связи, удерживающие субъединицы вместе. SDS-PAGE также можно сочетать с мочевинным PAGE для получения 2-мерного геля.
В принципе, этот метод позволяет разделить все клеточные белки на одном большом геле. Главным преимуществом этого метода является то, что он часто различает различные изоформы конкретного белка – например, белок, который был фосфорилирован (путем добавления отрицательно заряженной группы). Белки, которые были разделены, можно вырезать из геля, а затем проанализировать с помощью масс-спектрометрии , которая определяет их молекулярную массу.
Сигнал в полосе может быть слабым или отсутствовать по ряду причин, связанных с количеством используемых антител и антигенов. Эту проблему можно решить, используя идеальные концентрации антигенов и антител и разбавления, указанные в паспорте поставщика. Увеличение периода экспозиции в программном обеспечении системы обнаружения может устранить слабые полосы, вызванные более низкими концентрациями образцов и антител. [2]
Когда белок расщепляется протеазами, могут появиться несколько полос, отличных от прогнозируемых полос с низкой молекулярной массой. Развитие многочисленных полос можно предотвратить, правильно подготовив образцы белка с достаточным количеством ингибиторов протеазы. Несколько полос могут появиться в области высокой молекулярной массы, поскольку некоторые белки образуют димеры, тримеры и мультимеры; эта проблема может быть решена путем нагревания образца в течение более длительного периода времени. Белки с посттрансляционными модификациями (ПТМ) или многочисленными изоформами вызывают появление нескольких полос в областях с различной молекулярной массой. ПТМ можно удалить из образца с помощью специальных химикатов, которые также удаляют дополнительные полосы. [2]
Сильные концентрации антител, неадекватная блокировка, неадекватная промывка и чрезмерное время экспозиции во время визуализации могут привести к высокому фону в пятнах. Высокого фона в пятнах можно избежать, исправив эти проблемы. [2]
Было заявлено, что возникло множество странных и неравных полос, включая черные точки, белые пятна или полосы и изогнутые полосы. Блок-точки удаляются из пятен путем эффективного блокирования. Белые пятна развиваются в результате образования пузырьков между мембраной и гелем. Белые полосы появляются в пятнах, когда основные и вторичные антитела присутствуют в значительных концентрациях. Из-за высокого напряжения, используемого во время гелевого прогона, и быстрой миграции белка в пятнах появляются полосы-улыбки. Странные полосы в пятне разрешаются путем решения этих проблем. [2]
Во время вестерн-блоттинга может возникнуть несколько проблем, связанных с различными этапами этой процедуры. Эти проблемы могут возникнуть на этапе анализа белка, например, при обнаружении низко- или посттрансляционно модифицированных белков. Кроме того, они могут быть основаны на выборе антител, поскольку качество антител играет важную роль в обнаружении белков в частности. [3] В связи с наличием таких проблем в настоящее время вводятся различные усовершенствования в области подготовки клеточного лизата и процедур блоттинга для получения надежных результатов. Более того, для достижения более чувствительного анализа и преодоления проблем, связанных с вестерн-блоттингом, было разработано и использовано несколько различных методов, таких как дальний вестерн-блоттинг , диффузионный блоттинг, вестерн-блоттинг с разрешением по одной клетке и автоматизированный микрофлюидный вестерн-блоттинг. [3]
Исследователи используют различное программное обеспечение для обработки и выравнивания изображений-сечений для элегантного представления результатов вестерн-блоттинга. Популярные инструменты включают Sciugo, Microsoft PowerPoint , Adobe Illustrator и GIMP .
С 1980 года вестерн-блоттинг стал наиболее используемым методом в молекулярной биологии для определения наличия и количества определенного белка. За эти годы было разработано множество «продвинутых» и «оптимизированных» систематических методов. Эти разработки обеспечивают продвинутые и более чувствительные результаты с помощью более продвинутых технологий визуализации и современных методов флуоресцентной маркировки. [2]
Метод с самой высокой скоростью принятия для определения ДНК-связывающих белков и взаимодействий белок-ДНК - это тест сдвига электрофоретической подвижности. Комплексы белок-ДНК анализируются с помощью сдвига-WB. Он создается путем переноса комплексов белок-ДНК, в которых ДНК в заряженной мембране располагается под нитроцеллюлозной мембраной, в то время как белки удерживаются в мембране. Затем для идентификации белков используются специфические антитела, а для идентификации ДНК используется радиоактивная метка. Кроме того, переданные белки и ДНК могут быть извлечены и исследованы более подробно. [2] [44]
Одноклеточный WB (scWB), в дополнение к обычному WB, считается прорывом в изучении субклеточной локализации белка и в оценке одноклеточного белка. Он используется при измерении уровней и условий экспрессии белка от одной клетки к другой. С помощью одноклеточного WB селективность и специфичность вестерн-блота были расширены, включив анализ одноклеточного белка. Ограничения точности и чувствительности антител преодолеваются этой техникой. Кроме того, благодаря своей универсальности, он может использоваться для одновременного измерения многочисленных целевых белков из разных клеточных линий и отдельных клеток. [2] [45]
Разработка, известная как количественно определяемый флуоресцентный WB (QFWB), позволяет исследователям проводить сравнительный анализ экспрессии с большей чувствительностью и точностью, чем когда-либо прежде. Количественный в QFWB означает действительно количественный с повышенной чувствительностью. Этот метод используется для выявления мельчайших вариаций экспрессии между различными образцами. С помощью вторичного антитела, которое было флуоресцентно помечено, QFWB создает линейный профиль обнаружения. Современные методы QFWB позволяют проводить одновременную двойную маркировку и более чувствительны для выявления мельчайших вариаций. [2] [46]
Количественный компьютеризированный вестерн-блот анализирует реактивность отдельных антител к определенным антигенам для идентификации иммунодоминантных и иммунорецессивных детерминант с использованием двух мер, таких как интенсивность чистой полосы и общая интенсивность полосы WB. Создание быстрых серодиагностических тестов и эффективных вакцин стало возможным благодаря идентификации определенных иммунодоминантных антигенов. Исследование ищет серологические маркеры для ранней диагностики рака, вирусных и аутоиммунных заболеваний с использованием количественного компьютеризированного вестерн-блота. [2] [47]
Это метод, который сочетает в себе традиционное разрешение белков SDS-PAGE с платформой микрочипов на основе бус, которая иммобилизует белки на микросферах. Такое сочетание разделения белков, однородности и чувствительности позволяет быстро количественно определять ряд различных белковых мишеней, а также их изменения. Преимущество DigiWest заключается в том, что вестерн-блот проводится с использованием микрочипов на основе бус, что позволяет одновременно обнаруживать и анализировать сотни различных белков и их изменения с использованием широкого спектра различных антител. [2] [48]
Для обнаружения множества белков на одном микрофлюидном чипе выполняется микрофлюидный вестерн-блот с использованием ряда процессов, включая обогащение образца, размер белка, осаждение белка и затем зондирование антител in situ. Фотореактивный (УФ-свет) полиакриламидный гель и фотошаблонируемая (синий свет) поверхность являются основой этой многоэтапной процедуры. Благодаря улучшению аналитических характеристик WB теперь может быть завершен за 10–60 минут, сохраняя при этом высокие пределы обнаружения чувствительности (50 пикомоль) и уровни обнаружения мультиплексных компонентов (фемтограммы). Таким образом, объединяя превосходную специфичность и преимущества высокой пропускной способности мультиплексирования, WB создает краеугольный камень для быстрой протеомики. [2] [49]
Усовершенствованная техника WB, называемая многополосной WB, основана на одновременном переносе различных белков из нескольких полосок полиакриламидного геля на одну поливинилидендифторидную или нитроцеллюлозную мембрану. Многополосная WB позволяет одновременно контролировать до девяти отдельных белков из одной и той же загрузки образца и до десятикратного увеличения выходных данных для одного цикла WB. Системная биология, исследование клеточной сигнализации и биомедицинская диагностика — все выиграли бы от использования этой техники. [2] [50]
Капиллярный и микрочиповый электрофорез вестерн-блоттинга был создан для уменьшения количества образцов белка и времени, необходимого для проведения вестерн-блоттинга. Он способствует более чувствительному и точному измерению различных белковых мишеней из любого лизата одной клетки, проведенного на микрочипе. 400 нанограмм клеточного лизата — это все, что нужно для идентификации и количественного определения одиннадцати различных белков. [2] [51]
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка ){{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка ){{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка )