Искусственная клетка , синтетическая клетка или минимальная клетка — это сконструированная частица, которая имитирует одну или несколько функций биологической клетки . Часто искусственные клетки представляют собой биологические или полимерные мембраны, которые заключают в себе биологически активные материалы. [1] Таким образом, липосомы , полимерсомы , наночастицы , микрокапсулы и ряд других частиц могут считаться искусственными клетками.
Термины «искусственная клетка» и «синтетическая клетка» используются в различных областях и могут иметь разные значения, как это также отражено в различных разделах этой статьи. Некоторые более строгие определения основаны на предположении, что термин «клетка» напрямую относится к биологическим клеткам и что эти структуры, следовательно, должны быть живыми (или частью живого организма) и, кроме того, что термин «искусственный» подразумевает, что эти структуры искусственно построены снизу вверх, т. е. из базовых компонентов. Таким образом, в области синтетической биологии искусственная клетка может пониматься как полностью синтетически созданная клетка, которая может захватывать энергию , поддерживать ионные градиенты , содержать макромолекулы , а также хранить информацию и иметь способность к репликации . [2] Такой вид искусственной клетки еще не был создан.
Однако в других случаях термин «искусственный» не подразумевает, что вся структура создана человеком, а вместо этого может относиться к идее о том, что определенные функции или структуры биологических клеток могут быть изменены, упрощены, заменены или дополнены синтетическим объектом.
В других областях термин «искусственная клетка» может относиться к любому отсеку, который несколько напоминает биологическую клетку по размеру или структуре, но создан синтетически или даже полностью сделан из небиологических компонентов. Термин «искусственная клетка» также используется для структур с прямым применением, таких как отсеки для доставки лекарств. Микроинкапсуляция позволяет осуществлять метаболизм внутри мембраны, обмениваться малыми молекулами и предотвращать прохождение через нее крупных веществ. [3] [4] Основные преимущества инкапсуляции включают улучшенную мимикрию в организме, повышенную растворимость груза и снижение иммунных реакций . В частности, искусственные клетки были клинически успешны в гемоперфузии . [5]
Немецкий патолог Рудольф Вирхов выдвинул идею о том, что не только жизнь возникает из клеток, но и каждая клетка происходит из другой клетки; « Omnis cellula e cellula ». [6] До сих пор большинство попыток создать искусственную клетку создавали только пакет, который может имитировать определенные задачи клетки. Достижения в области бесклеточных реакций транскрипции и трансляции позволяют экспрессировать многие гены , но эти усилия далеки от создания полностью работоспособной клетки.
Подход снизу вверх к созданию искусственной клетки будет включать создание протоклетки de novo , полностью из неживых материалов. Как подразумевает термин «клетка», одним из предварительных условий является создание некоторого вида отсека, который определяет индивидуальную клеточную единицу. Фосфолипидные мембраны являются очевидным выбором в качестве разделяющих границ, [7] поскольку они действуют как селективные барьеры во всех живых биологических клетках. Ученые могут инкапсулировать биомолекулы в фосфолипидные везикулы размером с клетку и, делая это, наблюдать, как эти молекулы действуют так же, как в биологических клетках, и тем самым воссоздавать определенные функции клетки. [8] Аналогичным образом функциональные биологические строительные блоки могут быть инкапсулированы в эти липидные отсеки для достижения синтеза (хотя и рудиментарных) искусственных клеток.
Предлагается создать фосфолипидную двухслойную везикулу с ДНК, способную к самовоспроизведению с использованием синтетической генетической информации. Три основных элемента таких искусственных клеток — это формирование липидной мембраны , репликация ДНК и РНК через шаблонный процесс и сбор химической энергии для активного транспорта через мембрану. [9] [10] Главные препятствия, предвиденные и с которыми пришлось столкнуться при использовании этой предлагаемой протоклетки, — это создание минимальной синтетической ДНК, которая содержит всю достаточную информацию для жизни, и воспроизведение негенетических компонентов, которые являются неотъемлемой частью развития клетки, такой как молекулярная самоорганизация. [11] Однако есть надежда, что такой подход снизу вверх позволит пролить свет на фундаментальные вопросы организации на клеточном уровне и происхождения биологической жизни. До сих пор не было синтезировано ни одной полностью искусственной клетки, способной к самовоспроизведению, с использованием молекул жизни, и эта цель все еще находится в отдаленном будущем, хотя различные группы в настоящее время работают над достижением этой цели. [12]
Другой метод, предложенный для создания протоклетки, более точно напоминает условия, которые , как полагают, присутствовали во время эволюции, известные как первичный бульон. Различные полимеры РНК могут быть инкапсулированы в везикулы, и в таких малых граничных условиях химические реакции будут проверяться. [13]
Исследование протоклеток вызвало споры и противоположные мнения, включая критику расплывчатого определения «искусственной жизни». [14] Создание базовой единицы жизни является наиболее насущной этической проблемой. [15] Наиболее распространенное беспокойство по поводу протоклеток заключается в их потенциальной угрозе для здоровья человека и окружающей среды из-за неконтролируемой репликации. Однако искусственные клетки, созданные с помощью подхода «сверху вниз», или любые другие измененные формы существующих живых клеток, с гораздо большей вероятностью смогут существовать и воспроизводиться за пределами лаборатории и, следовательно, представлять такую угрозу.
В середине 2010-х годов научное сообщество начало осознавать необходимость объединения области исследований синтетических клеток, признав, что задача создания целого живого организма из неживых компонентов выходит за рамки возможностей одной страны. [16]
В 2017 году началось финансируемое NSF международное крупномасштабное исследовательское сотрудничество Build-a-Cell по созданию синтетической живой клетки. [17] Build-a-Cell провел девять междисциплинарных семинаров, открытых для всех заинтересованных лиц, для обсуждения и руководства будущим сообщества синтетических клеток. За Build-a-Cell последовали национальные организации синтетических клеток в нескольких других странах. К этим национальным организациям относятся FabriCell, [18] MaxSynBio [19] и BaSyC. [20] Европейские усилия по синтетическим клеткам были объединены в 2019 году в инициативу SynCellEU. [21]
Члены Института Дж. Крейга Вентера использовали нисходящий вычислительный подход для выбивания генов в живом организме до минимального набора генов. [22] В 2010 году команде удалось создать реплицирующийся штамм (названный Mycoplasma laboratorium ) Mycoplasma mycoides с использованием синтетически созданной ДНК, которая считается минимальным требованием для жизни, и была вставлена в геномно пустую бактерию. [22] Есть надежда, что процесс нисходящего биосинтеза позволит вставлять новые гены, которые будут выполнять полезные функции, такие как генерация водорода для топлива или улавливание избыточного углекислого газа в атмосфере. [15] Множество регуляторных, метаболических и сигнальных сетей не полностью охарактеризованы. Эти нисходящие подходы имеют ограничения для понимания фундаментальной молекулярной регуляции, поскольку организмы-хозяева имеют сложный и не полностью определенный молекулярный состав. [23] В 2019 году была опубликована полная вычислительная модель всех путей в клетке Mycoplasma Syn3.0, представляющая собой первую полную модель in silico для живого минимального организма. [24]
Крупные компании, такие как ExxonMobil , вложили значительные средства в биологию , сотрудничая с Synthetic Genomics Inc. , собственной биосинтетической компанией Крейга Вентера, занимающейся разработкой топлива из водорослей. [25]
По состоянию на 2016 год Mycoplasma genitalium является единственным организмом, используемым в качестве отправной точки для создания минимальной клетки, поскольку у него самый маленький известный геном, который можно культивировать в лабораторных условиях; у дикого типа их 482, и удаление ровно 100 генов, считающихся несущественными, привело к получению жизнеспособного штамма с улучшенными темпами роста. Escherichia coli с уменьшенным геномом считается более полезной, и жизнеспособные штаммы были разработаны с удаленными 15% генома. [26] : 29–30
Была создана разновидность искусственной клетки, в которой полностью синтетический геном был введен в геномно опустошенные клетки-хозяева. [22] Хотя она и не является полностью искусственной, поскольку цитоплазматические компоненты , а также мембрана клетки-хозяина сохраняются, сконструированная клетка находится под контролем синтетического генома и способна к репликации .
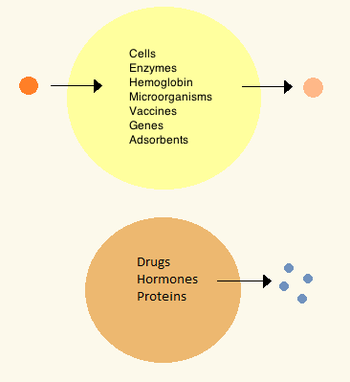
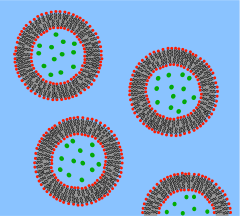
В 1960-х годах Томас Чанг разработал микрокапсулы, которые он позже назовет «искусственными клетками», поскольку они представляли собой ячейки размером с клетку, сделанные из искусственных материалов. [27] Эти клетки состояли из ультратонких мембран из нейлона, коллодия или сшитого белка, чьи полупроницаемые свойства позволяли диффузию малых молекул в клетку и из нее. Эти клетки были микронного размера и содержали клетки , ферменты , гемоглобин , магнитные материалы, адсорбенты и белки . [3]
Более поздние искусственные клетки имели размеры от сотен микрометров до нанометров и могли переносить микроорганизмы, вакцины , гены , лекарства, гормоны и пептиды . [3] Первое клиническое применение искусственных клеток было в гемоперфузии путем инкапсуляции активированного угля . [28]
В 1970-х годах исследователи смогли ввести ферменты, белки и гормоны в биоразлагаемые микрокапсулы, что позже привело к клиническому использованию при таких заболеваниях, как синдром Леша-Нихана . [29] Хотя первоначальное исследование Чанга было сосредоточено на искусственных эритроцитах , только в середине 1990-х годов были разработаны биоразлагаемые искусственные эритроциты. [30] Искусственные клетки в биологической инкапсуляции клеток впервые были использованы в клинике в 1994 году для лечения пациента с диабетом [31] , и с тех пор другие типы клеток, такие как гепатоциты , взрослые стволовые клетки и генетически модифицированные клетки, были инкапсулированы и изучаются для использования в регенерации тканей. [32] [33]
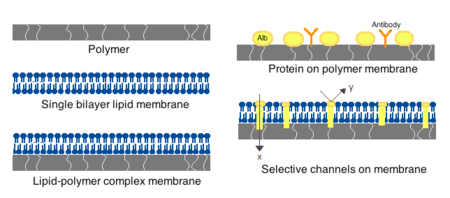
Мембраны для искусственных клеток могут быть изготовлены из простых полимеров , сшитых белков, липидных мембран или полимер-липидных комплексов. Кроме того, мембраны могут быть спроектированы для представления поверхностных белков, таких как альбумин , антигены , носители Na/K-АТФазы или поры, такие как ионные каналы . Обычно используемые материалы для производства мембран включают гидрогелевые полимеры, такие как альгинат , целлюлозу и термопластичные полимеры, такие как гидроксиэтилметакрилат-метилметакрилат (HEMA-MMA), полиакрилонитрил-поливинилхлорид (PAN-PVC), а также вариации вышеупомянутых. [4] Используемый материал определяет проницаемость клеточной мембраны, которая для полимера зависит от важности определения адекватной диффузии питательных веществ, отходов и других критических молекул. Гидрофильные полимеры имеют потенциал быть биосовместимыми и могут быть изготовлены в различных формах, которые включают полимерные мицеллы , золь-гелевые смеси, физические смеси и сшитые частицы и наночастицы. [4] Особый интерес представляют полимеры, реагирующие на стимулы, которые реагируют на изменения pH или температуры для использования в целевой доставке. Эти полимеры могут вводиться в жидкой форме посредством макроскопической инъекции и затвердевать или превращаться в гель in situ из-за разницы в pH или температуре. Препараты наночастиц и липосом также обычно используются для инкапсуляции и доставки материалов. Главным преимуществом липосом является их способность сливаться с мембранами клеток и органелл .
Разработано много вариантов искусственной подготовки и инкапсуляции клеток. Обычно синтезируются везикулы, такие как наночастицы , полимерсомы или липосомы . Эмульсия обычно изготавливается с использованием оборудования высокого давления, такого как гомогенизатор высокого давления или микрофлюидизатор. Ниже также описаны два метода микроинкапсуляции для нитроцеллюлозы.
В гомогенизаторе высокого давления две жидкости в суспензии масло/жидкость продавливаются через маленькое отверстие под очень высоким давлением. Этот процесс разделяет продукты и позволяет создавать чрезвычайно мелкие частицы размером до 1 нм.
Эта техника использует запатентованный микрофлюидизатор для получения большего количества гомогенных суспензий, которые могут создавать более мелкие частицы, чем гомогенизаторы. Сначала гомогенизатор используется для создания грубой суспензии, которая затем закачивается в микрофлюидизатор под высоким давлением. Затем поток разделяется на два потока, которые будут реагировать на очень высоких скоростях в камере взаимодействия до тех пор, пока не будет получен желаемый размер частиц. [34] Эта техника позволяет производить крупномасштабные фосфолипидные липосомы и последующие наноинкапсуляции материалов.
В этом методе раствор клеток вводится по каплям в коллодиевый раствор нитрата целлюлозы. По мере того, как капля проходит через коллодий, она покрывается мембраной благодаря свойствам межфазной полимеризации коллодия. Затем клетка оседает в парафине, где застывает мембрана, которая затем суспендируется с использованием физиологического раствора. Метод капель используется для создания больших искусственных клеток, которые инкапсулируют биологические клетки, стволовые клетки и генно-инженерные стволовые клетки.
Метод эмульсии отличается тем, что материал, который нужно инкапсулировать, обычно меньше и помещается на дно реакционной камеры, куда сверху добавляется коллодий и центрифугируется или иным образом перемешивается для создания эмульсии. Затем инкапсулированный материал диспергируется и суспендируется в солевом растворе.
Искусственные клетки, используемые для доставки лекарств, отличаются от других искусственных клеток, поскольку их содержимое предназначено для диффузии из мембраны или поглощения и переваривания целевой клеткой-хозяином. Часто используются субмикронные искусственные клетки с липидной мембраной, которые могут называться нанокапсулами, наночастицами, полимерсомами или другими вариациями этого термина. [35]
Была разработана система, чувствительная к температуре, которая использует РНК-термометры для контроля времени и места высвобождения груза из искусственных клеток. [36] Это достигается за счет того, что искусственные клетки экспрессируют порообразующий белок - альфа-гемолизин - под контролем РНК-термометра, что позволяет связать высвобождение груза с изменениями температуры. [36]
Ферментная терапия активно изучается для генетических метаболических заболеваний , когда фермент сверхэкспрессирован, недостаточно экспрессирован, дефектен или вообще отсутствует. В случае недостаточной экспрессии или экспрессии дефектного фермента в организм вводится активная форма фермента для компенсации дефицита. С другой стороны, ферментативная сверхэкспрессия может быть нейтрализована введением конкурирующего нефункционального фермента; то есть фермента, который метаболизирует субстрат в неактивные продукты. При помещении в искусственную клетку ферменты могут выполнять свою функцию в течение гораздо более длительного периода по сравнению со свободными ферментами [3] и могут быть дополнительно оптимизированы путем полимерной конъюгации. [37]
Первым ферментом, изученным при искусственной инкапсуляции клеток, была аспарагиназа для лечения лимфосаркомы у мышей. Это лечение задержало начало и рост опухоли . [ 38] Эти первоначальные результаты привели к дальнейшим исследованиям в области использования искусственных клеток для доставки ферментов в тирозинзависимые меланомы . [39] Эти опухоли имеют более высокую зависимость от тирозина , чем нормальные клетки для роста, и исследования показали, что снижение системных уровней тирозина у мышей может подавлять рост меланом. [40] Использование искусственных клеток для доставки тирозиназы ; и фермента, который переваривает тирозин, обеспечивает лучшую стабильность фермента и показано, что эффективно удаляет тирозин без серьезных побочных эффектов, связанных с лишением тирозина в рационе. [41]
Искусственная клеточная ферментная терапия также представляет интерес для активации пролекарств, таких как ифосфамид , при некоторых видах рака. Искусственные клетки, инкапсулирующие фермент цитохрома p450 , который преобразует это пролекарство в активное лекарство, могут быть адаптированы для накопления в карциноме поджелудочной железы или имплантации искусственных клеток близко к месту опухоли. Здесь локальная концентрация активированного ифосфамида будет намного выше, чем в остальной части тела, что предотвращает системную токсичность . [42] Лечение было успешным на животных [43] и показало удвоение медианной выживаемости среди пациентов с раком поджелудочной железы на поздней стадии в клинических испытаниях фазы I/II и утроение однолетней выживаемости. [42]
При лечении генетических заболеваний генная терапия направлена на вставку, изменение или удаление генов в клетках пораженного человека. Технология в значительной степени опирается на вирусные векторы , что вызывает опасения по поводу инсерционного мутагенеза и системного иммунного ответа , которые привели к смерти людей [44] [45] и развитию лейкемии [46] [47] в клинических испытаниях. Обход необходимости векторов путем использования голой или плазмидной ДНК в качестве собственной системы доставки также сталкивается с такими проблемами, как низкая эффективность трансдукции и плохое нацеливание на ткани при системном применении. [4]
Искусственные клетки были предложены в качестве невирусного вектора, с помощью которого генетически модифицированные неаутологичные клетки инкапсулируются и имплантируются для доставки рекомбинантных белков in vivo . [48] Этот тип иммуноизоляции доказал свою эффективность на мышах посредством доставки искусственных клеток, содержащих гормон роста мыши , который устранял задержку роста у мутантных мышей. [49] Несколько стратегий продвинулись до клинических испытаний на людях для лечения рака поджелудочной железы , бокового склероза и контроля боли. [4]
Первое клиническое применение искусственных клеток было в гемоперфузии путем инкапсуляции активированного угля . [28] Активированный уголь обладает способностью адсорбировать много крупных молекул и давно известен своей способностью удалять токсичные вещества из крови при случайном отравлении или передозировке. Однако перфузия посредством прямого введения угля токсична, поскольку приводит к эмболии и повреждению клеток крови с последующим удалением тромбоцитами. [50] Искусственные клетки позволяют токсинам диффундировать в клетку, удерживая опасный груз внутри своей сверхтонкой мембраны. [28]
Искусственная клеточная гемоперфузия была предложена как менее затратный и более эффективный вариант детоксикации, чем гемодиализ , [3] , при котором фильтрация крови происходит только за счет разделения по размеру физической мембраной. При гемоперфузии тысячи адсорбирующих искусственных клеток удерживаются внутри небольшого контейнера с помощью двух экранов на обоих концах, через которые протекает кровь пациента . По мере циркуляции крови токсины или лекарства диффундируют в клетки и удерживаются поглощающим материалом. Мембраны искусственных клеток намного тоньше тех, которые используются при диализе, и их небольшой размер означает, что они имеют большую площадь поверхности мембраны . Это означает, что часть клетки может иметь теоретический массоперенос, который в сто раз выше, чем у целого аппарата искусственной почки. [3] Устройство было установлено как рутинный клинический метод для пациентов, проходящих лечение от случайного или суицидального отравления, но также было введено в качестве терапии при печеночной недостаточности и почечной недостаточности , выполняя часть функции этих органов. [3] Искусственная клеточная гемоперфузия также была предложена для использования в иммуноадсорбции, посредством которой антитела могут быть удалены из организма путем прикрепления иммуноадсорбирующего материала, такого как альбумин, к поверхности искусственных клеток. Этот принцип использовался для удаления антител группы крови из плазмы для трансплантации костного мозга [51] и для лечения гиперхолестеринемии с помощью моноклональных антител для удаления липопротеинов низкой плотности . [52] Гемоперфузия особенно полезна в странах со слабой промышленностью по производству гемодиализа, поскольку устройства там, как правило, дешевле и используются у пациентов с почечной недостаточностью .

Наиболее распространенным методом получения искусственных клеток является инкапсуляция клеток . Инкапсулированные клетки обычно получаются путем получения капель контролируемого размера из жидкой клеточной суспензии , которые затем быстро затвердевают или гелеобразуются для обеспечения дополнительной стабильности. Стабилизация может быть достигнута путем изменения температуры или сшивания материалов. [4] Микросреда, в которой находится клетка, изменяется при инкапсуляции. Обычно она переходит от монослоя к суспензии в полимерном каркасе внутри полимерной мембраны. Недостатком метода является то, что инкапсуляция клетки снижает ее жизнеспособность и способность к пролиферации и дифференциации. [53] Кроме того, через некоторое время внутри микрокапсулы клетки образуют кластеры, которые ингибируют обмен кислородом и метаболическими отходами, [54] что приводит к апоптозу и некрозу , тем самым ограничивая эффективность клеток и активируя иммунную систему хозяина . Искусственные клетки оказались успешными для трансплантации ряда клеток, включая островки Лангерганса для лечения диабета [55] , клетки паращитовидных желез и клетки коры надпочечников.
Нехватка доноров органов делает искусственные клетки ключевыми игроками в альтернативных методах лечения печеночной недостаточности . Использование искусственных клеток для трансплантации гепатоцитов продемонстрировало осуществимость и эффективность в обеспечении функции печени в моделях заболеваний печени у животных и биоискусственных печеночных устройствах . [56] Исследования начались с экспериментов, в которых гепатоциты были прикреплены к поверхности микроносителей [57] и превратились в гепатоциты, которые были инкапсулированы в трехмерную матрицу в альгинатных микрокаплях, покрытых внешней оболочкой из полилизина . Ключевым преимуществом этого метода доставки является обход иммуносупрессивной терапии на протяжении всего лечения. Инкапсуляции гепатоцитов были предложены для использования в биоискусственной печени . Устройство состоит из цилиндрической камеры, в которую помещены изолированные гепатоциты, через которые плазма пациента циркулирует экстракорпорально в виде гемоперфузии . Поскольку микрокапсулы имеют высокое отношение площади поверхности к объему , они обеспечивают большую поверхность для диффузии субстрата и могут вмещать большое количество гепатоцитов. Лечение мышей с индуцированной печеночной недостаточностью показало значительное увеличение скорости выживаемости. [56] Искусственные системы печени все еще находятся на ранней стадии разработки, но показывают потенциал для пациентов, ожидающих трансплантации органов или пока собственная печень пациента достаточно регенерируется, чтобы возобновить нормальную функцию. До сих пор клинические испытания с использованием искусственных систем печени и трансплантации гепатоцитов при терминальной стадии заболеваний печени показали улучшение маркеров здоровья, но еще не улучшили выживаемость. [58] Короткая продолжительность жизни и агрегация искусственных гепатоцитов после трансплантации являются основными препятствиями. Гепатоциты, коинкапсулированные со стволовыми клетками , показывают большую жизнеспособность в культуре и после имплантации [59] , а имплантация только искусственных стволовых клеток также показала регенерацию печени. [60] В связи с этим возник интерес к использованию стволовых клеток для инкапсуляции в регенеративной медицине .
Пероральный прием живых колоний бактериальных клеток был предложен и в настоящее время используется в терапии для модуляции кишечной микрофлоры , [61] профилактики диарейных заболеваний , [62] лечения инфекций H. Pylori , атопических воспалений, [63] непереносимости лактозы [64] и иммуномодуляции , [65] среди прочего. Предложенный механизм действия не полностью изучен, но считается, что он имеет два основных эффекта. Первый - это питательный эффект, при котором бактерии конкурируют с бактериями, продуцирующими токсины. Второй - это санитарный эффект, который стимулирует устойчивость к колонизации и стимулирует иммунный ответ . [4] Пероральная доставка бактериальных культур часто является проблемой, поскольку они являются мишенью для иммунной системы и часто разрушаются при приеме внутрь. Искусственные клетки помогают решать эти проблемы, обеспечивая мимикрию в организме и избирательное или долгосрочное высвобождение, тем самым увеличивая жизнеспособность бактерий, достигающих желудочно-кишечного тракта . [4] Кроме того, инкапсуляция живых бактериальных клеток может быть разработана для обеспечения диффузии малых молекул, включая пептиды, в организм в терапевтических целях. [4] Мембраны, которые оказались успешными для доставки бактерий, включают ацетат целлюлозы и варианты альгината . [4] Дополнительные применения, которые возникли в результате инкапсуляции бактериальных клеток, включают защиту от заражения M. Tuberculosis [66] и повышение регуляции клеток, секретирующих Ig, иммунной системой. [67] Технология ограничена риском системных инфекций, неблагоприятными метаболическими процессами и риском переноса генов. [4] Однако более сложной задачей остается доставка достаточного количества жизнеспособных бактерий в интересующее место. [4]
Наноразмерные переносчики кислорода используются как своего рода заменители эритроцитов , хотя у них отсутствуют другие компоненты эритроцитов. Они состоят из синтетической полимерсомы или искусственной мембраны, окружающей очищенный животный, человеческий или рекомбинантный гемоглобин . [68] В целом, доставка гемоглобина продолжает оставаться проблемой, поскольку он очень токсичен при доставке без каких-либо модификаций. В некоторых клинических испытаниях наблюдались вазопрессорные эффекты. [69] [70]
Исследовательский интерес к использованию искусственных клеток для крови возник после паники по поводу СПИДа в 1980-х годах. Помимо обхода возможности передачи заболевания, искусственные эритроциты востребованы, поскольку они устраняют недостатки, связанные с аллогенными переливаниями крови, такие как определение группы крови, иммунные реакции и короткий срок хранения в 42 дня. Заменитель гемоглобина может храниться при комнатной температуре и не в холодильнике более года. [3] Были предприняты попытки разработать полностью работающий эритроцит, который включает в себя не только углеродный переносчик кислорода, но и ферменты, связанные с клеткой. Первая попытка была предпринята в 1957 году путем замены мембраны эритроцита сверхтонкой полимерной мембраной [71] , за которой последовала инкапсуляция через липидную мембрану [72] , а позднее и биоразлагаемую полимерную мембрану. [3] Биологическая мембрана эритроцита, включающая липиды и связанные с ними белки, также может использоваться для инкапсуляции наночастиц и увеличения времени пребывания in vivo путем обхода поглощения макрофагами и системного клиренса. [73]
Лейкополимерсома — это полимерсома , сконструированная так, чтобы иметь адгезивные свойства лейкоцита . [ 74] Полимерсомы — это везикулы, состоящие из двухслойного листа, который может инкапсулировать множество активных молекул, таких как лекарства или ферменты . Добавляя адгезивные свойства лейкоцитов к их мембранам, их можно заставить замедляться или катиться вдоль эпителиальных стенок в быстро текущей кровеносной системе .
Концепция электронной искусственной клетки была расширена в серии из трех проектов ЕС, координируемых Джоном Маккаскиллом с 2004 по 2015 год.
Европейская комиссия спонсировала разработку программы Programmable Artificial Cell Evolution (PACE) [75] с 2004 по 2008 год, целью которой было заложить основу для создания «микроскопических самоорганизующихся, самовоспроизводящихся и эволюционирующих автономных сущностей, построенных из простых органических и неорганических веществ, которые могут быть генетически запрограммированы для выполнения определенных функций» [75] для последующей интеграции в информационные системы. Проект PACE разработал первую Omega Machine, микрофлюидную систему жизнеобеспечения для искусственных клеток, которая могла бы дополнять химически отсутствующие функции (как первоначально предлагали Норман Паккард, Стин Расмуссен, Марк Бидо и Джон Маккаскилл). Конечной целью было достижение эволюционирующей гибридной клетки в сложной микромасштабной программируемой среде. Функции Omega Machine затем могли бы быть удалены поэтапно, создавая ряд решаемых эволюционных проблем для химии искусственных клеток. Проект достиг химической интеграции до уровня пар трех основных функций искусственных клеток (генетическая подсистема, система сдерживания и метаболическая система) и создал новые пространственно разрешенные программируемые микрофлюидные среды для интеграции сдерживания и генетической амплификации. [75] Проект привел к созданию Европейского центра живых технологий. [76]
После этого исследования в 2007 году Джон Маккаскилл предложил сосредоточиться на электронно-дополняемой искусственной клетке, названной Электронной химической клеткой. Основная идея заключалась в использовании массивно-параллельного массива электродов, соединенных с локально выделенной электронной схемой, в двумерной тонкой пленке, для дополнения появляющейся химической клеточной функциональности. Локальная электронная информация, определяющая переключение электродов и сенсорные схемы, могла бы служить электронным геномом, дополняя молекулярную последовательную информацию в появляющихся протоколах. Исследовательское предложение было успешно принято Европейской комиссией , и международная группа ученых, частично пересекающаяся с консорциумом PACE, начала работу в 2008–2012 годах над проектом Электронные химические клетки. Проект продемонстрировал, среди прочего, что электронно-управляемый локальный транспорт определенных последовательностей может использоваться в качестве искусственной пространственной системы управления для генетической пролиферации будущих искусственных клеток, и что основные процессы метаболизма могут быть доставлены с помощью соответствующим образом покрытых электродных массивов.
Основным ограничением этого подхода, помимо первоначальных трудностей в освоении микромасштабной электрохимии и электрокинетики, является то, что электронная система взаимосвязана как жесткая неавтономная часть макроскопического оборудования. В 2011 году Маккаскилл предложил инвертировать геометрию электроники и химии: вместо того, чтобы помещать химикаты в активную электронную среду, поместить микроскопическую автономную электронику в химическую среду. Он организовал проект по созданию третьего поколения электронных искусственных клеток в масштабе 100 мкм, которые могли бы самостоятельно собираться из двух полуклеток «лаблетов», чтобы заключить внутреннее химическое пространство, и функционировать с помощью активной электроники, питаемой средой, в которую они погружены. Такие клетки могут копировать как свое электронное, так и химическое содержимое и будут способны к эволюции в рамках ограничений, предоставляемых их специальными предварительно синтезированными микроскопическими строительными блоками. В сентябре 2012 года началась работа над этим проектом. [77]
Ведутся исследования и разработки физических искусственных нейронов — органических и неорганических.
Например, некоторые искусственные нейроны могут получать [78] [79] и высвобождать дофамин ( химические сигналы, а не электрические сигналы) и взаимодействовать с естественными мышечными и мозговыми клетками крысы , что может быть использовано в нейрокомпьютерных интерфейсах / протезировании . [80] [81]
Маломощные биосовместимые мемристоры могут позволить создавать искусственные нейроны, которые функционируют при напряжениях биологических потенциалов действия и могут использоваться для прямой обработки биосенсорных сигналов , для нейроморфных вычислений и/или прямой связи с биологическими нейронами . [82] [83] [84]
Органические нейроморфные схемы, сделанные из полимеров , покрытых гелем, богатым ионами, чтобы материал мог переносить электрический заряд, как настоящие нейроны , были встроены в робота, позволяя ему обучаться сенсомоторно в реальном мире, а не посредством моделирования или виртуально. [85] [86] Более того, искусственные спайковые нейроны, сделанные из мягкой материи (полимеров), могут работать в биологически релевантных средах и обеспечивать синергетическую связь между искусственными и биологическими доменами. [87] [88]Протоклетки дживану — это синтетические химические частицы, обладающие клеточной структурой и, по-видимому, обладающие некоторыми функциональными свойствами жизни. [89] Впервые синтезированные в 1963 году из простых минералов и основных органических веществ под воздействием солнечного света , они, как сообщается, обладают некоторыми метаболическими возможностями, наличием полупроницаемой мембраны , аминокислот , фосфолипидов , углеводов и РНК-подобных молекул. [89] Однако природа и свойства дживану еще предстоит выяснить. [89] [90]