
В биохимии киназа ( / ˈ k aɪ n eɪ s , ˈ k ɪ n eɪ s , - eɪ z / ) [2] является ферментом , который катализирует перенос фосфатных групп от высокоэнергетических молекул-доноров фосфата к определенным субстратам . Этот процесс известен как фосфорилирование , где высокоэнергетическая молекула АТФ отдает фосфатную группу молекуле субстрата . В результате киназа производит фосфорилированный субстрат и АДФ . Наоборот, это называется дефосфорилированием , когда фосфорилированный субстрат отдает фосфатную группу, а АДФ получает фосфатную группу (производя дефосфорилированный субстрат и высокоэнергетическую молекулу АТФ). Эти два процесса, фосфорилирование и дефосфорилирование, происходят четыре раза во время гликолиза . [3] [4] [5]
Киназы являются частью более крупного семейства фосфотрансфераз . Киназы не следует путать с фосфорилазами , которые катализируют добавление неорганических фосфатных групп к акцептору, или с фосфатазами , которые удаляют фосфатные группы (дефосфорилирование). Состояние фосфорилирования молекулы, будь то белок , липид или углевод , может влиять на ее активность, реакционную способность и способность связывать другие молекулы. Таким образом, киназы играют решающую роль в метаболизме , клеточной сигнализации , регуляции белков , клеточном транспорте , секреторных процессах и многих других клеточных путях, что делает их очень важными для физиологии.
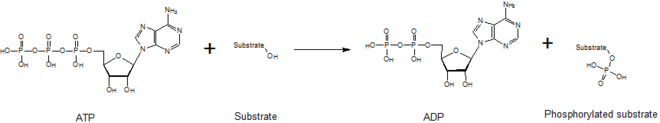
Киназы опосредуют перенос фосфатного фрагмента из высокоэнергетической молекулы (такой как АТФ ) в свою молекулу субстрата, как показано на рисунке ниже. Киназы необходимы для стабилизации этой реакции, поскольку фосфоангидридная связь содержит высокий уровень энергии. Киназы правильно ориентируют свой субстрат и фосфорильную группу в своих активных центрах, что увеличивает скорость реакции. Кроме того, они обычно используют положительно заряженные аминокислотные остатки, которые электростатически стабилизируют переходное состояние , взаимодействуя с отрицательно заряженными фосфатными группами. В качестве альтернативы некоторые киназы используют связанные металлические кофакторы в своих активных центрах для координации фосфатных групп. Протеинкиназы можно классифицировать как каталитически активные (канонические) или как псевдокиназы, что отражает эволюционную потерю одной или нескольких каталитических аминокислот, которые позиционируют или гидролизуют АТФ. [6] Однако с точки зрения выходных сигналов и значимости для заболевания как киназы, так и псевдокиназы являются важными модуляторами сигналов в клетках человека, что делает киназы важными мишенями для лекарственных препаратов. [7]
Киназы широко используются для передачи сигналов и регулирования сложных процессов в клетках. Фосфорилирование молекул может усиливать или подавлять их активность и модулировать их способность взаимодействовать с другими молекулами. Добавление и удаление фосфорильных групп предоставляет клетке средство контроля, поскольку различные киназы могут реагировать на различные условия или сигналы. Мутации в киназах, которые приводят к потере функции или приобретению функции, могут вызывать рак [8] и заболевания у людей, включая определенные типы лейкемии и нейробластомы , глиобластому [9], спиноцеребеллярную атаксию (тип 14), формы агаммаглобулинемии и многие другие. [10]
Первый белок, который был признан катализирующим фосфорилирование другого белка с использованием АТФ, был обнаружен в 1954 году Юджином П. Кеннеди, когда он описал фермент печени, катализирующий фосфорилирование казеина. [ необходима цитата ] В 1956 году Эдмонд Х. Фишер и Эдвин Г. Кребс обнаружили, что взаимопревращение между фосфорилазой a и фосфорилазой b опосредовано фосфорилированием и дефосфорилированием. [11] Киназа, которая переносила фосфорильную группу на фосфорилазу b, превращая ее в фосфорилазу a, была названа киназой фосфорилазы. Спустя годы был идентифицирован первый пример каскада киназ, в котором протеинкиназа A (PKA) фосфорилирует киназу фосфорилазы. В то же время было обнаружено, что PKA ингибирует гликогенсинтазу , что было первым примером события фосфорилирования, которое привело к ингибированию. В 1969 году Лестер Рид обнаружил, что пируватдегидрогеназа инактивируется фосфорилированием, и это открытие стало первым указанием на то, что фосфорилирование может служить средством регуляции в других метаболических путях, помимо метаболизма гликогена . В том же году Том Ланган обнаружил, что PKA фосфорилирует гистон H1, что предполагает, что фосфорилирование может регулировать неферментативные белки. В 1970-х годах были открыты кальмодулин-зависимые протеинкиназы и установлено, что белки могут фосфорилироваться по более чем одному аминокислотному остатку. 1990-е годы можно охарактеризовать как «десятилетие каскадов протеинкиназ». В это время были открыты путь MAPK/ERK , киназы JAK (семейство протеинтирозинкиназ) и каскад киназ, зависимых от PIP3. [12]
Киназы классифицируются на широкие группы по субстрату, на который они действуют: протеинкиназы, липидкиназы, углеводкиназы. Киназы можно обнаружить у различных видов, от бактерий до плесени, от червей до млекопитающих. [13] У людей было идентифицировано более пятисот различных киназ. [3] Их разнообразие и их роль в передаче сигналов делают их интересным объектом изучения. Различные другие киназы действуют на небольшие молекулы, такие как липиды , углеводы , аминокислоты и нуклеотиды , либо для передачи сигналов, либо для их подготовки к метаболическим путям. Конкретные киназы часто называют в честь их субстратов. Протеинкиназы часто имеют несколько субстратов, и белки могут служить субстратами для более чем одной конкретной киназы. По этой причине протеинкиназы называют на основе того, что регулирует их активность (т. е. кальмодулин-зависимые протеинкиназы). Иногда их далее подразделяют на категории, поскольку существует несколько изоферментных форм. Например, циклические АМФ-зависимые протеинкиназы типа I и типа II имеют идентичные каталитические субъединицы, но разные регуляторные субъединицы, которые связывают циклический АМФ. [14]
Протеинкиназы действуют на белки, фосфорилируя их по остаткам серина, треонина, тирозина или гистидина. Фосфорилирование может изменять функцию белка многими способами. Оно может увеличивать или уменьшать активность белка, стабилизировать его или помечать для разрушения, локализовать его в определенном клеточном отсеке и может инициировать или нарушать его взаимодействие с другими белками. Протеинкиназы составляют большинство всех киназ и широко изучаются. [15] Эти киназы, в сочетании с фосфатазами , играют важную роль в регуляции белков и ферментов , а также в передаче сигналов в клетке.
Распространенная точка путаницы возникает при размышлении о различных способах, которыми клетка достигает биологической регуляции. Существует бесчисленное множество примеров ковалентных модификаций, которым могут подвергаться клеточные белки; однако фосфорилирование является одной из немногих обратимых ковалентных модификаций. Это дало обоснование тому, что фосфорилирование белков является регуляторным. Потенциал регулирования функции белка огромен, учитывая, что существует множество способов ковалентной модификации белка в дополнение к регуляции, обеспечиваемой аллостерическим контролем. В своей мемориальной лекции Хопкинса Эдвин Кребс утверждал, что аллостерический контроль развился для реагирования на сигналы, возникающие изнутри клетки, тогда как фосфорилирование развилось для реагирования на сигналы извне клетки. Эта идея согласуется с тем фактом, что фосфорилирование белков происходит гораздо чаще в эукариотических клетках по сравнению с прокариотическими клетками , поскольку более сложный тип клеток развился для реагирования на более широкий спектр сигналов. [14]
Циклинзависимые киназы (CDK) представляют собой группу из нескольких различных киназ, участвующих в регуляции клеточного цикла . Они фосфорилируют другие белки по их остаткам серина или треонина, но CDK должны сначала связаться с белком циклина , чтобы быть активными. [16] Различные комбинации определенных CDK и циклинов отмечают различные части клеточного цикла. Кроме того, состояние фосфорилирования CDK также имеет решающее значение для их активности, поскольку они подлежат регуляции другими киназами (такими как CDK-активирующая киназа ) и фосфатазами (такими как Cdc25 ). [17] После того, как CDK активируются, они фосфорилируют другие белки, чтобы изменить их активность, что приводит к событиям, необходимым для следующей стадии клеточного цикла. Хотя они наиболее известны своей функцией в контроле клеточного цикла, CDK также играют роль в транскрипции, метаболизме и других клеточных событиях. [18]
Из-за их ключевой роли в контроле деления клеток мутации в CDK часто обнаруживаются в раковых клетках. Эти мутации приводят к неконтролируемому росту клеток, где они быстро проходят через весь клеточный цикл повторно. [19] Мутации CDK можно обнаружить в лимфомах , раке груди , опухолях поджелудочной железы и раке легких . Поэтому ингибиторы CDK были разработаны в качестве лечения некоторых типов рака. [19]
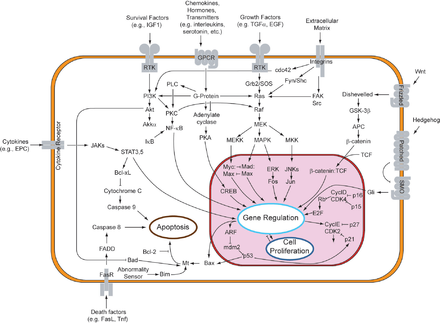
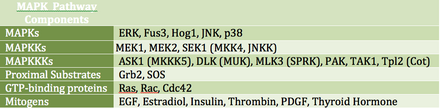
MAP-киназы (MAPK) — это семейство сериновых/треониновых киназ, которые реагируют на различные внеклеточные сигналы роста. Например, гормон роста, эпидермальный фактор роста, тромбоцитарный фактор роста и инсулин считаются митогенными стимулами, которые могут задействовать путь MAPK. Активация этого пути на уровне рецептора инициирует каскад сигналов, посредством которого Ras GTPase обменивает GDP на GTP . Затем Ras активирует Raf-киназу (также известную как MAPKKK), которая активирует MEK (MAPKK). MEK активирует MAPK (также известную как ERK), которая может продолжать регулировать транскрипцию и трансляцию . В то время как RAF и MAPK являются сериновыми/треониновыми киназами, MAPKK является тирозиновой/треониновой киназой.
MAPK может регулировать факторы транскрипции напрямую или косвенно. Его основные транскрипционные цели включают ATF-2, Chop, c-Jun, c-Myc, DPC4, Elk-1, Ets1, Max, MEF2C, NFAT4, Sap1a, STATs, Tal, p53, CREB и Myc. MAPK также может регулировать трансляцию, фосфорилируя киназу S6 в большой рибосомальной субъединице. Он также может фосфорилировать компоненты в восходящей части сигнального каскада MAPK, включая Ras, Sos и сам рецептор EGF . [20]
Канцерогенный потенциал пути MAPK делает его клинически значимым. Он участвует в клеточных процессах, которые могут привести к неконтролируемому росту и последующему образованию опухолей. Мутации в этом пути изменяют его регуляторные эффекты на клеточную дифференциацию , пролиферацию, выживание и апоптоз , все из которых участвуют в различных формах рака . [20]
Липидкиназы фосфорилируют липиды в клетке, как на плазматической мембране, так и на мембранах органелл. Добавление фосфатных групп может изменить реактивность и локализацию липида и может быть использовано в передаче сигнала.

Фосфатидилинозитолкиназы фосфорилируют виды фосфатидилинозитола , создавая такие виды, как фосфатидилинозитол 3,4-бисфосфат (PI(3,4)P 2 ), фосфатидилинозитол 3,4,5-трифосфат (PIP 3 ) и фосфатидилинозитол 3-фосфат (PI3P). К киназам относятся фосфоинозитид 3-киназа (PI3K), фосфатидилинозитол-4-фосфат 3-киназа и фосфатидилинозитол-4,5-бисфосфат 3-киназа . Состояние фосфорилирования фосфатидилинозитола играет важную роль в клеточной сигнализации , например, в сигнальном пути инсулина, а также играет роль в эндоцитозе , экзоцитозе и других событиях транспортировки. [21] [22] Мутации в этих киназах, таких как PI3K, могут привести к раку или резистентности к инсулину . [23]
Ферменты киназы увеличивают скорость реакций, делая гидроксильную группу инозитола более нуклеофильной, часто используя боковую цепь аминокислотного остатка, чтобы действовать как общее основание и депротонировать гидроксил, как показано в механизме ниже. [24] Здесь координируется реакция между аденозинтрифосфатом (АТФ) и фосфатидилинозитолом. Конечным результатом является фосфатидилинозитол-3-фосфат, а также аденозиндифосфат (АДФ) . Ферменты также могут помочь правильно ориентировать молекулу АТФ, а также группу инозитола, чтобы ускорить реакцию. Ионы металлов часто координируются для этой цели. [24]

Сфингозинкиназа (SK) — это липидная киназа, которая катализирует превращение сфингозина в сфингозин-1-фосфат (S1P). Сфинголипиды — это вездесущие мембранные липиды. После активации сфингозинкиназа мигрирует из цитозоля в плазматическую мембрану, где она переносит γ-фосфат (который является последним или конечным фосфатом) из АТФ или ГТФ в сфингозин. Рецептор S1P является рецептором GPCR , поэтому S1P обладает способностью регулировать сигнализацию G-белка. Результирующий сигнал может активировать внутриклеточные эффекторы, такие как ERK, Rho GTPase , Rac GTPase , PLC и AKT/PI3K. Он также может оказывать свое действие на целевые молекулы внутри клетки. Было показано, что S1P напрямую ингибирует активность гистондеацетилазы HDAC . Напротив, дефосфорилированный сфингозин способствует апоптозу клеток , и поэтому важно понимать регуляцию SK из-за ее роли в определении судьбы клеток. Прошлые исследования показывают, что SK могут поддерживать рост раковых клеток, поскольку они способствуют клеточной пролиферации, а SK1 (определенный тип SK) присутствует в более высоких концентрациях в определенных типах рака.
В клетках млекопитающих присутствуют две киназы, SK1 и SK2. SK1 более специфична по сравнению с SK2, и их паттерны экспрессии также различаются. SK1 экспрессируется в клетках легких, селезенки и лейкоцитах, тогда как SK2 экспрессируется в клетках почек и печени. Участие этих двух киназ в выживании клеток, пролиферации, дифференциации и воспалении делает их жизнеспособными кандидатами для химиотерапевтической терапии . [25]
Для многих млекопитающих углеводы обеспечивают большую часть суточной потребности в калориях . Чтобы получить энергию из олигосахаридов , их сначала нужно расщепить на моносахариды , чтобы они могли войти в метаболизм . Киназы играют важную роль почти во всех метаболических путях. На рисунке слева показана вторая фаза гликолиза , которая содержит две важные реакции, катализируемые киназами. Ангидридная связь в 1,3-бисфосфоглицерате нестабильна и имеет высокую энергию. 1,3-бисфосфоглицераткиназе требуется АДФ для проведения своей реакции, в результате которой образуются 3-фосфоглицерат и АТФ. На заключительном этапе гликолиза пируваткиназа переносит фосфорильную группу из фосфоенолпирувата в АДФ, генерируя АТФ и пируват.
Гексокиназа — наиболее распространенный фермент, который использует глюкозу, когда она впервые попадает в клетку. Она преобразует D-глюкозу в глюкозо-6-фосфат, перенося гамма-фосфат АТФ в положение C6. Это важный шаг в гликолизе, поскольку он удерживает глюкозу внутри клетки из-за отрицательного заряда. В своей дефосфорилированной форме глюкоза может очень легко перемещаться вперед и назад через мембрану. [26] Мутации в гене гексокиназы могут привести к дефициту гексокиназы , что может вызвать несфероцитарную гемолитическую анемию . [27]
Фосфофруктокиназа , или PFK, катализирует превращение фруктозо-6-фосфата в фруктозо-1,6-бисфосфат и является важным моментом в регуляции гликолиза. Высокие уровни АТФ, H + и цитрата ингибируют PFK. Если уровни цитрата высокие, это означает, что гликолиз функционирует с оптимальной скоростью. Высокие уровни AMP стимулируют PFK. Болезнь Таруи , заболевание накопления гликогена, которое приводит к непереносимости физических нагрузок, вызвана мутацией в гене PFK, которая снижает его активность. [28]
Киназы действуют на многие другие молекулы, помимо белков, липидов и углеводов. Многие из них действуют на нуклеотиды (ДНК и РНК), включая те, которые участвуют в нуклеотидном взаимопревращении, такие как нуклеозид-фосфаткиназы и нуклеозид-дифосфаткиназы . [30] Другие небольшие молекулы, которые являются субстратами киназ, включают креатин , фосфоглицерат , рибофлавин , дигидроксиацетон , шикимат и многие другие.
Рибофлавинкиназа катализирует фосфорилирование рибофлавина для создания флавинмононуклеотида (ФМН). Он имеет упорядоченный механизм связывания, где рибофлавин должен связаться с киназой, прежде чем он свяжется с молекулой АТФ. [31] Двухвалентные катионы помогают координировать нуклеотид . [31] Общий механизм показан на рисунке ниже.

Рибофлавинкиназа играет важную роль в клетках, поскольку FMN является важным кофактором . FMN также является предшественником флавинадениндинуклеотида (FAD), окислительно-восстановительного кофактора , используемого многими ферментами, в том числе многими в метаболизме . Фактически, есть некоторые ферменты, которые способны осуществлять как фосфорилирование рибофлавина до FMN , так и реакцию FMN до FAD . [32] Рибофлавинкиназа может помочь предотвратить инсульт и, возможно, может быть использована в качестве лечения в будущем. [33] Она также участвует в инфекции, когда изучалась на мышах. [34]
Тимидинкиназа — одна из многих нуклеозидкиназ, которые отвечают за фосфорилирование нуклеозидов. Она фосфорилирует тимидин , создавая тимидинмонофосфат (dTMP). Эта киназа использует молекулу АТФ для поставки фосфата тимидину, как показано ниже. Этот перенос фосфата от одного нуклеотида к другому тимидинкиназой, а также другими нуклеозид- и нуклеотидкиназами, помогает контролировать уровень каждого из различных нуклеотидов.
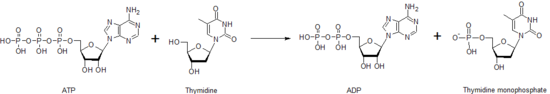
После создания молекулы dTMP другая киназа, тимидилаткиназа , может воздействовать на dTMP, создавая дифосфатную форму, dTDP. Нуклеозиддифосфаткиназа катализирует выработку тимидинтрифосфата , dTTP, который используется в синтезе ДНК . Из-за этого активность тимидинкиназы тесно связана с клеточным циклом и используется в качестве опухолевого маркера в клинической химии . [35] Поэтому ее иногда можно использовать для прогнозирования прогноза для пациента. [36] Пациенты с мутациями в гене тимидинкиназы могут иметь определенный тип синдрома истощения митохондриальной ДНК , заболевания, которое приводит к смерти в раннем детстве. [37]