
Биоматериал — это вещество, которое было разработано для взаимодействия с биологическими системами в медицинских целях — терапевтических (лечение, усиление, восстановление или замена функции ткани организма) или диагностических . Соответствующая область изучения, называемая биоматериаловедением или биоматериальной инженерией , существует около пятидесяти лет. [ требуется обновление ] Она пережила устойчивый рост на протяжении своей истории, при этом многие компании инвестируют большие суммы денег в разработку новых продуктов. Биоматериаловедение охватывает элементы медицины , биологии , химии , тканевой инженерии и материаловедения .
Биоматериал отличается от биологического материала, такого как кость , который производится биологической системой . Однако «биоматериал» и «биологический материал» часто используются взаимозаменяемо. Кроме того, слово «биотериальный» было предложено в качестве потенциального альтернативного слова для биологически произведенных материалов, таких как кость или грибковые биокомпозиты. [ необходима цитата ] Кроме того, следует проявлять осторожность при определении биоматериала как биосовместимого , поскольку он является специфическим для конкретного применения. Биоматериал, который является биосовместимым или подходит для одного применения, может быть не биосовместимым в другом. [1]
Материал , используемый в контакте с живыми тканями, организмами или микроорганизмами. [2] [a] [b] [c]
Биоматериалы могут быть получены либо из природы, либо синтезированы в лаборатории с использованием различных химических подходов с использованием металлических компонентов, полимеров , керамики или композитных материалов . Они часто используются и/или адаптируются для медицинского применения и, таким образом, включают в себя всю или часть живой структуры или биомедицинского устройства, которое выполняет, дополняет или заменяет естественную функцию. Такие функции могут быть относительно пассивными, например, используемые для сердечного клапана , или, возможно, биоактивными с более интерактивной функциональностью, например, покрытые гидроксиапатитом имплантаты тазобедренного сустава . Биоматериалы также широко используются в стоматологии, хирургии и доставке лекарств. Например, конструкция с пропитанными фармацевтическими продуктами может быть помещена в тело, что позволяет пролонгированно высвобождение лекарства в течение длительного периода времени. Биоматериал также может быть аутотрансплантатом , аллотрансплантатом или ксенотрансплантатом , используемым в качестве материала для трансплантации . [ необходима цитата ]
Способность сконструированного биоматериала вызывать физиологическую реакцию, которая поддерживает функцию и производительность биоматериала, известна как биоактивность. Чаще всего в биоактивных стеклах и биоактивной керамике этот термин относится к способности имплантированных материалов хорошо связываться с окружающей тканью в остеокондуктивных или остеопродуктивных ролях. [4] Материалы для костных имплантатов часто разрабатываются для содействия росту костей при растворении в окружающей жидкости организма. [5] Таким образом, для многих биоматериалов желательны хорошая биосовместимость наряду с хорошей прочностью и скоростью растворения. Обычно биоактивность биоматериалов измеряется поверхностной биоминерализацией, при которой на поверхности образуется собственный слой гидроксиапатита . В наши дни разработка клинически полезных биоматериалов значительно усовершенствована с появлением вычислительных процедур, которые могут предсказывать молекулярные эффекты биоматериалов в терапевтических условиях на основе ограниченных экспериментов in vitro . [6]
Самоорганизация — наиболее распространенный термин в современном научном сообществе для описания спонтанной агрегации частиц (атомов, молекул, коллоидов , мицелл и т. д.) без воздействия каких-либо внешних сил. Известно, что большие группы таких частиц собираются в термодинамически стабильные, структурно четко определенные массивы, весьма напоминающие одну из семи кристаллических систем, обнаруженных в металлургии и минералогии (например, гранецентрированную кубическую, объемноцентрированную кубическую и т. д.). Фундаментальное различие в равновесной структуре заключается в пространственном масштабе элементарной ячейки (параметре решетки) в каждом конкретном случае.
Молекулярная самосборка широко распространена в биологических системах и обеспечивает основу для широкого спектра сложных биологических структур. Это включает в себя новый класс механически превосходных биоматериалов, основанных на микроструктурных особенностях и конструкциях, найденных в природе. Таким образом, самосборка также появляется как новая стратегия в химическом синтезе и нанотехнологиях . Молекулярные кристаллы, жидкие кристаллы, коллоиды, мицеллы, эмульсии , полимеры с разделенными фазами, тонкие пленки и самоорганизующиеся монослои представляют собой примеры типов высокоупорядоченных структур, которые получаются с помощью этих методов. Отличительной чертой этих методов является самоорганизация. [7] [8] [9]
Почти все материалы можно рассматривать как иерархически структурированные, поскольку изменения в пространственном масштабе вызывают различные механизмы деформации и повреждения. [10] Однако в биологических материалах эта иерархическая организация присуща микроструктуре. Одним из первых примеров этого в истории структурной биологии является ранняя работа по рассеянию рентгеновских лучей по иерархической структуре волос и шерсти , проведенная Эстбери и Вудсом. [11] В костях, например, коллаген является строительным блоком органической матрицы , тройной спирали диаметром 1,5 нм. Эти молекулы тропоколлагена интеркалированы с минеральной фазой ( гидроксиапатит , фосфат кальция), образуя фибриллы , которые скручиваются в геликоиды чередующихся направлений. Эти « остеоны » являются основными строительными блоками костей, причем распределение объемной доли между органической и минеральной фазой составляет около 60/40.
На другом уровне сложности кристаллы гидроксиапатита представляют собой минеральные пластинки диаметром приблизительно от 70 до 100 нм и толщиной 1 нм. Они изначально зарождаются в промежутках между коллагеновыми фибриллами. [12]
Аналогично, иерархия раковины ушка начинается на наноуровне, с органического слоя толщиной от 20 до 30 нм. Этот слой продолжается монокристаллами арагонита ( полиморф CaCO 3 ), состоящими из «кирпичей» размером 0,5 и заканчивающимися слоями примерно 0,3 мм (мезоструктура). [13]
Крабы — членистоногие, панцирь которых состоит из минерализованного твердого компонента (демонстрирует хрупкое разрушение) и более мягкого органического компонента, состоящего в основном из хитина . Хрупкий компонент расположен в виде спирали. Каждый из этих минеральных «стержней» (диаметром 1 мкм) содержит хитин-белковые фибриллы диаметром около 60 нм. Эти фибриллы состоят из каналов диаметром 3 нм, которые связывают внутреннюю и внешнюю части панциря.
Биоматериалы используются в:
Биоматериалы должны быть совместимы с организмом, и часто возникают проблемы биосовместимости , которые должны быть решены до того, как продукт может быть размещен на рынке и использован в клинических условиях. Из-за этого биоматериалы обычно подвергаются тем же требованиям, что и новые лекарственные терапии. [19] [20] Все производственные компании также обязаны обеспечивать прослеживаемость всех своих продуктов, чтобы в случае обнаружения дефектного продукта можно было отследить другие в той же партии.
Сульфат кальция (его α- и β-полугидраты) — хорошо известный биосовместимый материал, который широко используется в качестве заменителя костного трансплантата в стоматологии или в качестве его связующего вещества. [21] [22]
В Соединенных Штатах 49% из 250 000 процедур замены клапанов, выполняемых ежегодно, включают механический имплантат клапана. Наиболее широко используемый клапан — это двустворчатый дисковый сердечный клапан или клапан Св. Иуды. Механика включает два полукруглых диска, движущихся вперед и назад, причем оба обеспечивают поток крови, а также способны образовывать уплотнение против обратного потока. Клапан покрыт пиролитическим углеродом и прикреплен к окружающим тканям сеткой из тканого материала под названием дакрон (торговое название полиэтилентерефталата компании Du Pont ). Сетка позволяет тканям тела расти, одновременно встраивая клапан. [23]
В большинстве случаев искусственная ткань выращивается из собственных клеток пациента. Однако, когда повреждение настолько сильное, что невозможно использовать собственные клетки пациента, выращиваются искусственные клетки ткани. Трудность заключается в поиске каркаса, на котором клетки могут расти и организовываться. Характеристики каркаса должны быть такими, чтобы он был биосовместимым, клетки могли прилипать к каркасу, был механически прочным и биоразлагаемым . Одним из успешных каркасов является сополимер молочной и гликолевой кислот . [ 23]
Как обсуждалось ранее, биоматериалы используются в медицинских устройствах для лечения, помощи или замены функции в организме человека. Применение определенного биоматериала должно сочетать необходимый состав, свойства материала, структуру и желаемую реакцию in vivo для выполнения желаемой функции. Категоризации различных желаемых свойств определяются для максимизации функциональных результатов. [24] [25]
Реакция хозяина определяется как «реакция организма хозяина (локальная и системная) на имплантированный материал или устройство». Большинство материалов будут реагировать при контакте с человеческим телом. Успех биоматериала зависит от реакции ткани хозяина на инородный материал. Конкретные реакции между тканью хозяина и биоматериалом могут быть вызваны биосовместимостью материала . [25] [26]
Функциональность in vivo и долговечность любого имплантируемого медицинского устройства зависят от реакции организма на инородный материал. [27] Организм проходит каскад процессов, определяемых реакцией на инородное тело (FBR), чтобы защитить хозяина от инородного материала. Взаимодействие между устройством и тканью/кровью хозяина, а также между тканью/кровью хозяина и устройством необходимо понимать, чтобы предотвратить осложнения и отказ устройства.
Повреждение тканей, вызванное имплантацией устройства, вызывает воспалительные и лечебные реакции во время FBR. Воспалительная реакция происходит в течение двух периодов времени: острая фаза и хроническая фаза. Острая фаза происходит в течение первых часов или дней после имплантации и определяется по экссудации жидкости и белка [28] вместе с нейтрофильной реакцией. [29] Во время острой фазы организм пытается очистить и залечить рану, доставляя избыток крови, белков и моноцитов к месту. [30] Продолжающееся воспаление приводит к хронической фазе, которую можно классифицировать по наличию моноцитов, макрофагов и лимфоцитов. [29] Кроме того, кровеносные сосуды и соединительная ткань формируются для заживления раневой области. [31]
Биосовместимость связана с поведением биоматериалов в различных средах при различных химических и физических условиях. Термин может относиться к определенным свойствам материала без указания того, где или как материал будет использоваться. Например, материал может вызывать незначительный или нулевой иммунный ответ в данном организме и может или не может интегрироваться с определенным типом клеток или тканей . Иммуноинформированные биоматериалы, которые направляют иммунный ответ, а не пытаются обойти этот процесс, являются одним из подходов, который показывает многообещающие результаты. [32] Неоднозначность термина отражает продолжающееся развитие понимания того, «как биоматериалы взаимодействуют с человеческим телом » и, в конечном итоге, «как эти взаимодействия определяют клинический успех медицинского устройства (например, кардиостимулятора или замены тазобедренного сустава )». Современные медицинские устройства и протезы часто изготавливаются из более чем одного материала, поэтому не всегда может быть достаточно говорить о биосовместимости определенного материала. [33] Хирургическая имплантация биоматериала в организм вызывает воспалительную реакцию организма с сопутствующим заживлением поврежденной ткани. В зависимости от состава имплантируемого материала, поверхности имплантата, механизма усталости и химического разложения возможны и другие реакции. Они могут быть как местными, так и системными. К ним относятся иммунный ответ, реакция на инородное тело с изоляцией имплантата сосудистой соединительной тканью, возможная инфекция и влияние на продолжительность жизни имплантата. Реакция «трансплантат против хозяина» является ауто- и аллоиммунным заболеванием, проявляющим вариабельное клиническое течение. Она может проявляться как в острой, так и в хронической форме, поражая множество органов и тканей и вызывая серьезные осложнения в клинической практике, как при трансплантации, так и при внедрении биосовместимых материалов. [34]
Биоматериал должен выполнять свою предполагаемую функцию в живом организме, не оказывая отрицательного влияния на другие ткани и органы тела. Чтобы предотвратить нежелательные взаимодействия органов и тканей, биоматериалы должны быть нетоксичными . Токсичность биоматериала относится к веществам, которые выделяются из биоматериала in vivo . Биоматериал не должен выделять ничего в окружающую среду, если только он не предназначен для этого. Нетоксичность означает, что биоматериал: неканцерогенный, непирогенный , неаллергенный , совместимый с кровью и невоспалительный . [35] Однако биоматериал может быть разработан так, чтобы включать токсичность для предполагаемой цели. Например, применение токсичного биоматериала изучается во время тестирования иммунотерапии рака in vivo и in vitro . Токсичные биоматериалы предоставляют возможность манипулировать и контролировать раковые клетки. [36] В одном из недавних исследований говорится: «Усовершенствованные нанобиоматериалы, включая липосомы , полимеры и кремний , играют жизненно важную роль в совместной доставке лекарств и иммуномодуляторов . Эти системы доставки на основе нанобиоматериалов могут эффективно стимулировать противоопухолевые иммунные реакции и одновременно снижать токсические побочные эффекты». [37] Это яркий пример того, как биосовместимость биоматериала может быть изменена для получения любой желаемой функции.
Биоразлагаемые биоматериалы относятся к материалам, которые разлагаются посредством естественных ферментативных реакций . Применение биоразлагаемых синтетических полимеров началось в конце 1960-х годов. [38] Биоразлагаемые материалы имеют преимущество перед другими материалами, так как они имеют меньший риск вредных последствий в долгосрочной перспективе. В дополнение к этическим достижениям при использовании биоразлагаемых материалов, они также улучшают биосовместимость материалов, используемых для имплантации. [38] Несколько свойств, включая биосовместимость, важны при рассмотрении различных биоразлагаемых биоматериалов. Биоразлагаемые биоматериалы могут быть синтетическими или натуральными в зависимости от их источника и типа внеклеточного матрикса (ECM). [39]
Некоторые из наиболее часто используемых биосовместимых материалов (или биоматериалов) являются полимерами из-за их присущей им гибкости и настраиваемых механических свойств . Медицинские устройства из пластика часто изготавливаются из нескольких избранных, включая: циклический олефиновый сополимер (COC), поликарбонат (PC), полиэфиримид (PEI), медицинский поливинилхлорид (PVC), полиэфирсульфон (PES), полиэтилен (PE), полиэфирэфиркетон (PEEK) и даже полипропилен (PP). Для обеспечения биосовместимости существует ряд регламентированных испытаний, которые материал должен пройти, чтобы быть сертифицированным для использования. К ним относятся Тест на биологическую реактивность Фармакопеи США IV (USP Класс IV) и Биологическая оценка медицинских устройств Международной организации по стандартизации 10993 (ISO 10993). Основная цель испытаний на биосовместимость – количественно оценить острую и хроническую токсичность материала и определить любые потенциальные неблагоприятные эффекты в условиях использования, поэтому испытания, необходимые для данного материала, зависят от его конечного использования (т. е. кровь, центральная нервная система и т. д.) [40] .
Два свойства, которые оказывают большое влияние на функциональность биоматериала, — это поверхностные и объемные свойства . [41]
Объемные свойства относятся к физическим и химическим свойствам, которые составляют биоматериал на протяжении всей его жизни. Они могут быть специально созданы для имитации физико-химических свойств ткани, которую заменяет материал. Это механические свойства, которые создаются из атомной и молекулярной структуры материала.
Важные объемные свойства: [42]
Поверхностные свойства относятся к химическим и топографическим особенностям поверхности биоматериала, которые будут иметь прямое взаимодействие с кровью/тканями хозяина. [43] Поверхностная инженерия и модификация позволяют врачам лучше контролировать взаимодействие биоматериала с живой системой хозяина.
Важные свойства поверхности: [44]
Помимо того, что материал сертифицирован как биосовместимый , биоматериалы должны быть специально разработаны для их целевого применения в медицинском устройстве . Это особенно важно с точки зрения механических свойств , которые определяют, как ведет себя данный биоматериал. Одним из наиболее важных параметров материала является модуль Юнга, E , который описывает упругую реакцию материала на напряжения . Модули Юнга ткани и устройства, которое соединяется с ней, должны точно совпадать для оптимальной совместимости между устройством и телом, независимо от того, имплантировано ли устройство или установлено снаружи. Соответствие модуля упругости позволяет ограничить движение и расслоение на биоинтерфейсе между имплантатом и тканью, а также избежать концентрации напряжений , которая может привести к механическому отказу . Другими важными свойствами являются прочность на растяжение и сжатие , которые количественно определяют максимальные напряжения, которые материал может выдержать до разрушения, и могут использоваться для установки пределов напряжений , которым может подвергаться устройство внутри или снаружи тела. В зависимости от области применения может быть желательно, чтобы биоматериал имел высокую прочность, чтобы он был устойчив к разрушению при воздействии нагрузки, однако в других областях применения может быть выгодно, чтобы материал был низкопрочным. Существует тщательный баланс между прочностью и жесткостью, который определяет, насколько устойчивым к разрушению является устройство из биоматериала. Обычно, по мере увеличения эластичности биоматериала предел прочности на разрыв уменьшается и наоборот. Одной из областей применения, где нежелателен высокопрочный материал, является нейронные зонды ; если в этих областях применения используется высокопрочный материал, ткань всегда выйдет из строя раньше, чем устройство (под приложенной нагрузкой ), поскольку модуль Юнга твердой мозговой оболочки и мозговой ткани составляет порядка 500 Па . Когда это происходит, может произойти необратимое повреждение мозга, поэтому биоматериал должен иметь модуль упругости, меньший или равный мозговой ткани, и низкую прочность на разрыв, если ожидается приложенная нагрузка. [46] [47]
Для имплантированных биоматериалов, которые могут испытывать колебания температуры , например, зубных имплантатов , важна пластичность . Материал должен быть пластичным по той же причине, по которой предел прочности на разрыв не может быть слишком высоким; пластичность позволяет материалу сгибаться без разрушения , а также предотвращает концентрацию напряжений в тканях при изменении температуры. Свойство материала — прочность — также важно для зубных имплантатов, а также для любого другого жесткого, несущего нагрузку имплантата, такого как замена тазобедренного сустава . Прочность описывает способность материала деформироваться под действием приложенного напряжения без разрушения , а высокая прочность позволяет имплантатам из биоматериала дольше служить внутри тела, особенно при воздействии большого напряжения или циклически нагруженных напряжений , таких как напряжения, приложенные к тазобедренному суставу во время бега. [46]
Для медицинских устройств, которые имплантируются или прикрепляются к коже, еще одним важным свойством, требующим рассмотрения, является жесткость при изгибе, D. Жесткость при изгибе будет определять, насколько хорошо поверхность устройства может поддерживать конформный контакт с поверхностью ткани , что особенно важно для устройств, которые измеряют движение ткани ( деформацию ), электрические сигналы ( импеданс ) или предназначены для прилипания к коже без расслаивания , как в эпидермальной электронике. Поскольку жесткость при изгибе зависит от толщины материала, h , в третьей степени ( h 3 ), очень важно, чтобы биоматериал можно было формировать в тонкие слои в ранее упомянутых приложениях, где конформность имеет первостепенное значение. [48]
Молекулярный состав биоматериала определяет физические и химические свойства биоматериала. Эти составы создают сложные структуры, которые позволяют биоматериалу функционировать, и поэтому их необходимо определить и понять, чтобы разработать биоматериал. Биоматериалы могут быть разработаны для копирования природных организмов, процесс, известный как биомиметика . [49] Структуру биоматериала можно наблюдать на разных уровнях, чтобы лучше понять свойства и функции материалов.

Расположение атомов и ионов в материале является одним из важнейших структурных свойств биоматериала. Атомную структуру материала можно рассматривать на разных уровнях: субатомном , атомном или молекулярном , а также на ультраструктуре, созданной атомами и молекулами. Межмолекулярные силы между атомами и молекулами, составляющими материал, будут определять его материальные и химические свойства. [50]
На субатомном уровне наблюдается электрическая структура отдельного атома для определения его взаимодействия с другими атомами и молекулами. Молекулярная структура наблюдает расположение атомов внутри материала. Наконец, ультраструктура наблюдает трехмерную структуру, созданную из атомных и молекулярных структур материала. Твердое состояние материала характеризуется внутримолекулярными связями между атомами и молекулами, составляющими материал. Типы внутримолекулярных связей включают: ионные связи , ковалентные связи и металлические связи . Эти связи будут определять физические и химические свойства материала, а также тип материала ( керамика , металл или полимер ).
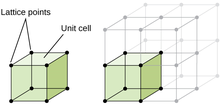
Микроструктура материала относится к структуре объекта, организма или материала, рассматриваемого при увеличении более чем в 25 раз. [51] Она состоит из различных фаз формы, размера и распределения зерен, пор, осадков и т. д. Большинство твердых микроструктур являются кристаллическими , однако некоторые материалы, такие как определенные полимеры, не кристаллизуются в твердом состоянии. [52]
Кристаллическая структура — это состав ионов, атомов и молекул, которые удерживаются вместе и упорядочиваются в трехмерной форме. Главное различие между кристаллической структурой и аморфной структурой заключается в порядке компонентов. Кристаллическая структура имеет самый высокий уровень порядка, возможный в материале, тогда как аморфная структура состоит из нерегулярностей в упорядоченном рисунке. [53] Один из способов описания кристаллических структур — через кристаллическую решетку , которая является трехмерным представлением местоположения повторяющегося фактора ( элементарной ячейки ) в структуре, обозначенной решетками . [54] Существует 14 различных конфигураций расположения атомов в кристаллической структуре, и все они представлены решетками Браве . [ требуется ссылка ]
В процессе формирования кристаллической структуры могут образовываться различные примеси, неровности и другие дефекты. Эти дефекты могут образовываться в результате деформации твердого тела, быстрого охлаждения или высокоэнергетического излучения. [55] Типы дефектов включают точечные дефекты, линейные дефекты, а также краевые дислокации.
Макроструктура относится к общим геометрическим свойствам, которые будут влиять на силу при разрушении, жесткость, изгиб, распределение напряжений и вес материала. Для выявления макроструктуры материала требуется небольшое увеличение или его отсутствие. Наблюдение за макроструктурой выявляет такие свойства, как полости, пористость , газовые пузырьки, расслоение и трещины . [56] Прочность и модуль упругости материала не зависят от макроструктуры.
Биоматериалы могут быть созданы только с использованием материалов, полученных из растений и животных, для изменения, замены или восстановления человеческих тканей/органов. Использование природных биоматериалов использовалось еще в Древнем Египте, где коренные народы использовали кожу животных в качестве швов. Более современным примером является замена тазобедренного сустава с использованием материала из слоновой кости, которая была впервые зарегистрирована в Германии в 1891 году. [57]
Ценные критерии жизнеспособности природных биоматериалов:
Примеры природных биоматериалов:
Биополимеры — это полимеры , вырабатываемые живыми организмами. Целлюлоза и крахмал , белки и пептиды , а также ДНК и РНК — все это примеры биополимеров, в которых мономерными единицами являются сахара , аминокислоты и нуклеотиды . [60] Целлюлоза — это как самый распространенный биополимер, так и самое распространенное органическое соединение на Земле. Около 33% всего растительного материала составляет целлюлоза. [61] [62] Аналогичным образом, шелк (белковый биополимер) привлек огромный исследовательский интерес во множестве областей, включая тканевую инженерию и регенеративную медицину, микрофлюидику, доставку лекарств. [63] [64]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )