Метилирование гистонов — это процесс, при котором метильные группы переносятся на аминокислоты гистоновых белков , которые составляют нуклеосомы , которые двойная спираль ДНК обвивает, образуя хромосомы . Метилирование гистонов может как увеличивать, так и уменьшать транскрипцию генов в зависимости от того, какие аминокислоты в гистонах метилированы и сколько метильных групп присоединено. События метилирования, которые ослабляют химическое притяжение между хвостами гистонов и ДНК, увеличивают транскрипцию, поскольку они позволяют ДНК раскручиваться от нуклеосом, так что белки факторов транскрипции и РНК-полимераза могут получить доступ к ДНК. Этот процесс имеет решающее значение для регуляции экспрессии генов , что позволяет разным клеткам экспрессировать разные гены.
Метилирование гистонов, как механизм изменения структуры хроматина , связано со стимуляцией нейронных путей, которые, как известно, важны для формирования долговременной памяти и обучения. [1] Метилирование гистонов имеет решающее значение почти для всех фаз эмбрионального развития животных . [2]
Животные модели показали, что метилирование и другие механизмы эпигенетической регуляции связаны с состояниями старения, нейродегенеративными заболеваниями и умственной отсталостью [1] ( синдром Рубинштейна-Тейби , Х-сцепленная умственная отсталость ). [3] Неправильная регуляция H3K4, H3K27 и H4K20 связана с раком . [4] Эта модификация изменяет свойства нуклеосомы и влияет на ее взаимодействие с другими белками, особенно в отношении процессов транскрипции генов.
Основная единица хроматина , называемая нуклеосомой , содержит ДНК, намотанную вокруг белкового октамера . Этот октамер состоит из двух копий каждого из четырех гистоновых белков: H2A , H2B , H3 и H4 . Каждый из этих белков имеет удлинение хвоста, и эти хвосты являются целями модификации нуклеосомы путем метилирования. Активация или инактивация ДНК во многом зависит от конкретного метилированного остатка хвоста и степени его метилирования. Гистоны могут быть метилированы только по остаткам лизина (K) и аргинина (R), но метилирование чаще всего наблюдается на остатках лизина гистоновых хвостов H3 и H4. [7] Конец хвоста, наиболее удаленный от ядра нуклеосомы, — это N-конец (остатки нумеруются, начиная с этого конца). Обычные сайты метилирования, связанные с активацией генов, включают H3K4, H3K48 и H3K79. Распространенными сайтами для инактивации генов являются H3K9 и H3K27. [8] Исследования этих сайтов показали, что метилирование гистоновых хвостов в различных остатках служит маркерами для привлечения различных белков или белковых комплексов, которые служат для регулирования активации или инактивации хроматина.
Остатки лизина и аргинина содержат аминогруппы, которые придают основные и гидрофобные характеристики. Лизин может быть моно-, ди- или триметилирован с метильной группой, заменяющей каждый водород его группы NH3+. При наличии свободной группы NH2 и NH2+ аргинин может быть моно- или диметилирован. Это диметилирование может происходить асимметрично по группе NH2 или симметрично с одним метилированием по каждой группе. [9] Каждое добавление метильной группы к каждому остатку требует определенного набора белковых ферментов с различными субстратами и кофакторами. Как правило, метилирование остатка аргинина требует комплекса, включающего белок аргининметилтрансферазу (PRMT), тогда как лизин требует определенной гистонметилтрансферазы (HMT), обычно содержащей эволюционно консервативный домен SET. [10]
Различные степени метилирования остатков могут обеспечивать различные функции, как показано на примере метилирования обычно изучаемого остатка H4K20. Монометилированный H4K20 ( H4K20me 1) участвует в уплотнении хроматина и, следовательно, в репрессии транскрипции. Однако H4K20me2 жизненно важен для восстановления поврежденной ДНК. При диметилировании остаток обеспечивает платформу для связывания белка 53BP1, участвующего в восстановлении двухцепочечных разрывов ДНК путем негомологичного соединения концов. Наблюдается, что H4K20me3 концентрируется в гетерохроматине, и снижение этого триметилирования наблюдается при прогрессировании рака. Таким образом, H4K20me3 играет дополнительную роль в репрессии хроматина. [10] Восстановление двухцепочечных разрывов ДНК в хроматине также происходит путем гомологичной рекомбинации и также включает метилирование гистонов ( H3K9me3 ) для облегчения доступа ферментов репарации к участкам повреждения. [11]

Геном плотно сжат в хроматин, который необходимо ослабить для транскрипции . Чтобы остановить транскрипцию гена, ДНК должна быть скручена плотнее. Это можно сделать, модифицируя гистоны в определенных местах путем метилирования. Гистонметилтрансферазы — это ферменты, которые переносят метильные группы с S-аденозилметионина (SAM) на остатки лизина или аргинина гистонов H3 и H4. Существуют примеры, когда также метилируются основные глобулярные домены гистонов.
Гистонметилтрансферазы специфичны либо к лизину, либо к аргинину. Лизинспецифичные трансферазы далее подразделяются на те, имеют ли они домен SET или не-SET. Эти домены точно определяют, как фермент катализирует перенос метила от SAM к белку-переносчику и далее к остатку гистона. [12] Метилтрансферазы могут добавлять 1-3 метила к целевым остаткам.
Эти метилы, которые добавляются к гистонам, регулируют транскрипцию, блокируя или стимулируя доступ ДНК к факторам транскрипции. Таким образом, целостность генома и эпигенетическое наследование генов находятся под контролем действий гистонметилтрансфераз. Метилирование гистонов является ключевым фактором в различении целостности генома и генов, которые экспрессируются клетками, тем самым давая клеткам их идентичность.
Метилированные гистоны могут либо подавлять, либо активировать транскрипцию. [12] Например, в то время как H3K4me2, H3K4me3 и H3K79me3 обычно связаны с транскрипционной активностью, тогда как H3K9me2 , H3K9me3 , H3K27me2, H3K27me3 и H4K20me3 связаны с транскрипционной репрессией. [13]
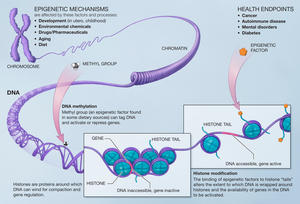
Изменения, внесенные в гистон, оказывают влияние на гены, которые экспрессируются в клетке, и это тот случай, когда метилы добавляются к остаткам гистона метилтрансферазами гистонов. [14] Метилирование гистонов играет важную роль в сборке механизма гетерохроматина и поддержании границ генов между транскрибируемыми и нетранскрибируемыми генами. Эти изменения передаются потомству и могут быть затронуты средой, которой подвергаются клетки. Эпигенетические изменения обратимы, что означает, что они могут быть мишенями для терапии.
Активность гистоновых метилтрансфераз компенсируется активностью гистоновых деметилаз. Это позволяет включать или выключать транскрипцию путем отмены ранее существовавших модификаций. Необходимо, чтобы активность как гистоновых метилтрансфераз, так и гистоновых деметилаз строго регулировалась. Неправильная регуляция любого из них может привести к экспрессии генов, что приводит к повышенной восприимчивости к болезням. Многие виды рака возникают из-за ненадлежащих эпигенетических эффектов неправильно отрегулированного метилирования. [15] Однако, поскольку эти процессы иногда обратимы, существует интерес к использованию их активности совместно с противораковой терапией. [15]
В женских организмах сперматозоид, содержащий Х-хромосому, оплодотворяет яйцеклетку, давая эмбриону две копии Х-хромосомы. Самкам, однако, изначально не требуются обе копии Х-хромосомы, поскольку это только удвоит количество транскрибируемых белковых продуктов, как показано в гипотезе о дозовой компенсации. Отцовская Х-хромосома быстро инактивируется во время первых нескольких делений. [16] Эта неактивная Х-хромосома (Xi) упакована в невероятно плотную форму хроматина, называемую гетерохроматином . [17] Эта упаковка происходит из-за метилирования различных остатков лизина, которые помогают формировать различные гистоны. У людей инактивация Х является случайным процессом, который опосредован некодирующей РНК XIST. [18]
Хотя метилирование остатков лизина происходит на многих различных гистонах, наиболее характерное для Xi происходит на девятом лизине третьего гистона (H3K9). В то время как одиночное метилирование этой области позволяет связанным генам оставаться транскрипционно активными, [19] в гетерохроматине этот остаток лизина часто метилируется дважды или трижды, H3K9me2 или H3K9me3 соответственно, чтобы гарантировать, что связанная ДНК неактивна. Более поздние исследования показали, что H3K27me3 и H4K20me1 также распространены у ранних эмбрионов. Другие маркировки метилирования, связанные с транскрипционно активными областями ДНК, H3K4me2 и H3K4me3, отсутствуют в хромосоме Xi вместе со многими маркировками ацетилирования. Хотя было известно, что определенные маркировки метилирования гистона Xi остаются относительно постоянными между видами, недавно было обнаружено, что разные организмы и даже разные клетки внутри одного организма могут иметь разные маркировки для своей инактивации X. [20] Благодаря метилированию гистонов происходит генетический импринтинг , в результате которого один и тот же гомолог X остается инактивированным в ходе репликации хромосом и деления клеток.
Из-за того, что метилирование гистонов регулирует большую часть того, какие гены транскрибируются, даже незначительные изменения в паттернах метилирования могут иметь ужасные последствия для организма. Мутации, которые происходят для увеличения и уменьшения метилирования, имеют большие изменения в регуляции генов, в то время как мутации ферментов, таких как метилтрансфераза и деметилтрансфераза, могут полностью изменить то, какие белки транскрибируются в данной клетке. Избыточное метилирование хромосомы может привести к тому, что определенные гены, необходимые для нормальной функции клетки, станут инактивированными. В определенном штамме дрожжей, Saccharomyces cerevisiae , мутация, которая приводит к метилированию трех остатков лизина на третьем гистоне, H3K4, H3K36 и H3K79, вызывает задержку митотического клеточного цикла, поскольку многие гены, необходимые для этого прогрессирования, инактивируются. Эта экстремальная мутация приводит к гибели организма. Было обнаружено, что удаление генов, которые в конечном итоге обеспечивают выработку гистонметилтрансферазы, позволяет этому организму жить, поскольку его остатки лизина не метилированы. [21]
В последние годы внимание исследователей привлекло то, что многие виды рака в значительной степени вызваны эпигенетическими факторами. Рак может быть вызван различными способами из-за дифференциального метилирования гистонов. С момента открытия онкогенов , а также генов-супрессоров опухолей стало известно, что большой фактор возникновения и подавления рака находится в нашем собственном геноме. Если области вокруг онкогенов становятся неметилированными, эти гены, вызывающие рак, имеют потенциал транскрибироваться с пугающей скоростью. Противоположностью этому является метилирование генов-супрессоров опухолей. В случаях, когда области вокруг этих генов были сильно метилированы, ген-супрессор опухолей был неактивен, и поэтому вероятность возникновения рака была выше. Эти изменения в паттерне метилирования часто обусловлены мутациями в метилтрансферазе и деметилтрансферазе. [22] Другие типы мутаций в белках, таких как изоцитратдегидрогеназа 1 (IDH1) и изоцитратдегидрогеназа 2 (IDH2), могут вызывать инактивацию гистондеметилтрансферазы, что, в свою очередь, может привести к различным видам рака, глиомам и лейкемиям, в зависимости от того, в каких клетках происходит мутация. [23]
В одноуглеродном метаболизме аминокислоты глицин и серин преобразуются через циклы фолата и метионина в нуклеотидные предшественники и SAM. Множество питательных веществ подпитывают одноуглеродный метаболизм, включая глюкозу , серин, глицин и треонин . Высокие уровни донора метильной группы SAM влияют на метилирование гистонов, что может объяснить, как высокие уровни SAM предотвращают злокачественную трансформацию. [24]