Надпочечники (также известные как надпочечники ) являются эндокринными железами , которые вырабатывают различные гормоны, включая адреналин и стероиды альдостерон и кортизол . [1] [2] Они находятся над почками . Каждая железа имеет внешнюю кору , которая вырабатывает стероидные гормоны , и внутреннюю мозговую . Сама кора надпочечников делится на три основные зоны: клубочковую зону , пучковую зону и сетчатую зону . [3]
Кора надпочечников вырабатывает три основных типа стероидных гормонов : минералокортикоиды , глюкокортикоиды и андрогены . Минералокортикоиды (например, альдостерон ), вырабатываемые в клубочковой зоне, помогают регулировать артериальное давление и электролитный баланс . Глюкокортикоиды кортизол и кортизон синтезируются в пучковой зоне; их функции включают регуляцию метаболизма и подавление иммунной системы . Самый внутренний слой коры, сетчатая зона, вырабатывает андрогены, которые преобразуются в полностью функциональные половые гормоны в гонадах и других органах-мишенях. [4] Выработка стероидных гормонов называется стероидогенезом и включает ряд реакций и процессов, которые происходят в корковых клетках. [5] Мозговой слой вырабатывает катехоламины , которые выполняют функцию быстрого ответа по всему телу в стрессовых ситуациях. [4]
Ряд эндокринных заболеваний связаны с дисфункциями надпочечников. Избыточная продукция кортизола приводит к синдрому Кушинга , тогда как недостаточная продукция связана с болезнью Аддисона . Врожденная гиперплазия надпочечников — это генетическое заболевание, вызванное нарушением регуляции механизмов эндокринного контроля. [4] [6] Различные опухоли могут возникать из ткани надпочечников и обычно обнаруживаются при медицинском сканировании при поиске других заболеваний. [7]

Надпочечники расположены по обеим сторонам тела в забрюшинном пространстве , выше и немного медиальнее почек . У людей правый надпочечник имеет пирамидальную форму, тогда как левый имеет форму полумесяца или полумесяца и несколько больше. [8] Надпочечники имеют длину около 5 см, ширину 3 см и толщину до 1 см. [9] Их общий вес у взрослого человека составляет от 7 до 10 граммов. [10] Железы желтоватого цвета. [8]
Надпочечники окружены жировой капсулой и лежат внутри почечной фасции , которая также окружает почки. Слабая перегородка (стенка) соединительной ткани отделяет железы от почек. [11] Надпочечники находятся непосредственно под диафрагмой и прикреплены к ножкам диафрагмы почечной фасцией. [11]
Каждый надпочечник состоит из двух отдельных частей, каждая из которых имеет уникальную функцию: внешняя кора надпочечника и внутренняя мозговая часть , обе из которых вырабатывают гормоны. [12]

Кора надпочечников — это внешняя область, а также самая большая часть надпочечника. Она разделена на три отдельные зоны: zona glomerulosa, zona fasciculata и zona reticularis. Каждая зона отвечает за выработку определенных гормонов. Кора надпочечников — это самый внешний слой надпочечника. Внутри коры находятся три слоя, называемые «зонами». При рассмотрении под микроскопом каждый слой имеет особый вид, и каждый имеет свою функцию. [13] Кора надпочечников предназначена для выработки гормонов , а именно альдостерона , кортизола и андрогенов . [14]
Самая наружная зона коркового вещества надпочечников — это клубочковая зона . Она расположена непосредственно под фиброзной капсулой железы. Клетки в этом слое образуют овальные группы, отделенные тонкими тяжами соединительной ткани от фиброзной капсулы железы и несущие широкие капилляры . [15]
Этот слой является основным местом выработки альдостерона , минералокортикоида , под действием фермента альдостеронсинтазы . [16] [17] Альдостерон играет важную роль в долгосрочной регуляции артериального давления . [18]
Пучковая зона расположена между клубочковой и сетчатой зонами. Клетки этого слоя отвечают за выработку глюкокортикоидов, таких как кортизол . [19] Это самый большой из трех слоев, на который приходится почти 80% объема коркового вещества. [3] В пучковой зоне клетки расположены в колонках, радиально ориентированных по направлению к мозговому веществу. Клетки содержат многочисленные липидные капли, обильные митохондрии и сложный гладкий эндоплазматический ретикулум . [15]
Самый внутренний корковый слой, сетчатая зона , непосредственно примыкает к мозговому веществу. Он вырабатывает андрогены , в основном дегидроэпиандростерон (ДГЭА), сульфат ДГЭА (ДГЭА-С) и андростендион (предшественник тестостерона ) у людей. [19] Его небольшие клетки образуют нерегулярные тяжи и кластеры, разделенные капиллярами и соединительной тканью. Клетки содержат относительно небольшое количество цитоплазмы и липидных капель, а иногда и коричневый пигмент липофусцин . [15]
Мозговое вещество надпочечников находится в центре каждого надпочечника и окружено корой надпочечников. Хромаффинные клетки мозгового вещества являются основным источником катехоламинов , таких как адреналин и норадреналин, выделяемых мозговым веществом. Здесь секретируется около 20% норадреналина (норэпинефрина) и 80% адреналина (эпинефрина). [19]
Мозговое вещество надпочечников управляется симпатической нервной системой через преганглионарные волокна , берущие начало в грудном отделе спинного мозга , от позвонков T5–T11. [20] Поскольку оно иннервируется преганглионарными нервными волокнами , мозговое вещество надпочечников можно рассматривать как специализированный симпатический ганглий . [20] Однако, в отличие от других симпатических ганглиев, мозговое вещество надпочечников не имеет отдельных синапсов и выделяет свои секреты непосредственно в кровь.
Надпочечники имеют один из самых высоких показателей кровоснабжения на грамм ткани любого органа: в каждую железу может входить до 60 мелких артерий . [21] Обычно каждый надпочечник снабжают три артерии: [8]
Эти кровеносные сосуды снабжают сетью мелких артерий внутри капсулы надпочечников. Тонкие нити капсулы входят в железы, неся кровь к ним. [8]
Венозная кровь отводится от желез по надпочечниковым венам , обычно по одной для каждой железы: [8]
Центральная надпочечниковая вена, в мозговом веществе надпочечника, является необычным типом кровеносного сосуда. Ее структура отличается от других вен тем, что гладкая мышца в ее tunica media (среднем слое сосуда) организована в заметные, продольно ориентированные пучки. [3]
Надпочечники могут вообще не развиться или могут быть сращены по средней линии позади аорты . [12] Это связано с другими врожденными аномалиями , такими как неспособность почек к развитию или сращенные почки. [12] Железа может развиться с частичным или полным отсутствием коркового вещества или может развиться в необычном месте. [12]

Надпочечники выделяют ряд различных гормонов, которые метаболизируются ферментами либо в железе, либо в других частях тела. Эти гормоны участвуют в ряде важных биологических функций. [23]
Кортикостероиды — это группа стероидных гормонов, вырабатываемых корой надпочечников, от которой они и получили свое название. [24]
Надпочечники вырабатывают альдостерон , минералокортикоид , который важен для регуляции солевого («минерального») баланса и объема крови . В почках альдостерон действует на дистальные извитые канальцы и собирательные трубочки , увеличивая реабсорбцию натрия и выведение как калия, так и ионов водорода. [18] Альдостерон отвечает за реабсорбцию около 2% отфильтрованного клубочкового фильтрата . [27] Задержка натрия также является реакцией дистальной части толстой кишки и потовых желез на стимуляцию рецепторов альдостерона. Ангиотензин II и внеклеточный калий являются двумя основными регуляторами выработки альдостерона. [19] Количество натрия, присутствующего в организме, влияет на внеклеточный объем, который, в свою очередь, влияет на артериальное давление . Поэтому эффекты альдостерона в задержке натрия важны для регуляции артериального давления. [28]
Кортизол является основным глюкокортикоидом у людей. У видов, которые не вырабатывают кортизол, эту роль выполняет кортикостерон . Глюкокортикоиды оказывают множество эффектов на метаболизм . Как следует из их названия, они повышают уровень циркулирующей глюкозы . Это является результатом увеличения мобилизации аминокислот из белка и стимуляции синтеза глюкозы из этих аминокислот в печени. Кроме того, они повышают уровень свободных жирных кислот , которые клетки могут использовать в качестве альтернативы глюкозе для получения энергии. Глюкокортикоиды также оказывают эффекты, не связанные с регуляцией уровня сахара в крови, включая подавление иммунной системы и мощный противовоспалительный эффект. Кортизол снижает способность остеобластов производить новую костную ткань и снижает всасывание кальция в желудочно-кишечном тракте . [28]
Надпочечники секретируют базальный уровень кортизола, но также могут производить выбросы гормона в ответ на адренокортикотропный гормон (АКТГ) из передней доли гипофиза . Кортизол не высвобождается равномерно в течение дня — его концентрация в крови самая высокая рано утром и самая низкая вечером в результате циркадного ритма секреции АКТГ. [28] Кортизон является неактивным продуктом действия фермента 11β-HSD на кортизол. Реакция, катализируемая 11β-HSD, обратима, что означает, что она может превратить введенный кортизон в кортизол, биологически активный гормон. [28]

Все кортикостероидные гормоны имеют холестерин в качестве общего предшественника. Поэтому первым шагом в стероидогенезе является поглощение или синтез холестерина. Клетки, которые производят стероидные гормоны, могут получать холестерин двумя путями. Основным источником является пищевой холестерин, транспортируемый через кровь в виде эфиров холестерина в липопротеинах низкой плотности (ЛПНП). ЛПНП поступает в клетки через рецептор-опосредованный эндоцитоз . Другим источником холестерина является синтез в эндоплазматическом ретикулуме клетки . Синтез может компенсировать, когда уровни ЛПНП аномально низкие. [4] В лизосоме эфиры холестерина преобразуются в свободный холестерин, который затем используется для стероидогенеза или хранится в клетке. [29]
Начальная часть превращения холестерина в стероидные гормоны включает ряд ферментов семейства цитохрома P450 , которые расположены во внутренней мембране митохондрий . Транспорт холестерина от внешней к внутренней мембране облегчается стероидогенным острым регуляторным белком и является этапом, ограничивающим скорость синтеза стероидов. [29]
Слои надпочечников различаются по функциям, причем каждый слой имеет различные ферменты, которые производят различные гормоны из общего предшественника. [4] Первым ферментативным шагом в производстве всех стероидных гормонов является расщепление боковой цепи холестерина, реакция, которая образует прегненолон как продукт и катализируется ферментом P450scc , также известным как холестериндесмолаза . После производства прегненолона специфические ферменты каждого коркового слоя дополнительно модифицируют его. Ферменты, участвующие в этом процессе, включают как митохондриальные, так и микросомальные P450 и гидроксистероиддегидрогеназы . Обычно для образования функциональных гормонов требуется ряд промежуточных этапов, на которых прегненолон модифицируется несколько раз. [5] Ферменты, катализирующие реакции в этих метаболических путях, участвуют в ряде эндокринных заболеваний. Например, наиболее распространенная форма врожденной гиперплазии надпочечников развивается в результате дефицита 21-гидроксилазы — фермента, участвующего в промежуточном этапе выработки кортизола. [30]
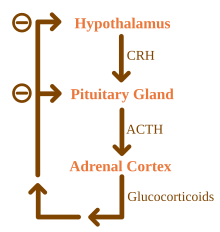
Глюкокортикоиды находятся под регулирующим влиянием оси гипоталамус-гипофиз-надпочечники (HPA) . Синтез глюкокортикоидов стимулируется адренокортикотропным гормоном (АКТГ), гормоном, выделяемым в кровоток передней долей гипофиза . В свою очередь, выработка АКТГ стимулируется наличием кортиколиберина (CRH), который выделяется нейронами гипоталамуса . АКТГ действует на клетки надпочечников сначала путем повышения уровня StAR внутри клеток, а затем всех стероидогенных ферментов P450. Ось HPA является примером системы отрицательной обратной связи , в которой сам кортизол действует как прямой ингибитор синтеза как CRH, так и АКТГ. Ось HPA также взаимодействует с иммунной системой посредством повышения секреции АКТГ в присутствии определенных молекул воспалительной реакции . [ 4]
Секреция минералокортикоидов регулируется в основном ренин-ангиотензин-альдостероновой системой (РААС), концентрацией калия и в меньшей степени концентрацией АКТГ. [4] Датчики артериального давления в юкстагломерулярном аппарате почек выделяют в кровь фермент ренин , который запускает каскад реакций, приводящих к образованию ангиотензина II . Ангиотензиновые рецепторы в клетках клубочковой зоны распознают это вещество, и при связывании стимулируют высвобождение альдостерона . [31]
Клетки в сетчатой зоне надпочечников вырабатывают мужские половые гормоны, или андрогены , наиболее важным из которых является ДГЭА . В целом, эти гормоны не оказывают общего эффекта на мужской организм и преобразуются в более мощные андрогены, такие как тестостерон и ДГТ , или в эстрогены (женские половые гормоны) в гонадах , действуя таким образом как метаболический промежуточный продукт . [32]
В Соединенных Штатах их в первую очередь называют эпинефрином и норадреналином , адреналин и норадреналин являются катехоламинами , водорастворимыми соединениями , имеющими структуру, состоящую из катехольной группы и аминогруппы . Надпочечники отвечают за большую часть адреналина, циркулирующего в организме, но только за небольшое количество циркулирующего норадреналина. [23] Эти гормоны выделяются мозговым веществом надпочечников, которое содержит густую сеть кровеносных сосудов. Адреналин и норадреналин действуют, взаимодействуя с адренорецепторами по всему телу, с эффектами, которые включают повышение артериального давления и частоты сердечных сокращений. [23] Действия адреналина и норадреналина отвечают за реакцию «бей или беги» , характеризующуюся учащением дыхания и частоты сердечных сокращений, повышением артериального давления и сужением кровеносных сосудов во многих частях тела. [33]
Катехоламины вырабатываются в хромаффинных клетках мозгового слоя надпочечников из тирозина , заменимой аминокислоты, получаемой из пищи или вырабатываемой из фенилаланина в печени. Фермент тирозингидроксилаза преобразует тирозин в L-ДОФА на первом этапе синтеза катехоламинов. Затем L-ДОФА преобразуется в дофамин , прежде чем он может быть превращен в норадреналин. В цитозоле норадреналин преобразуется в адреналин ферментом фенилэтаноламин N-метилтрансферазой (PNMT) и хранится в гранулах. Глюкокортикоиды, вырабатываемые в коре надпочечников, стимулируют синтез катехоламинов, повышая уровни тирозингидроксилазы и PNMT. [4] [13]
Выделение катехоламинов стимулируется активацией симпатической нервной системы . Спланхнические нервы симпатической нервной системы иннервируют мозговое вещество надпочечников. При активации они вызывают высвобождение катехоламинов из гранул хранения, стимулируя открытие кальциевых каналов в клеточной мембране. [34]
Геном человека включает приблизительно 20 000 генов, кодирующих белки, и 70% этих генов экспрессируются в нормальных взрослых надпочечниках. [35] [36] Только около 250 генов более специфично экспрессируются в надпочечниках по сравнению с другими органами и тканями. Гены, специфичные для надпочечников, с самым высоким уровнем экспрессии включают членов суперсемейства ферментов цитохрома P450 . Соответствующие белки экспрессируются в различных отделах надпочечника, например, CYP11A1 , HSD3B2 и FDX1, участвующие в синтезе стероидных гормонов и экспрессирующиеся в слоях корковых клеток, а также PNMT и DBH, участвующие в синтезе норадреналина и адреналина и экспрессирующиеся в мозговом веществе. [37]
Надпочечники состоят из двух гетерогенных типов ткани. В центре находится мозговое вещество надпочечника , которое вырабатывает адреналин и норадреналин и выделяет их в кровоток, как часть симпатической нервной системы . Вокруг мозгового вещества находится кора , которая вырабатывает различные стероидные гормоны . Эти ткани происходят из разных эмбриональных предшественников и имеют различные пути пренатального развития . Кора надпочечника происходит из мезодермы , тогда как мозговое вещество происходит из нервного гребня , который имеет эктодермальное происхождение. [12]
Надпочечники у новорожденного ребенка намного больше по отношению к размеру тела, чем у взрослого. [38] Например, в возрасте трех месяцев железы в четыре раза больше почек. Размер желез относительно уменьшается после рождения, в основном из-за усадки коркового вещества. Корковое вещество, которое почти полностью исчезает к возрасту 1 года, снова развивается с 4–5 лет. Железы весят около1 грамм при рождении [12] и достигают веса взрослого человека около4 грамма каждая. [28] У плода железы впервые обнаруживаются после шестой недели развития. [12]
Ткань коры надпочечников происходит из промежуточной мезодермы . Она впервые появляется через 33 дня после оплодотворения , демонстрирует способность вырабатывать стероидные гормоны к восьмой неделе и быстро растет в течение первого триместра беременности. Кора надпочечников плода отличается от своей взрослой аналогии, поскольку состоит из двух отдельных зон: внутренней «фетальной» зоны, которая несет большую часть гормонопродуцирующей активности, и внешней «окончательной» зоны, которая находится в пролиферативной фазе. Фетальная зона вырабатывает большое количество надпочечниковых андрогенов (мужских половых гормонов), которые используются плацентой для биосинтеза эстрогенов . [39] Развитие коры надпочечников регулируется в основном АКТГ , гормоном, вырабатываемым гипофизом , который стимулирует синтез кортизола . [40] В середине беременности фетальная зона занимает большую часть коркового объема и производит 100–200 мг/день ДГЭА-С , андрогена и предшественника как андрогенов, так и эстрогенов (женских половых гормонов). [41] Гормоны надпочечников, особенно глюкокортикоиды , такие как кортизол, необходимы для пренатального развития органов, в частности для созревания легких . Надпочечник уменьшается в размерах после рождения из-за быстрого исчезновения фетальной зоны с соответствующим снижением секреции андрогенов. [39]
В раннем детстве синтез и секреция андрогенов остаются низкими, но за несколько лет до полового созревания (с 6–8 лет) происходят изменения как в анатомических, так и в функциональных аспектах продукции корковых андрогенов, что приводит к увеличению секреции стероидов ДГЭА и ДГЭА-С . Эти изменения являются частью процесса, называемого адренархе , который был описан только у людей и некоторых других приматов. Адренархе не зависит от АКТГ или гонадотропинов и коррелирует с прогрессирующим утолщением слоя сетчатой зоны коры. Функционально адренархе обеспечивает источник андрогенов для развития подмышечных и лобковых волос до начала полового созревания. [42] [43]
Мозговое вещество надпочечников происходит из клеток нервного гребня , которые происходят из слоя эктодермы эмбриона . Эти клетки мигрируют из своего первоначального положения и агрегируют в непосредственной близости от дорсальной аорты , примитивного кровеносного сосуда, который активирует дифференциацию этих клеток посредством высвобождения белков, известных как BMP . Затем эти клетки подвергаются второй миграции из дорсальной аорты, чтобы сформировать мозговое вещество надпочечников и другие органы симпатической нервной системы . [44] Клетки мозгового вещества надпочечников называются хромаффинными клетками , потому что они содержат гранулы, которые окрашиваются солями хрома , что характерно не для всех симпатических органов. Когда-то считалось, что глюкокортикоиды, вырабатываемые в коре надпочечников, отвечают за дифференциацию хромаффинных клеток. Более поздние исследования показывают, что BMP-4, секретируемый в ткани надпочечников, является основным ответственным за это, и что глюкокортикоиды играют роль только в последующем развитии клеток. [45]
Нормальная функция надпочечников может быть нарушена такими состояниями, как инфекции, опухоли, генетические нарушения и аутоиммунные заболевания , или как побочный эффект медицинской терапии. Эти нарушения влияют на железу либо напрямую (как при инфекциях или аутоиммунных заболеваниях), либо в результате нарушения регуляции выработки гормонов (как при некоторых типах синдрома Кушинга ), что приводит к избытку или недостаточности гормонов надпочечников и связанным с этим симптомам.
Синдром Кушинга является проявлением избытка глюкокортикоидов. Он может быть результатом длительного лечения глюкокортикоидами или быть вызванным основным заболеванием, которое вызывает изменения в оси HPA или выработке кортизола. Причины можно далее классифицировать на АКТГ -зависимые или АКТГ-независимые. Наиболее распространенной причиной эндогенного синдрома Кушинга является аденома гипофиза , которая вызывает избыточную выработку АКТГ. Заболевание вызывает широкий спектр признаков и симптомов, которые включают ожирение, диабет, повышенное кровяное давление, чрезмерное оволосение тела ( гирсутизм ), остеопороз , депрессию и, что наиболее характерно, растяжки на коже, вызванные ее прогрессирующим истончением. [4] [6]
Когда zona glomerulosa производит избыточный альдостерон , результатом является первичный альдостеронизм . Причинами этого состояния являются двусторонняя гиперплазия (чрезмерный рост ткани) желез или аденомы , продуцирующие альдостерон (состояние, называемое синдромом Конна ). Первичный альдостеронизм вызывает гипертонию и электролитный дисбаланс, увеличивая истощение калия и задержку натрия. [6]
Недостаточность надпочечников (дефицит глюкокортикоидов ) встречается примерно у 5 из 10 000 человек в общей популяции. [6] Заболевания, классифицируемые как первичная недостаточность надпочечников (включая болезнь Аддисона и генетические причины), напрямую влияют на кору надпочечников. Если проблема, которая влияет на гипоталамо-гипофизарно-надпочечниковую ось, возникает вне железы, это вторичная недостаточность надпочечников .

Болезнь Аддисона относится к первичному гипоадренализму, который представляет собой дефицит глюкокортикоидов и минералокортикоидов, вырабатываемых надпочечниками. В западном мире болезнь Аддисона чаще всего является аутоиммунным заболеванием, при котором организм вырабатывает антитела против клеток коры надпочечников. Во всем мире заболевание чаще всего вызывается инфекцией, особенно туберкулезом . Отличительной чертой болезни Аддисона является гиперпигментация кожи, которая сопровождается другими неспецифическими симптомами, такими как усталость. [4]
Осложнением, наблюдаемым при нелеченой болезни Аддисона и других типах первичной надпочечниковой недостаточности, является надпочечниковый криз , неотложная медицинская ситуация, при которой низкие уровни глюкокортикоидов и минералокортикоидов приводят к гиповолемическому шоку и таким симптомам, как рвота и лихорадка. Надпочечниковый криз может постепенно привести к ступору и коме . [4] Лечение надпочечниковых кризов включает применение инъекций гидрокортизона . [46]
При вторичной надпочечниковой недостаточности дисфункция гипоталамо -гипофизарно-надпочечниковой оси приводит к снижению стимуляции коры надпочечников. Помимо подавления оси глюкокортикоидной терапией, наиболее частой причиной вторичной надпочечниковой недостаточности являются опухоли, которые влияют на выработку адренокортикотропного гормона (АКТГ) гипофизом . [ 6] Этот тип надпочечниковой недостаточности обычно не влияет на выработку минералокортикоидов , которые вместо этого регулируются ренин-ангиотензиновой системой . [4]
Врожденная гиперплазия надпочечников — это семейство врожденных заболеваний , при которых мутации ферментов, которые вырабатывают стероидные гормоны, приводят к дефициту глюкокортикоидов и нарушению работы отрицательной обратной связи оси HPA . В оси HPA кортизол (глюкокортикоид) подавляет высвобождение CRH и ACTH , гормонов, которые, в свою очередь, стимулируют синтез кортикостероидов. Поскольку кортизол не может быть синтезирован, эти гормоны выделяются в больших количествах и стимулируют выработку других стероидов надпочечников вместо этого. Наиболее распространенная форма врожденной гиперплазии надпочечников обусловлена дефицитом 21-гидроксилазы . 21-гидроксилаза необходима для выработки как минералокортикоидов, так и глюкокортикоидов, но не андрогенов . Таким образом, стимуляция коры надпочечников АКТГ вызывает высвобождение избыточного количества андрогенов надпочечников , что может привести к развитию неоднозначных гениталий и вторичных половых признаков . [30]

Опухоли надпочечников обычно обнаруживаются как инциденталомы , неожиданные бессимптомные опухоли, обнаруженные во время медицинской визуализации . Они видны примерно в 3,4% КТ-сканирований , [7] и в большинстве случаев это доброкачественные аденомы . [48] Карциномы надпочечников встречаются очень редко, с частотой 1 случай на миллион в год. [4]
Феохромоцитомы — это опухоли мозгового вещества надпочечников, которые возникают из хромаффинных клеток . Они могут вызывать различные неспецифические симптомы, включая головные боли, потливость, беспокойство и сердцебиение . Общие признаки включают гипертонию и тахикардию . Хирургия, особенно лапароскопия надпочечников , является наиболее распространенным методом лечения небольших феохромоцитом. [49]
Бартоломео Эустаки , итальянский анатом, считается автором первого описания надпочечников в 1563–1564 годах. [50] [51] [52] Однако эти публикации были частью папской библиотеки и не получили общественного внимания, которое впервые было получено благодаря иллюстрациям Каспара Бартолина Старшего в 1611 году. [51]
Надпочечники названы по их расположению относительно почек. Термин «надпочечник» происходит от латинского ad , «рядом», и ren , «почка». [53] Аналогично, «надпочечник», как его назвал Жан Риолан Младший в 1629 году, происходит от латинского supra , «выше», и ren , «почка». Надпочечниковая природа желез не была по-настоящему принята до 19 века, поскольку анатомы прояснили беспротоковую природу желез и их вероятную секреторную роль — до этого были некоторые споры о том, были ли железы действительно надпочечниками или частью почки. [51]
Одна из самых известных работ о надпочечниках вышла в 1855 году с публикацией книги « О конституционных и местных эффектах заболевания надпочечниковой капсулы » английского врача Томаса Аддисона . В своей монографии Аддисон описал то, что французский врач Жорж Труссо позже назовет болезнью Аддисона , эпоним, который до сих пор используется для обозначения состояния надпочечниковой недостаточности и связанных с ней клинических проявлений. [54] В 1894 году английские физиологи Джордж Оливер и Эдвард Шефер изучали действие экстрактов надпочечников и наблюдали их прессорные эффекты. В последующие десятилетия несколько врачей экспериментировали с экстрактами из коры надпочечников для лечения болезни Аддисона. [50] Эдвард Кальвин Кендалл , Филипп Хенч и Тадеуш Рейхштейн были затем удостоены Нобелевской премии по физиологии и медицине 1950 года за свои открытия в области структуры и эффектов гормонов надпочечников. [55]
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )