
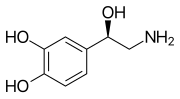
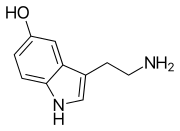
Моноаминные нейротрансмиттеры — это нейротрансмиттеры и нейромодуляторы , которые содержат одну аминогруппу , связанную с ароматическим кольцом двухуглеродной цепью (например, -CH 2 -CH 2 -). Примерами являются дофамин , норадреналин и серотонин .
Все моноамины образуются из ароматических аминокислот, таких как фенилаланин , тирозин и триптофан, под действием ферментов декарбоксилазы ароматических аминокислот . Они дезактивируются в организме ферментами, известными как моноаминоксидазы , которые отсекают аминогруппу.
Моноаминергические системы, то есть сети нейронов, которые используют моноаминовые нейротрансмиттеры, участвуют в регуляции таких процессов, как эмоции, возбуждение и определенные типы памяти. Также было обнаружено, что моноаминовые нейротрансмиттеры играют важную роль в секреции и выработке нейротрофина -3 астроцитами, химического вещества, которое поддерживает целостность нейронов и обеспечивает нейронам трофическую поддержку. [1]
Препараты, используемые для усиления или ослабления действия моноаминовых нейротрансмиттеров, используются для лечения пациентов с психиатрическими и неврологическими расстройствами, включая депрессию , тревожность , шизофрению и болезнь Паркинсона . [2]
Существуют специфические транспортные белки, называемые транспортерами моноаминов , которые транспортируют моноамины в клетку или из нее. Это транспортер дофамина (DAT), транспортер серотонина (SERT) и транспортер норадреналина (NET) во внешней клеточной мембране и везикулярный транспортер моноаминов ( VMAT1 и VMAT2 ) в мембране внутриклеточных везикул . [ необходима цитата ]
После высвобождения в синаптическую щель действие нейротрансмиттера моноамина заканчивается обратным захватом в пресинаптическое окончание. Там они могут быть переупакованы в синаптические пузырьки или деградированы ферментом моноаминоксидазой ( МАО), которая является целью ингибиторов моноаминоксидазы , класса антидепрессантов . [ необходима цитата ]

Моноаминовые нейротрансмиттерные системы встречаются практически у всех позвоночных, причем способность этих систем к развитию способствовала повышению приспособляемости видов позвоночных к различным условиям окружающей среды. [12] [13]
Недавнее вычислительное исследование генетических истоков показывает, что самое раннее развитие моноаминов произошло 650 миллионов лет назад и что появление этих химических веществ, необходимых для активного или интерактивного осознания и взаимодействия с окружающей средой, совпадает с возникновением билатерального или «зеркального» тела в разгар (или, возможно, в каком-то смысле, каталитического?) кембрийского взрыва. [14]
которого регулируется содержание гистамина в мозге, остается неясным. У млекопитающих везикулярные переносчики моноаминов (ВМАТ) экспрессируются исключительно в нейронах и обеспечивают хранение гистамина и других моноаминов.
Следовые амины метаболизируются в организме млекопитающих с помощью моноаминоксидазы (МАО; EC 1.4.3.4) (Berry, 2004) (рис. 2) ... Он дезаминирует первичные и вторичные амины, которые свободны в цитоплазме нейронов, но не те, которые связаны в пузырьках хранения симпатического нейрона ... Аналогично, β-PEA не будет дезаминироваться в кишечнике, поскольку он является селективным субстратом для МАО-B, который не обнаруживается в кишечнике ...
Уровни эндогенных следовых аминов в мозге в несколько сотен раз ниже, чем для классических нейротрансмиттеров норадреналина, дофамина и серотонина, но их скорости синтеза эквивалентны таковым для норадреналина и дофамина, и они имеют очень высокую скорость оборота (Berry, 2004). Уровни эндогенных внеклеточных тканей следовых аминов, измеренные в мозге, находятся в низком наномолярном диапазоне. Такие низкие концентрации возникают из-за их очень короткого периода полураспада...
В дополнение к основному метаболическому пути, ТА также могут быть преобразованы неспецифической N-метилтрансферазой (NMT) [22] и фенилэтаноламин N-метилтрансферазой (PNMT) [23] в соответствующие вторичные амины (например, синефрин [14], N-метилфенилэтиламин и N-метилтирамин [15]), которые проявляют схожую активность на TAAR1 (TA1) в качестве своих первичных аминных предшественников... Как дофамин, так и 3-метокситирамин, которые не подвергаются дальнейшему N-метилированию, являются частичными агонистами TAAR1 (TA1). ...
Нарушение регуляции уровней ТА было связано с несколькими заболеваниями, что выделяет соответствующих членов семейства TAAR в качестве потенциальных целей для разработки лекарств. В этой статье мы сосредоточимся на значимости ТА и их рецепторов для расстройств, связанных с нервной системой, а именно шизофрении и депрессии; Однако ТА также связаны с другими заболеваниями, такими как мигрень, синдром дефицита внимания и гиперактивности, злоупотребление психоактивными веществами и расстройства пищевого поведения [7,8,36]. Клинические исследования сообщают о повышенных уровнях β-ПЭА в плазме у пациентов, страдающих острой шизофренией [37] и повышенном выделении β-ПЭА с мочой у параноидальных шизофреников [38], что подтверждает роль ТА в шизофрении. В результате этих исследований β-ПЭА был назван «эндогенным амфетамином» организма [39]
Эта «эволюционируемость» дофаминовых систем сыграла важную роль в адаптации видов позвоночных практически ко всем возможным средам.
Эти данные предполагают, что для разработки новых катехоламиновых психомоторных адаптивных реакций потребовалась дупликация гена рецептора D1/beta и что норадренергическая система возникла в начале эволюции позвоночных.