Дофамин ( DA , сокращение 3,4- дигидроксифенэтиламина ) представляет собой нейромодулирующую молекулу , которая играет несколько важных ролей в клетках . Это органическое химическое вещество семейств катехоламинов и фенэтиламинов . Дофамин составляет около 80% содержания катехоламинов в мозге. Это амин , синтезируемый путем удаления карбоксильной группы из молекулы его химического предшественника L -ДОФА , который синтезируется в мозге и почках. Дофамин также синтезируется в растениях и большинстве животных. В мозге дофамин действует как нейротрансмиттер — химическое вещество, выделяемое нейронами (нервными клетками) для отправки сигналов другим нервным клеткам. Нейротрансмиттеры синтезируются в определенных областях мозга, но системно влияют на многие регионы. Мозг включает в себя несколько различных путей дофамина , один из которых играет важную роль в мотивационном компоненте поведения, мотивированного вознаграждением . Ожидание большинства видов вознаграждений повышает уровень дофамина в мозге [4] , а многие наркотики, вызывающие привыкание , увеличивают высвобождение дофамина или блокируют его обратный захват в нейроны после высвобождения. [5] Другие пути дофамина в мозге участвуют в контроле моторики и контроле высвобождения различных гормонов. Эти пути и группы клеток образуют дофаминовую систему, которая является нейромодулирующей . [5]
В популярной культуре и средствах массовой информации дофамин часто изображается как основной химикат удовольствия, но в настоящее время в фармакологии существует мнение, что вместо этого дофамин придает мотивационную значимость ; [6] [7] [8] другими словами, дофамин сигнализирует о воспринимаемой мотивационной значимости (т. е. желательности или неприятия) результата, который, в свою очередь, подталкивает поведение организма к достижению этого результата или от него. [8] [9] Именно эндоканнабиноид , 2 -арахидоноилглицерин (2-AG: C 23 H 38 O 4 ; 20: 4 , ω-6 ), формирует аккумбальное кодирование сигнал - мотивированного поведения посредством активации рецептора CB1 в вентральной части тела . tegmentum и тем самым модулирует вызванные сигналом переходные процессы дофамина во время преследования вознаграждения . [ нужны разъяснения ] [10]
За пределами центральной нервной системы дофамин действует главным образом как местный паракринный мессенджер. В кровеносных сосудах он ингибирует высвобождение норадреналина и действует как сосудорасширяющее средство ; в почках увеличивает экскрецию натрия и диурез; в поджелудочной железе снижает выработку инсулина; в пищеварительной системе снижает перистальтику желудочно-кишечного тракта и защищает слизистую оболочку кишечника ; а в иммунной системе снижает активность лимфоцитов . За исключением кровеносных сосудов, дофамин в каждой из этих периферических систем синтезируется локально и оказывает свое действие вблизи клеток, которые его выделяют.
Некоторые важные заболевания нервной системы связаны с дисфункциями дофаминовой системы, и некоторые из ключевых лекарств, используемых для их лечения, действуют путем изменения эффектов дофамина. Болезнь Паркинсона , дегенеративное состояние, вызывающее тремор и двигательные нарушения, вызвана потерей секретирующих дофамин нейронов в области среднего мозга , называемой черной субстанцией . Его метаболический предшественник L-DOPA может быть произведен; Леводопа , чистая форма L-ДОФА, является наиболее широко используемым средством лечения болезни Паркинсона. Есть доказательства того, что шизофрения связана с изменением уровня активности дофамина, и большинство антипсихотических препаратов , используемых для лечения этого заболевания, представляют собой антагонисты дофамина , которые снижают активность дофамина. [11] Подобные препараты-антагонисты дофамина также являются одними из наиболее эффективных средств против тошноты . Синдром беспокойных ног и синдром дефицита внимания с гиперактивностью (СДВГ) связаны со снижением активности дофамина. [12] Дофаминергические стимуляторы могут вызывать привыкание в высоких дозах, но некоторые из них используются в более низких дозах для лечения СДВГ. Сам дофамин доступен в виде готового лекарства для внутривенных инъекций . Он полезен при лечении тяжелой сердечной недостаточности или кардиогенного шока . [13] У новорожденных детей его можно применять при гипотонии и септическом шоке . [14]
Молекула дофамина состоит из катехиновой структуры ( бензольное кольцо с двумя боковыми гидроксильными группами) с одной аминогруппой , присоединенной через этильную цепь. [15] Таким образом, дофамин является простейшим катехоламином , семейством, которое также включает нейротрансмиттеры норадреналин и адреналин . [16] Наличие бензольного кольца с этим аминным присоединением делает его замещенным фенэтиламином , семейством, которое включает многочисленные психоактивные препараты . [17]
Как и большинство аминов, дофамин представляет собой органическое основание . [18] Как основание , он обычно протонируется в кислой среде (в кислотно-основной реакции ). [18] Протонированная форма хорошо растворима в воде и относительно стабильна, но может окисляться при воздействии кислорода или других окислителей . [18] В основных средах дофамин не протонируется. [18] В этой форме свободного основания оно менее водорастворимо, а также более реакционноспособно. [18] Из-за повышенной стабильности и водорастворимости протонированной формы дофамин поставляется для химического или фармацевтического использования в виде гидрохлорида дофамина , то есть гидрохлоридной соли , которая образуется при соединении дофамина с соляной кислотой . [18] В сухом виде гидрохлорид дофамина представляет собой мелкий порошок от белого до желтого цвета. [19]
Дофамин синтезируется в ограниченном наборе типов клеток, главным образом в нейронах и клетках мозгового вещества надпочечников . [23] Первичными и второстепенными путями метаболизма являются соответственно:
Прямой предшественник дофамина, L -ДОФА , может быть синтезирован опосредованно из незаменимой аминокислоты фенилаланина или непосредственно из заменимой аминокислоты тирозина . [26] Эти аминокислоты содержатся почти в каждом белке и поэтому легко доступны в пище, наиболее распространенным из которых является тирозин. Хотя дофамин также содержится во многих видах пищи, он не способен преодолевать гематоэнцефалический барьер , который окружает и защищает мозг. [27] Поэтому он должен синтезироваться внутри мозга для выполнения своей нейрональной активности . [27]
L -Фенилаланин превращается в L -тирозин под действием фермента фенилаланингидроксилазы с молекулярным кислородом (O 2 ) и тетрагидробиоптерином в качестве кофакторов . L -тирозин превращается в L -ДОФА ферментом тирозингидроксилазой с тетрагидробиоптерином, O 2 и железом (Fe 2+ ) в качестве кофакторов. [26] L -ДОФА преобразуется в дофамин с помощью фермента декарбоксилазы ароматических L -аминокислот (также известного как декарбоксилаза ДОФА) с пиридоксальфосфатом в качестве кофактора. [26]
Сам дофамин используется в качестве предшественника в синтезе нейротрансмиттеров норадреналина и адреналина. [26] Дофамин преобразуется в норадреналин под действием фермента дофамин-β-гидроксилазы с участием O 2 и L -аскорбиновой кислоты в качестве кофакторов. [26] Норадреналин превращается в адреналин под действием фермента фенилэтаноламин -N -метилтрансферазы с S -аденозил- L -метионином в качестве кофактора. [26]
Некоторые из кофакторов также требуют собственного синтеза. [26] Дефицит любой необходимой аминокислоты или кофактора может нарушить синтез дофамина, норадреналина и адреналина. [26]
Дофамин расщепляется на неактивные метаболиты под действием ряда ферментов — моноаминоксидазы (МАО), катехол- О -метилтрансферазы (КОМТ) и альдегиддегидрогеназы (АЛДГ), действующих последовательно. [28] Обе изоформы моноаминоксидазы, МАО-А и МАО-В , эффективно метаболизируют дофамин. [26] Существуют различные пути распада, но основным конечным продуктом является гомованилиновая кислота (ГВА), биологическая активность которой неизвестна. [28] Из кровотока гомованилиновая кислота фильтруется почками, а затем выводится с мочой. [28] Двумя основными метаболическими путями, которые превращают дофамин в ГВА, являются: [29]
В клинических исследованиях шизофрении измерения гомованилиновой кислоты в плазме использовались для оценки уровня активности дофамина в мозге. Однако сложность этого подхода заключается в выделении высокого уровня гомованилиновой кислоты в плазме, обусловленного метаболизмом норадреналина. [30] [31]
Хотя дофамин обычно расщепляется ферментом оксидоредуктазой , он также подвержен окислению в результате прямой реакции с кислородом, в результате чего в качестве продуктов образуются хиноны и различные свободные радикалы . [32] Скорость окисления может быть увеличена за счет присутствия трехвалентного железа или других факторов. Хиноны и свободные радикалы, образующиеся в результате автоокисления дофамина, могут отравлять клетки , и есть доказательства того, что этот механизм может способствовать потере клеток, которая происходит при болезни Паркинсона и других состояниях. [33]
Дофамин оказывает свое действие путем связывания и активации рецепторов клеточной поверхности . [23] У людей дофамин обладает высокой аффинностью связывания с дофаминовыми рецепторами и рецептором 1, связанным с следами аминов человека (hTAAR1). [3] [34] У млекопитающих были идентифицированы пять подтипов дофаминовых рецепторов , обозначенных от D 1 до D 5 . [23] Все они функционируют как метаботропные рецепторы , связанные с G-белком , что означает, что они оказывают свое воздействие через сложную систему вторичных мессенджеров . [35] Эти рецепторы можно разделить на два семейства, известные как D 1 -подобные и D 2 -подобные . [23] Для рецепторов, расположенных на нейронах нервной системы, конечным эффектом D1 - подобной активации (D1 и D5 ) может быть возбуждение (через открытие натриевых каналов ) или торможение (через открытие калиевых каналов ); Конечным эффектом D2 - подобной активации (D2 , D3 и D4 ) обычно является торможение нейрона-мишени. [35] Следовательно, неверно описывать сам дофамин как возбуждающий или тормозящий: его влияние на нейрон-мишень зависит от того, какие типы рецепторов присутствуют на мембране этого нейрона, а также от внутренних реакций этого нейрона на вторичный мессенджер. цАМП . [35] Рецепторы D 1 являются наиболее многочисленными дофаминовыми рецепторами в нервной системе человека; Следующими идут D2 - рецепторы; Рецепторы D3 , D4 и D5 присутствуют на значительно более низких уровнях . [35]
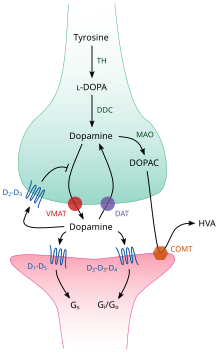
Внутри мозга дофамин действует как нейромедиатор и нейромодулятор и контролируется набором механизмов, общих для всех моноаминовых нейротрансмиттеров . [23] После синтеза дофамин транспортируется из цитозоля в синаптические пузырьки растворенным переносчиком — везикулярным переносчиком моноаминов , VMAT2 . [36] Дофамин хранится в этих пузырьках до тех пор, пока не будет выброшен в синаптическую щель . В большинстве случаев высвобождение дофамина происходит посредством процесса, называемого экзоцитозом , который вызывается потенциалами действия , но это также может быть вызвано активностью внутриклеточного рецептора, связанного с следами аминов , TAAR1 . [34] TAAR1 представляет собой рецептор с высоким сродством к дофамину, следовым аминам и некоторым замещенным амфетаминам , который расположен вдоль мембран во внутриклеточной среде пресинаптической клетки; [34] активация рецептора может регулировать передачу сигналов дофамина, вызывая ингибирование обратного захвата и оттока дофамина , а также ингибируя возбуждение нейронов посредством разнообразного набора механизмов. [34] [37]
Попадая в синапс, дофамин связывается с дофаминовыми рецепторами и активирует их. [38] Это могут быть постсинаптические рецепторы дофамина, которые расположены на дендритах (постсинаптический нейрон), или пресинаптические ауторецепторы (например, D 2 sh и пресинаптические рецепторы D 3 ), которые расположены на мембране окончания аксона ( пресинаптический нейрон). [23] [38] После того как постсинаптический нейрон вызывает потенциал действия, молекулы дофамина быстро отрываются от своих рецепторов. Затем они всасываются обратно в пресинаптическую клетку путем обратного захвата , опосредованного либо переносчиком дофамина , либо переносчиком моноаминов плазматической мембраны . [39] Вернувшись в цитозоль, дофамин может либо расщепляться моноаминоксидазой , либо переупаковываться в везикулы с помощью VMAT2, что делает его доступным для будущего высвобождения. [36]
В мозге уровень внеклеточного дофамина модулируется двумя механизмами: фазической и тонической передачей . [40] Фазическое высвобождение дофамина, как и высвобождение большинства нейромедиаторов в нервной системе, напрямую обусловлено потенциалами действия в дофаминсодержащих клетках. [40] Тоническая передача дофамина происходит, когда небольшие количества дофамина высвобождаются без предшествующих пресинаптических потенциалов действия. [40] Тоническая передача регулируется множеством факторов, включая активность других нейронов и обратный захват нейромедиаторов. [40]

Внутри мозга дофамин играет важную роль в исполнительных функциях , контроле моторики , мотивации , возбуждении , подкреплении и вознаграждении , а также в функциях более низкого уровня, включая лактацию , сексуальное удовлетворение и тошноту . Группы и пути дофаминергических клеток составляют дофаминовую систему, которая является нейромодулирующей .
Дофаминергические нейроны (нервные клетки, продуцирующие дофамин) сравнительно немногочисленны — всего около 400 000 в человеческом мозге [41] — и их клеточные тела сосредоточены группами в нескольких относительно небольших областях мозга. [42] Однако их аксоны проецируются во многие другие области мозга и оказывают мощное воздействие на свои цели. [42] Эти группы дофаминергических клеток были впервые картированы в 1964 году Анникой Дальстрем и Кьеллом Фуксе, которые присвоили им метки, начинающиеся с буквы «А» (что означает «аминергические»). [43] На их схеме области от А1 до А7 содержат нейромедиатор норадреналин, тогда как от А8 до А14 содержат дофамин. Они определили дофаминергические области: черную субстанцию (группы 8 и 9); вентральная покрышка (группа 10); задний гипоталамус (группа 11); дугообразное ядро (группа 12); неясная зона ( группа 13) и перивентрикулярное ядро (группа 14). [43]
Черная субстанция — небольшая область среднего мозга, которая является компонентом базальных ганглиев . Он состоит из двух частей — входной области, называемой pars Compacta , и выходной области, pars reticulata . Дофаминергические нейроны обнаруживаются преимущественно в компактной части (группа клеток А8) и поблизости (группа А9). [42] У людей проекция дофаминергических нейронов из компактной части черной субстанции в дорсальное полосатое тело, называемая нигростриарным путем , играет значительную роль в контроле двигательной функции и в обучении новым двигательным навыкам . [44] Эти нейроны особенно уязвимы к повреждениям, и когда большое их количество погибает, возникает паркинсонический синдром . [45]
Вентральная покрышка (ВТА) — еще одна область среднего мозга. Наиболее известная группа дофаминергических нейронов VTA проецируется в префронтальную кору по мезокортикальному пути, а другая, меньшая группа, проецируется в прилежащее ядро по мезолимбическому пути . Вместе эти два пути называются мезокортиколимбической проекцией . [42] [44] ВТА также посылает дофаминергические проекции в миндалевидное тело , поясную извилину , гиппокамп и обонятельную луковицу . [42] [44] Мезокортиколимбические нейроны играют центральную роль в вознаграждении и других аспектах мотивации. [44] Накопление литературы показывает, что дофамин также играет решающую роль в аверсивном обучении, воздействуя на ряд областей мозга. [46] [47] [48]
В заднем гипоталамусе есть дофаминовые нейроны, которые передаются в спинной мозг, но их функция недостаточно изучена. [49] Есть некоторые свидетельства того, что патология в этой области играет роль в синдроме беспокойных ног — состоянии, при котором люди испытывают трудности со сном из-за непреодолимой навязчивой потребности постоянно двигать частями тела, особенно ногами. [49]
В дугообразном ядре и перивентрикулярном ядре гипоталамуса имеются дофаминовые нейроны, образующие важную проекцию — тубероинфундибулярный путь , идущий к гипофизу , где он влияет на секрецию гормона пролактина . [50] Дофамин является основным нейроэндокринным ингибитором секреции пролактина передней долей гипофиза . [50] Дофамин, вырабатываемый нейронами дугообразного ядра, секретируется в гипофизарную портальную систему срединного возвышения , которая снабжает гипофиз . [50] Пролактиновые клетки , которые производят пролактин, в отсутствие дофамина постоянно секретируют пролактин; дофамин подавляет эту секрецию. [50] В контексте регуляции секреции пролактина дофамин иногда называют фактором, ингибирующим пролактин, гормоном, ингибирующим пролактин, или пролактостатином. [50]
Неопределенная зона, сгруппированная между дугообразными и перивентрикулярными ядрами, проецируется на несколько областей гипоталамуса и участвует в контроле высвобождения гонадотропин-рилизинг-гормона , который необходим для активации развития мужской и женской репродуктивной системы после полового созревания. [50]
Дополнительная группа нейронов, секретирующих дофамин, обнаружена в сетчатке глаза. [51] Эти нейроны являются амакриновыми клетками , что означает, что у них нет аксонов. [51] Они выделяют дофамин во внеклеточную среду и особенно активны в дневное время, замолкая ночью. [51] Этот ретинальный дофамин усиливает активность колбочек в сетчатке, одновременно подавляя палочки . Результатом является повышение чувствительности к цвету и контрастности в условиях яркого освещения за счет снижения чувствительности при тусклом свете. [51]

Крупнейшими и наиболее важными источниками дофамина в мозге позвоночных являются черная субстанция и вентральная область покрышки. [42] Обе структуры являются компонентами среднего мозга, тесно связанными друг с другом и во многом функционально схожими. [42] Самый крупный компонент базальных ганглиев — полосатое тело. [52] Черная субстанция посылает дофаминергические проекции в дорсальное полосатое тело , тогда как вентральная покрышка посылает дофаминергические проекции аналогичного типа в вентральное полосатое тело . [42]
Прогресс в понимании функций базальных ганглиев был медленным. [52] Наиболее популярные гипотезы в широком смысле предполагают, что базальные ганглии играют центральную роль в выборе действия . [53] Теория выбора действия в своей простейшей форме предполагает, что, когда человек или животное находится в ситуации, когда возможны несколько вариантов поведения, активность базальных ганглиев определяет, какое из них будет выполнено, освобождая эту реакцию от торможения, продолжая при этом торможение. другие двигательные системы, которые, если их активировать, будут вызывать конкурирующее поведение. [54] Таким образом, согласно этой концепции, базальные ганглии отвечают за инициирование поведения, но не за определение деталей того, как оно осуществляется. Другими словами, они по сути образуют систему принятия решений. [54]
Базальные ганглии можно разделить на несколько секторов, каждый из которых участвует в управлении определенными типами действий. [55] Вентральный сектор базальных ганглиев (содержащий вентральное полосатое тело и вентральную покрышку) действует на самом высоком уровне иерархии, выбирая действия на уровне всего организма. [54] Дорсальные сектора (содержащие дорсальное полосатое тело и черную субстанцию) действуют на более низких уровнях, выбирая конкретные мышцы и движения, которые используются для реализации заданной модели поведения. [55]
Дофамин участвует в процессе выбора действия по крайней мере двумя важными способами. Во-первых, он устанавливает «порог» начала действий. [53] Чем выше уровень активности дофамина, тем меньший стимул требуется для вызова определенного поведения. [53] Как следствие, высокий уровень дофамина приводит к высокому уровню двигательной активности и импульсивному поведению ; низкий уровень дофамина приводит к оцепенению и замедлению реакций. [53] Болезнь Паркинсона, при которой уровень дофамина в цепи черной субстанции значительно снижается, характеризуется скованностью и трудностями в начале движения. Однако, когда люди с этим заболеванием сталкиваются с сильными раздражителями, такими как серьезная угроза, их реакции могут быть такой же энергичный, как у здорового человека. [56] Напротив, наркотики, которые увеличивают высвобождение дофамина, такие как кокаин или амфетамин, могут вызывать повышенный уровень активности, включая, в крайнем случае, психомоторное возбуждение и стереотипные движения . [57]
Второй важный эффект дофамина — это «обучающий» сигнал. [53] Когда за действием следует повышение активности дофамина, схема базальных ганглиев изменяется таким образом, что ту же реакцию легче вызвать, когда аналогичные ситуации возникнут в будущем. [53] Это форма оперантного обусловливания , при которой дофамин играет роль сигнала вознаграждения. [54]

На языке, используемом для обсуждения системы вознаграждений, вознаграждение — это привлекательное и мотивационное свойство стимула, которое вызывает аппетитное поведение (также известное как поведение приближения) и законченное поведение . [58] Поощрительный стимул — это стимул, который может побудить организм приблизиться к нему и принять решение его употребить. [58] Удовольствие , обучение (например, классическое и оперантное обусловливание ) и подход к поведению — три основные функции вознаграждения. [58] Как аспект вознаграждения, удовольствие дает определение вознаграждения; [58] однако, хотя все приятные стимулы приносят удовольствие, не все стимулы, приносящие удовольствие, являются приятными (например, внешние вознаграждения, такие как деньги). [58] [59] Мотивационный или желательный аспект стимулов вознаграждения отражается в поведении, которое они вызывают, тогда как удовольствие от внутренних вознаграждений возникает в результате их потребления после их приобретения. [58] Нейропсихологическая модель, которая различает эти два компонента стимула, приносящего по своей сути вознаграждение, представляет собой модель значимости стимулов , в которой «желание» или желание (реже «поиск» [60] ) соответствует аппетитному или приближающемуся поведению, в то время как «нравится» или удовольствие соответствует завершенному поведению. [58] [6] [61] У людей -наркоманов «желание» становится диссоциированным с «пристрастием», поскольку желание употреблять вызывающий привыкание наркотик увеличивается, в то время как удовольствие, получаемое от его употребления, уменьшается из-за толерантности к наркотику . [6]
В мозге дофамин частично действует как глобальный сигнал вознаграждения. Первоначальная дофаминовая реакция на поощряющий стимул кодирует информацию о значимости , ценности и контексте вознаграждения. [58] В контексте обучения, связанного с вознаграждением, дофамин также действует как сигнал ошибки прогнозирования вознаграждения , то есть степени, в которой значение вознаграждения является неожиданным. [58] Согласно этой гипотезе, предложенной Монтегю, Даяном и Сейновски, [62] ожидаемые вознаграждения не вызывают второй фазовой реакции дофамина в определенных дофаминергических клетках, но вознаграждения, которые являются неожиданными или превышают ожидаемые, вызывают короткий -длительное увеличение синаптического дофамина, тогда как отсутствие ожидаемого вознаграждения фактически приводит к падению выброса дофамина ниже фонового уровня. [58] Гипотеза «ошибки прогнозирования» вызвала особый интерес у вычислительных нейробиологов, поскольку влиятельный метод вычислительного обучения, известный как обучение временной разности, интенсивно использует сигнал, который кодирует ошибку прогнозирования. [58] Такое слияние теории и данных привело к плодотворному взаимодействию между нейробиологами и учеными-компьютерщиками, интересующимися машинным обучением . [58]
Данные, полученные на микроэлектродах из мозга животных, показывают, что дофаминовые нейроны в вентральной покрышке (VTA) и черной субстанции сильно активируются самыми разными событиями вознаграждения. [58] Эти дофаминовые нейроны, реагирующие на вознаграждение, в VTA и черной субстанции имеют решающее значение для познания, связанного с вознаграждением, и служат центральным компонентом системы вознаграждения. [6] [63] [64] Функция дофамина варьируется в каждой аксональной проекции VTA и черной субстанции; [6] например, проекция VTA- прилежащее ядро присваивает значимость стимулов («хочу») стимулам вознаграждения и связанным с ними сигналам , проекция VTA- префронтальная кора обновляет ценность различных целей в соответствии с их значимостью стимулов, VTA-проекция префронтальной коры обновляет ценность различных целей в соответствии с их значимостью стимулов. Проекции миндалевидного тела и VTA-гиппокамп опосредуют консолидацию воспоминаний, связанных с вознаграждением, а пути VTA- прилежащее ядро и путь черной субстанции-дорсальное полосатое тело участвуют в обучении двигательным реакциям, которые облегчают приобретение стимулов вознаграждения. [6] [65] Некоторая активность в дофаминергических проекциях VTA, по-видимому, также связана с предсказанием вознаграждения. [6] [65]
Хотя дофамин играет центральную роль в возникновении «желания», связанного с поведенческими реакциями аппетита или приближения к поощряющим стимулам, детальные исследования показали, что дофамин нельзя просто приравнивать к гедонистическому «пристрастию» или удовольствию, что отражается в законченной поведенческой реакции. [59] Дофаминовая нейротрансмиссия участвует в некоторых, но не во всех аспектах познания, связанного с удовольствием, поскольку центры удовольствия были идентифицированы как внутри дофаминовой системы (т.е. оболочки прилежащего ядра), так и за пределами дофаминовой системы (т.е. вентрального паллидума и парабрахиального ядра). ). [59] [61] [66] Например, прямая электрическая стимуляция дофаминовых путей с использованием электродов, имплантированных в мозг, воспринимается как удовольствие, и многие виды животных готовы работать, чтобы получить это. [67] Антипсихотические препараты снижают уровень дофамина и имеют тенденцию вызывать ангедонию , снижение способности испытывать удовольствие. [68] Многие виды приятного опыта, такие как половой акт, еда и видеоигры, увеличивают выброс дофамина. [69] Все наркотики, вызывающие привыкание, прямо или косвенно влияют на нейротрансмиссию дофамина в прилежащем ядре; [6] [67] эти наркотики усиливают «желание к наркотикам», что приводит к компульсивному употреблению наркотиков при неоднократном приеме в высоких дозах, предположительно за счет повышения чувствительности стимулов . [61] К препаратам, повышающим концентрацию синаптического дофамина, относятся психостимуляторы , такие как метамфетамин и кокаин. Они вызывают увеличение «желательного» поведения, но не сильно меняют выражение удовольствия или уровень насыщения. [61] [67] Однако опиатные наркотики, такие как героин и морфин, вызывают увеличение проявлений поведения «приязнь» и «желание». [61] Более того, животные, у которых вентральная покрышка дофаминовой системы отключена, не ищут пищу и умрут от голода, если оставить их себе, но если еду положить им в рот, они съедят ее и продемонстрируют выражение лица, указывающее на удовольствие. . [70]
Клиническое исследование, проведенное в январе 2019 года, в котором оценивалось влияние предшественника дофамина ( леводопы ), антагониста дофамина ( рисперидона ) и плацебо на реакцию вознаграждения на музыку, включая степень удовольствия, испытываемого во время музыкального озноба , измеряемого по изменениям электродермальной активности . а также субъективные оценки — обнаружено, что манипулирование нейротрансмиссией дофамина двунаправленно регулирует познание удовольствия (в частности, гедоническое воздействие музыки ) у людей. [71] [72] Это исследование показало, что повышенная нейротрансмиссия дофамина действует как обязательное условие для приятных гедонистических реакций на музыку у людей. [71] [72]
Исследование, опубликованное в журнале Nature в 1998 году, обнаружило доказательства того, что видеоигры высвобождают дофамин в полосатом теле человека. Этот дофамин связан с обучением, подкреплением поведения, вниманием и сенсомоторной интеграцией. [73] Исследователи использовали позитронно-эмиссионную томографию и меченный 11 C раклоприд для отслеживания уровня дофамина в мозге во время целенаправленных двигательных задач и обнаружили, что высвобождение дофамина положительно коррелирует с выполнением задач и является наибольшим в вентральном полосатом теле . Это было первое исследование, продемонстрировавшее поведенческие условия, при которых у людей высвобождается дофамин. Это подчеркивает способность позитронно-эмиссионной томографии обнаруживать потоки нейромедиаторов во время изменений в поведении. Согласно исследованиям, потенциально проблематичное использование видеоигр связано с такими личностными качествами, как низкая самооценка и низкая самоэффективность, тревожность, агрессия, а также клинические симптомы депрессии и тревожных расстройств. [74] Кроме того, причины, по которым люди играют в видеоигры, различаются и могут включать в себя преодоление трудностей , социализацию и личное удовлетворение. DSM -5 определяет расстройство, связанное с азартными играми, как психическое расстройство, тесно связанное с расстройством, связанным с азартными играми. Это было поддержано некоторыми исследователями, но также вызвало споры.
Дофамин не проникает через гематоэнцефалический барьер, поэтому его синтез и функции в периферических областях в значительной степени независимы от его синтеза и функций в головном мозге. [27] Значительное количество дофамина циркулирует в кровотоке, но его функции там не совсем ясны. [28] Дофамин обнаруживается в плазме крови в количествах, сравнимых с уровнями адреналина, но у людей более 95% дофамина в плазме находится в форме сульфата дофамина , конъюгата, продуцируемого ферментом сульфотрансферазой 1А3/1А4, действующим на свободный дофамин. [28] Основная часть этого сульфата дофамина производится в брыжеечных органах. [28] Считается, что выработка сульфата дофамина является механизмом детоксикации дофамина, который поступает с пищей или вырабатывается в процессе пищеварения — его уровень в плазме обычно повышается более чем в пятьдесят раз после еды. [28] Сульфат дофамина не имеет известных биологических функций и выводится с мочой. [28]
Относительно небольшое количество неконъюгированного дофамина в кровотоке может вырабатываться симпатической нервной системой , пищеварительной системой или, возможно, другими органами. [28] Он может действовать на дофаминовые рецепторы в периферических тканях, метаболизироваться или превращаться в норадреналин с помощью фермента дофамин-бета-гидроксилазы , который высвобождается в кровоток мозговым веществом надпочечников. [28] Некоторые дофаминовые рецепторы расположены в стенках артерий, где они действуют как сосудорасширяющее средство и ингибитор высвобождения норадреналина из окончаний постганглионарных симпатических нервов (дофамин может ингибировать высвобождение норадреналина, воздействуя на пресинаптические дофаминовые рецепторы, а также на пресинаптические α- 1 рецепторы, такие как сам норадреналин). [75] Эти реакции могут быть активированы дофамином, высвобождаемым из каротидного тела в условиях низкого содержания кислорода, но неизвестно, выполняют ли артериальные рецепторы дофамина другие биологически полезные функции. [75]
Помимо своей роли в модуляции кровотока, существует несколько периферических систем, в которых дофамин циркулирует в пределах ограниченной области и выполняет экзокринную или паракринную функцию. [28] Периферические системы, в которых дофамин играет важную роль, включают иммунную систему , почки и поджелудочную железу .
В иммунной системе дофамин действует на рецепторы, присутствующие на иммунных клетках, особенно на лимфоцитах . [76] Дофамин также может влиять на иммунные клетки селезенки , костного мозга и системы кровообращения . [77] Кроме того, дофамин может синтезироваться и высвобождаться самими иммунными клетками. [76] Основное воздействие дофамина на лимфоциты заключается в снижении уровня их активации. Функциональное значение этой системы неясно, но она обеспечивает возможный путь взаимодействия между нервной системой и иммунной системой и может иметь отношение к некоторым аутоиммунным заболеваниям. [77]
Почечная дофаминергическая система расположена в клетках нефрона почки , где присутствуют все подтипы дофаминовых рецепторов. [78] Дофамин также синтезируется там клетками канальцев и выбрасывается в канальцевую жидкость . Его действия включают усиление кровоснабжения почек, повышение скорости клубочковой фильтрации и усиление выведения натрия с мочой. Следовательно, нарушения функции дофамина в почках могут привести к снижению экскреции натрия и, как следствие, к развитию высокого кровяного давления . Имеются убедительные доказательства того, что нарушения в выработке дофамина или рецепторах могут привести к ряду патологий, включая окислительный стресс , отеки и генетическую или эссенциальную гипертензию. Окислительный стресс сам по себе может вызвать гипертонию. [79] Дефекты в системе также могут быть вызваны генетическими факторами или высоким кровяным давлением. [80]
В поджелудочной железе роль дофамина несколько сложна. Поджелудочная железа состоит из двух частей: экзокринного и эндокринного компонентов. Экзокринная часть синтезирует и секретирует в тонкий кишечник пищеварительные ферменты и другие вещества, включая дофамин. [81] Функция этого секретируемого дофамина после его попадания в тонкую кишку четко не установлена — возможные варианты включают защиту слизистой оболочки кишечника от повреждения и снижение моторики желудочно-кишечного тракта (скорости, с которой содержимое перемещается через пищеварительную систему). [81]
Островки поджелудочной железы составляют эндокринную часть поджелудочной железы и синтезируют и секретируют в кровоток гормоны, включая инсулин . [81] Имеются доказательства того, что бета-клетки островков, синтезирующих инсулин, содержат рецепторы дофамина и что дофамин снижает количество выделяемого ими инсулина. [81] Источник поступления дофамина четко не установлен — он может поступать из дофамина, который циркулирует в кровотоке и поступает из симпатической нервной системы, или он может синтезироваться локально другими типами клеток поджелудочной железы. [81]

Дофамин как промышленное лекарство продается, среди прочего, под торговыми названиями Интропин, Допастат и Ревимин. Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [82] Чаще всего он используется в качестве стимулирующего препарата при лечении тяжелого низкого кровяного давления , замедления сердечного ритма и остановки сердца . Это особенно важно при лечении этих заболеваний у новорожденных . [83] [14] Его вводят внутривенно. Поскольку период полувыведения дофамина в плазме очень короткий — примерно одна минута у взрослых, две минуты у новорожденных и до пяти минут у недоношенных детей — его обычно вводят непрерывно внутривенно капельно, а не однократно. [84]
Его эффекты, в зависимости от дозировки, включают увеличение выведения натрия почками, увеличение диуреза, увеличение частоты сердечных сокращений и повышение артериального давления . [84] В низких дозах он действует через симпатическую нервную систему, увеличивая силу сокращения сердечной мышцы и частоту сердечных сокращений, тем самым увеличивая сердечный выброс и кровяное давление. [85] Более высокие дозы также вызывают вазоконстрикцию , что еще больше повышает кровяное давление. [85] [86] В более старой литературе также описываются очень низкие дозы, которые, как считается, улучшают функцию почек без других последствий, но недавние обзоры пришли к выводу, что дозы на таких низких уровнях не эффективны, а иногда могут быть вредными. [87] Хотя некоторые эффекты возникают в результате стимуляции дофаминовых рецепторов, выраженные сердечно-сосудистые эффекты возникают в результате действия дофамина на α 1 , β 1 и β 2 адренергические рецепторы . [88] [89]
Побочные эффекты дофамина включают негативное воздействие на функцию почек и нерегулярное сердцебиение . [85] Установлено, что LD 50 , или смертельная доза, которая, как ожидается, окажется фатальной для 50% населения, составляет: 59 мг/кг (мышь; вводится внутривенно ); 95 мг/кг (мыши; вводят внутрибрюшинно ); 163 мг/кг (крыса; вводят внутрибрюшинно); 79 мг/кг (собака; вводится внутривенно). [90]
Дофаминовая система играет центральную роль в ряде серьезных заболеваний, включая болезнь Паркинсона , синдром дефицита внимания и гиперактивности , синдром Туретта , шизофрению , биполярное расстройство и зависимость . Помимо самого дофамина, существует множество других важных препаратов, которые действуют на дофаминовые системы в различных частях мозга или тела. Некоторые из них используются в медицинских или развлекательных целях, но нейрохимики также разработали множество исследовательских препаратов, некоторые из которых связываются с высоким сродством к определенным типам дофаминовых рецепторов и либо агонизируют , либо противодействуют их эффектам, а многие из них влияют на другие аспекты физиологии дофамина. , [91] включая ингибиторы переносчика дофамина , ингибиторы VMAT и ингибиторы ферментов .
В ряде исследований сообщалось о связанном с возрастом снижении синтеза дофамина и плотности рецепторов дофамина (т. е. количества рецепторов) в головном мозге. [92] Было показано, что это снижение происходит в полосатом теле и экстрастриарных областях. [93] Снижение рецепторов D 1 , D 2 и D 3 хорошо документировано. [94] [95] [96] Считается, что снижение уровня дофамина с возрастом является причиной многих неврологических симптомов, частота которых увеличивается с возрастом, таких как уменьшение размахивания руками и повышенная ригидность . [97] Изменения уровня дофамина также могут вызывать возрастные изменения когнитивной гибкости. [97]
Исследования показали, что дисбаланс дофамина влияет на утомляемость при рассеянном склерозе . [98] У пациентов с рассеянным склерозом дофамин ингибирует выработку IL-17 и IFN-γ мононуклеарными клетками периферической крови. [99]
Болезнь Паркинсона — возрастное заболевание, характеризующееся двигательными нарушениями, такими как скованность тела, замедление движений и дрожание конечностей, когда они не используются. [56] На поздних стадиях заболевание прогрессирует до деменции и, в конечном итоге, до смерти. [56] Основные симптомы вызваны потерей клеток, секретирующих дофамин, в черной субстанции. [100] Эти дофаминовые клетки особенно уязвимы к повреждениям, и различные травмы, включая энцефалит (как показано в книге и фильме « Пробуждение »), повторяющиеся сотрясения мозга , связанные со спортом , и некоторые формы химического отравления, такие как МФТП , могут приводят к значительной потере клеток, вызывая паркинсонический синдром , который по своим основным признакам сходен с болезнью Паркинсона. [101] Однако большинство случаев болезни Паркинсона являются идиопатическими , что означает, что причина гибели клеток не может быть идентифицирована. [101]
Наиболее широко используемым методом лечения паркинсонизма является введение L-ДОФА, метаболического предшественника дофамина. [27] L-ДОФА преобразуется в дофамин в мозге и различных частях тела с помощью фермента ДОФА-декарбоксилазы. [26] L-ДОФА используется вместо самого дофамина, поскольку, в отличие от дофамина, он способен преодолевать гематоэнцефалический барьер . [27] Его часто назначают совместно с ферментным ингибитором периферического декарбоксилирования , таким как карбидопа или бенсеразид , чтобы уменьшить количество, превращающееся в дофамин на периферии, и тем самым увеличить количество L-ДОФА, попадающего в мозг. [27] При регулярном применении L-ДОФА в течение длительного периода времени часто начинают проявляться различные неприятные побочные эффекты, такие как дискинезия ; даже в этом случае он считается лучшим доступным вариантом долгосрочного лечения для большинства случаев болезни Паркинсона. [27]
Лечение L-ДОФА не может восстановить утраченные клетки дофамина, но оно заставляет оставшиеся клетки вырабатывать больше дофамина, тем самым компенсируя потерю, по крайней мере, в некоторой степени. [27] На поздних стадиях лечение начинает неэффективным, поскольку потеря клеток настолько серьезна, что оставшиеся не могут производить достаточное количество дофамина независимо от уровня L-ДОФА. [27] Другие препараты, усиливающие функцию дофамина, такие как бромокриптин и перголид , также иногда используются для лечения паркинсонизма, но в большинстве случаев L-ДОФА, по-видимому, обеспечивает лучший компромисс между положительными эффектами и отрицательными побочными эффектами. [27]
Дофаминергические препараты, используемые для лечения болезни Паркинсона, иногда связаны с развитием синдрома дисрегуляции дофамина , который включает в себя чрезмерное использование дофаминергических препаратов и вызванное лекарствами компульсивное участие в естественных вознаграждениях , таких как азартные игры и сексуальная активность. [102] [103] Последнее поведение похоже на поведение, наблюдаемое у людей с поведенческой зависимостью . [102]

Кокаин , замещенные амфетамины (включая метамфетамин ), аддералл , метилфенидат (продаваемый как риталин или концерта ) и другие психостимуляторы оказывают свое действие главным образом или частично за счет повышения уровня дофамина в мозге с помощью различных механизмов. [104] Кокаин и метилфенидат являются блокаторами переносчика дофамина или ингибиторами обратного захвата ; [105] они неконкурентно ингибируют обратный захват дофамина, что приводит к увеличению концентрации дофамина в синаптической щели. [106] [107] : 54–58 Подобно кокаину, замещенные амфетамины и амфетамин также повышают концентрацию дофамина в синаптической щели , но по разным механизмам. [37] [107] : 147–150
Эффекты психостимуляторов включают увеличение частоты сердечных сокращений, температуры тела и потоотделения; улучшение бдительности, внимания и выносливости; увеличение удовольствия от награждения событиями; но при более высоких дозах возникает возбуждение, тревога или даже потеря контакта с реальностью . [104] Наркотики этой группы могут иметь высокий потенциал привыкания из-за их активирующего воздействия на опосредованную дофамином систему вознаграждения в мозге. [104] Однако некоторые из них также могут быть полезны в более низких дозах для лечения синдрома дефицита внимания и гиперактивности (СДВГ) и нарколепсии . [108] [109] Важным дифференцирующим фактором является начало и продолжительность действия. [104] Кокаин может начать действовать за секунды, если его вводить или вдыхать в форме свободного основания; Эффект длится от 5 до 90 минут. [110] Это быстрое и кратковременное действие делает его эффект легко ощутимым и, следовательно, дает ему высокий потенциал привыкания. [104] Напротив, метилфенидат, принимаемый в форме таблеток, может занять два часа, чтобы достичь пикового уровня в кровотоке, [108] и в зависимости от лекарственной формы эффект может длиться до 12 часов. [111] Преимущество этих препаратов длительного действия заключается в снижении возможности злоупотребления и улучшении приверженности к лечению за счет использования более удобных схем дозирования. [112]

Различные наркотики, вызывающие привыкание, вызывают увеличение активности дофамина, связанного с вознаграждением. [104] Стимуляторы, такие как никотин , кокаин и метамфетамин, способствуют повышению уровня дофамина, который, по-видимому, является основным фактором, вызывающим зависимость. Что касается других наркотиков, вызывающих привыкание, таких как опиоидный героин, повышенный уровень дофамина в системе вознаграждения может играть лишь незначительную роль в возникновении зависимости. [113] Когда люди, зависимые от стимуляторов, проходят абстиненцию, они не испытывают физических страданий, связанных с отменой алкоголя или опиатов; вместо этого они испытывают тягу, сильное стремление к наркотику, характеризующееся раздражительностью, беспокойством и другими симптомами возбуждения, [114] вызванное психологической зависимостью .
Дофаминовая система играет решающую роль в некоторых аспектах зависимости. На самой ранней стадии генетические различия, которые изменяют экспрессию дофаминовых рецепторов в мозгу, могут предсказать, сочтет ли человек стимуляторы привлекательными или отталкивающими. [115] Потребление стимуляторов приводит к повышению уровня дофамина в мозге, которое длится от нескольких минут до часов. [104] Наконец, хроническое повышение уровня дофамина, сопровождающее повторяющееся употребление высоких доз стимуляторов, запускает широкий спектр структурных изменений в мозге, которые ответственны за поведенческие отклонения, характеризующие зависимость. [116] Лечение зависимости от стимуляторов очень сложно, потому что даже если потребление прекращается, тяга, сопровождающая психологическую абстиненцию, не исчезает. [114] Даже когда тяга к наркотику кажется угасшей, она может возникнуть вновь при столкновении со стимулами, связанными с наркотиком, такими как друзья, места и ситуации. [114] Сети ассоциаций в мозге тесно взаимосвязаны. [117]
Психиатры в начале 1950-х годов обнаружили, что класс препаратов, известных как типичные антипсихотики (также известные как основные транквилизаторы ), часто эффективен для уменьшения психотических симптомов шизофрении. [118] Появление в 1950-х годах первого широко используемого антипсихотика, хлорпромазина (торазина), привело к выписке многих пациентов с шизофренией из учреждений в последующие годы. [118] К 1970-м годам исследователи поняли , что эти типичные антипсихотики действуют как антагонисты рецепторов D2 . [118] [119] Это осознание привело к так называемой дофаминовой гипотезе шизофрении , которая постулирует, что шизофрения в значительной степени вызвана гиперактивностью дофаминовых систем мозга. [120] Гипотеза дофамина получила дополнительную поддержку в наблюдении, что психотические симптомы часто усиливаются стимуляторами, усиливающими дофамин, такими как метамфетамин, и что эти наркотики также могут вызывать психоз у здоровых людей, если их принимать в достаточно больших дозах. [120] В последующие десятилетия были разработаны другие атипичные антипсихотики , которые имели меньше серьезных побочных эффектов. [118] Многие из этих новых препаратов не действуют непосредственно на дофаминовые рецепторы, а вместо этого косвенно вызывают изменения в активности дофамина. [121] Эти препараты также использовались для лечения других психозов. [118] Антипсихотические препараты оказывают широкое подавляющее действие на большинство типов активного поведения и, в частности, уменьшают бредовое и возбужденное поведение, характерное для явного психоза. [119]
Однако более поздние наблюдения привели к тому, что гипотеза дофамина потеряла популярность, по крайней мере, в ее простой первоначальной форме. [120] Во-первых, у пациентов с шизофренией обычно не наблюдается заметного повышения уровня активности дофамина в мозге. [120] Несмотря на это, многие психиатры и нейробиологи продолжают считать, что шизофрения связана с какой-то дисфункцией дофаминовой системы. [118] Однако по мере развития «дофаминовой гипотезы» с течением времени виды дисфункций, которые она постулирует, имеют тенденцию становиться все более тонкими и сложными. [118]
Психофармаколог Стивен М. Шталь предположил в обзоре 2018 года, что во многих случаях психоза, включая шизофрению, три взаимосвязанные сети, основанные на дофамине, серотонине и глутамате — каждая по отдельности или в различных комбинациях — способствуют перевозбуждению дофамина D 2 . Рецепторы вентрального полосатого тела . [122]
Измененная нейротрансмиссия дофамина вовлечена в синдром дефицита внимания и гиперактивности (СДВГ), состояние, связанное с нарушением когнитивного контроля , что, в свою очередь, приводит к проблемам с регуляцией внимания ( контроль внимания ), торможению поведения ( тормозящий контроль ), а также к забывчивости вещей или упущению деталей ( работа) . память ), среди других проблем. [123] Существуют генетические связи между рецепторами дофамина, переносчиком дофамина и СДВГ, а также связи с другими рецепторами и переносчиками нейромедиаторов. [124] Самая важная связь между дофамином и СДВГ связана с препаратами, которые используются для лечения СДВГ. [125] Одними из наиболее эффективных терапевтических средств при СДВГ являются психостимуляторы, такие как метилфенидат (риталин, концерта) и амфетамин (эвекео, аддералл, декседрин), препараты, которые повышают уровни дофамина и норадреналина в мозге. [125] Клинические эффекты этих психостимуляторов при лечении СДВГ опосредованы через непрямую активацию рецепторов дофамина и норадреналина, в частности дофаминового рецептора D 1 и адренорецептора α 2 , в префронтальной коре головного мозга. [123] [126] [127]
Дофамин играет роль в обработке боли на нескольких уровнях центральной нервной системы, включая спинной мозг, околоводопроводную серую часть , таламус , базальные ганглии и поясную извилину . [128] Снижение уровня дофамина связано с болезненными симптомами, которые часто возникают при болезни Паркинсона. [128] Нарушения дофаминергической нейротрансмиссии также возникают при некоторых болезненных клинических состояниях, включая синдром жжения во рту , фибромиалгию и синдром беспокойных ног. [128]
Тошнота и рвота в значительной степени определяются активностью постремной области в продолговатом мозге ствола мозга , в области, известной как триггерная зона хеморецепторов . [129] Эта область содержит большую популяцию дофаминовых рецепторов типа D2 . [129] Следовательно, препараты, которые активируют рецепторы D 2 , могут вызывать тошноту. [129] В эту группу входят некоторые лекарства, назначаемые при болезни Паркинсона, а также другие агонисты дофамина , такие как апоморфин . [130] В некоторых случаях антагонисты D 2 -рецепторов, такие как метоклопрамид, полезны в качестве средств против тошноты . [129]
Нет никаких сообщений о дофамине у архей , но он был обнаружен у некоторых типов бактерий и у простейших, называемых Tetrahymena . [131] Возможно, более важно то, что существуют типы бактерий, которые содержат гомологи всех ферментов, которые животные используют для синтеза дофамина. [132] Было высказано предположение, что животные получили свой механизм синтеза дофамина от бактерий посредством горизонтального переноса генов , который мог произойти относительно поздно в эволюционном времени, возможно, в результате симбиотического включения бактерий в эукариотические клетки, которые дали начало митохондриям. . [132]
Дофамин используется в качестве нейромедиатора у большинства многоклеточных животных. [133] У губок есть только одно сообщение о присутствии дофамина без указания его функции; [134] однако сообщалось о дофамине в нервной системе многих других радиально-симметричных видов, включая книдарий , гидру и некоторые кораллы . [135] Это датирует появление дофамина в качестве нейротрансмиттера самым ранним появлением нервной системы, более 500 миллионов лет назад, в кембрийский период. Дофамин действует как нейромедиатор у позвоночных , иглокожих , членистоногих , моллюсков и некоторых видов червей . [136] [137]
Было замечено, что у каждого типа животных, которые были исследованы, дофамин изменяет двигательное поведение. [133] В модельном организме , нематоде Caenorhabditis elegans , он снижает локомоцию и увеличивает движения, связанные с поиском пищи; у плоских червей совершает «винтовые» движения; у пиявок он тормозит плавание и способствует ползанию. У широкого круга позвоночных дофамин оказывает «активирующее» влияние на переключение поведения и выбор ответов, сравнимое с его действием у млекопитающих. [133] [138]
Также неоднократно доказывалось, что дофамин играет роль в обучении с вознаграждением во всех группах животных. [133] Как и все позвоночные, беспозвоночные , такие как круглые черви , плоские черви , моллюски и обыкновенные плодовые мухи, могут быть обучены повторять действие, если за ним постоянно следует повышение уровня дофамина. [133] У плодовых мух отдельные элементы обучения вознаграждению предполагают модульную структуру системы обработки вознаграждения насекомых, которая в целом аналогична структуре системы млекопитающих. [139] Например, дофамин регулирует краткосрочное и долгосрочное обучение у обезьян; [140] у плодовых мух разные группы дофаминовых нейронов передают сигналы вознаграждения за кратковременную и долговременную память. [141]
Долгое время считалось, что членистоногие являются исключением из этого правила, а дофамин оказывает неблагоприятное воздействие. Было замечено, что вознаграждение вместо этого опосредовано октопамином , нейротрансмиттером, тесно связанным с норэпинефрином. [142] Однако более поздние исследования показали, что дофамин действительно играет роль в обучении с помощью вознаграждения у плодовых мух. Также было обнаружено, что полезный эффект октопамина обусловлен его активацией набора дофаминергических нейронов, ранее не исследованных в исследованиях. [142]

Многие растения, в том числе разнообразные пищевые, в разной степени синтезируют дофамин. [143] Самые высокие концентрации наблюдались в бананах: мякоть красных и желтых бананов содержит дофамин в количестве от 40 до 50 частей на миллион по весу. [143] Картофель, авокадо, брокколи и брюссельская капуста также могут содержать дофамин в количестве 1 часть на миллион или более; апельсины, помидоры, шпинат, фасоль и другие растения содержат измеримые концентрации менее 1 части на миллион. [143] Дофамин в растениях синтезируется из аминокислоты тирозина по биохимическим механизмам, аналогичным тем, которые используют животные. [143] Он может метаболизироваться различными способами с образованием меланина и различных алкалоидов в качестве побочных продуктов. [143] Функции растительных катехоламинов четко не установлены, но есть свидетельства того, что они играют роль в реакции на стрессоры, такие как бактериальная инфекция, в некоторых ситуациях действуют как факторы, стимулирующие рост, и изменяют способ расщепления сахаров. метаболизируется. Рецепторы, опосредующие эти действия, еще не идентифицированы, как и внутриклеточные механизмы, которые они активируют. [143]
Дофамин, потребляемый с пищей, не может действовать на мозг, поскольку не может преодолеть гематоэнцефалический барьер. [27] Однако есть также множество растений, которые содержат L-ДОФА, метаболический предшественник дофамина. [144] Самые высокие концентрации обнаружены в листьях и стручках растений рода Mucuna , особенно в Mucuna pruriens (бархатные бобы), которые использовались в качестве источника L-ДОФА в качестве лекарственного средства. [145] Еще одним растением, содержащим значительные количества L-ДОФА, является Vicia faba , растение, которое производит конские бобы (также известные как «бобы»). Однако уровень L-ДОФА в бобах намного ниже, чем в оболочках стручков и других частях растения. [146] Семена деревьев кассии и баухинии также содержат значительное количество L-ДОФА. [144]
В одном из видов морских зеленых водорослей Ulvaria obscura , основном компоненте цветения некоторых водорослей , дофамин присутствует в очень высоких концентрациях, оцениваемых в 4,4% от сухого веса. Есть доказательства того, что этот дофамин действует как защита от травоядных животных , снижая потребление его улитками и изоподами . [147]
Меланины — это семейство темно-пигментированных веществ, обнаруженных в широком спектре организмов. [148] Химически они тесно связаны с дофамином, и существует тип меланина, известный как дофамин-меланин , который может быть синтезирован путем окисления дофамина с помощью фермента тирозиназы . [148] Меланин, который затемняет кожу человека, не относится к этому типу: он синтезируется по пути, в котором в качестве предшественника используется L-ДОФА, но не дофамин. [148] Однако имеются убедительные доказательства того, что нейромеланин , который придает темный цвет черной субстанции мозга, по крайней мере частично представляет собой дофамин-меланин. [149]
Меланин, производный дофамина, вероятно, появляется по крайней мере в некоторых других биологических системах. Некоторая часть дофамина в растениях, вероятно, будет использоваться в качестве предшественника дофамина-меланина. [150] Считается, что сложные узоры, которые появляются на крыльях бабочек, а также черно-белые полосы на телах личинок насекомых, вызваны пространственно структурированными скоплениями дофамина-меланина. [151]
Дофамин был впервые синтезирован в 1910 году Джорджем Баргером и Джеймсом Юэнсом в лабораториях Wellcome в Лондоне, Англия [152] и впервые идентифицирован в человеческом мозге Кэтрин Монтегю в 1957 году. Он был назван дофамином, потому что это моноамин , предшественник которого в Баргер- Синтез Юэнса представляет собой 3,4- дигидроксифенилаланин ( леводопа или L - ДОФА). Функция дофамина как нейромедиатора была впервые признана в 1958 году Арвидом Карлссоном и Нильсом-Оке Хилларпом в Лаборатории химической фармакологии Национального института сердца Швеции . [153] Карлссон был удостоен Нобелевской премии по физиологии и медицине 2000 года за доказательство того, что дофамин является не только предшественником норадреналина (норадреналина) и адреналина (адреналина), но также сам по себе является нейромедиатором. [154]
Исследования, посвященные адгезивным полифенольным белкам мидий , привели к открытию в 2007 году , что самые разнообразные материалы, если их поместить в раствор дофамина со слабоосновным pH , покроются слоем полимеризованного дофамина, часто называемого полидофамином . [155] [156] Этот полимеризованный дофамин образуется в результате спонтанной реакции окисления и формально является разновидностью меланина. [157] Кроме того, самополимеризация дофамина может использоваться для модуляции механических свойств гелей на основе пептидов. [158] Синтез полидофамина обычно включает реакцию гидрохлорида дофамина с Трисом в качестве основания в воде. Структура полидофамина неизвестна. [156]
Полидофаминовые покрытия могут образовываться на объектах размером от наночастиц до больших поверхностей. [157] Слои полидофамина обладают химическими свойствами, которые могут оказаться чрезвычайно полезными, и многочисленные исследования изучали их возможное применение. [157] На самом простом уровне их можно использовать для защиты от повреждения светом или для формирования капсул для доставки лекарств. [157] На более сложном уровне их адгезионные свойства могут сделать их полезными в качестве субстратов для биосенсоров или других биологически активных макромолекул. [157]
Таким образом, стимулы, вызывающие страх, способны по-разному изменять фазовую передачу дофамина в субрегионах NAcc. Авторы предполагают, что наблюдаемое повышение уровня дофамина в оболочке NAcc, вероятно, отражает общую мотивационную значимость, возможно, из-за облегчения состояния страха, вызванного CS, когда не проводится УЗИ (шок для ног). Это рассуждение подтверждается сообщением Будыгина и его коллег
112
, в котором показано, что у анестезированных крыс прекращение зажима хвоста приводит к увеличению высвобождения дофамина в панцире.
Субстрат: L-фенилаланин + тетрагидробиоптерин + O2
Продукт: L-тирозин + 3-гидроксифенилаланин [(он же м-тирозин)] + дигидроптеридин + H2O
Организм: Homo sapiens
Субстрат: м-тирозин
Продукт: м-тирамин + CO2
Организм: Homo sapiens
TAAR1 представляет собой рецептор с высоким сродством к METH/AMPH и DA.
Прослушивание приятной музыки часто сопровождается измеримыми телесными реакциями, такими как мурашки по коже или дрожь по спине, обычно называемые «ознобом» или «дрожью». ... В целом, наши результаты прямо показали, что фармакологические вмешательства двунаправленно модулируют реакции вознаграждения, вызываемые музыкой. В частности, мы обнаружили, что рисперидон ухудшал способность участников испытывать музыкальное удовольствие, тогда как леводопа усиливала ее. ... Здесь, напротив, изучая реакции на абстрактные вознаграждения у людей, мы показываем, что манипуляция дофаминергической передачей влияет как на удовольствие (т.е. количество времени, в течение которого сообщается о ознобе, и эмоциональное возбуждение, измеряемое EDA), так и на мотивационные компоненты музыкального вознаграждения. (деньги готовы потратить). Эти данные позволяют предположить, что дофаминергическая передача сигналов является непременным условием не только для мотивационных реакций, как было показано на примере первичных и вторичных вознаграждений, но также и для гедонистических реакций на музыку. Этот результат подтверждает недавние результаты, показывающие, что дофамин также опосредует восприятие приятности, получаемой от других типов абстрактных вознаграждений (37), и бросает вызов предыдущим данным на животных моделях о первичных вознаграждениях, таких как еда (42, 43).
В фармакологическом исследовании, опубликованном в PNAS, Ferreri et al. (1) представили доказательства того, что усиление или ингибирование передачи сигналов дофамина с помощью леводопы или рисперидона модулирует удовольствие, испытываемое при прослушивании музыки. ... В последней попытке установить не только корреляционную, но и причинно-следственную связь дофамина с музыкальным удовольствием, авторы обратились к прямому манипулированию дофаминергической передачей сигналов в полосатом теле, сначала применяя возбуждающую и тормозящую транскраниальную магнитную стимуляцию к мозгу участников. левая дорсолатеральная префронтальная кора, область, которая, как известно, модулирует функцию полосатого тела (5), и, наконец, в текущем исследовании, путем введения фармацевтических агентов, способных изменять синаптическую доступность дофамина (1), оба из которых влияют на восприятие удовольствия, физиологические показатели возбуждения, и денежная стоимость, присвоенная музыке в предсказанном направлении. ... Хотя вопрос о музыкальном выражении эмоций имеет долгую историю исследований, в том числе в PNAS (6), а психофизиологическое направление исследований 1990-х годов уже установило, что музыкальное удовольствие может активировать вегетативную нервную систему (7), Демонстрация авторами влияния системы вознаграждения на музыкальные эмоции была воспринята как первое доказательство того, что это настоящие эмоции, исследование которых имеет полную законность для информирования нейробиологии о наших повседневных когнитивных, социальных и аффективных функциях (8). Кстати, это направление работы, кульминацией которого стала статья Феррери и др. (1), вероятно, сделал больше для привлечения финансирования исследований в области музыкальных наук, чем кто-либо другой в этом сообществе.
Доказательства Феррери и др. (1) обеспечивает новейшую поддержку убедительной нейробиологической модели, в которой музыкальное удовольствие возникает в результате взаимодействия древних систем вознаграждения/оценки (стриарно-лимбической-паралимбической) с более филогенетически развитыми системами восприятия/предсказания (темпорофронтальными).
Дофамин связывается с бета-1, бета-2, альфа-1 и дофаминергическими рецепторами.