Моносахариды (от греч. monos : одиночный, sacchar : сахар), также называемые простыми сахарами , представляют собой простейшие формы сахара и самые основные единицы ( мономеры ), из которых построены все углеводы . Проще говоря, это структурная единица углеводов . [1] [2]
Обычно они представляют собой бесцветные , водорастворимые органические твердые вещества кристаллической формы. Вопреки своему названию (сахара), только некоторые моносахариды имеют сладкий вкус . Большинство моносахаридов имеют формулу (CH 2 O) x (хотя не все молекулы с этой формулой являются моносахаридами).
Примеры моносахаридов включают глюкозу (декстрозу), фруктозу (левулозу) и галактозу . Моносахариды являются строительными блоками дисахаридов (таких как сахароза и лактоза ) и полисахаридов (таких как целлюлоза и крахмал ). Столовый сахар , используемый в повседневной жизни, сам по себе представляет собой дисахарид сахарозу, содержащий по одной молекуле каждого из двух моносахаридов D -глюкозы и D -фруктозы. [2]
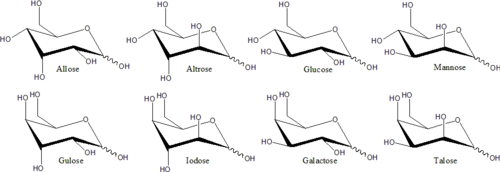
Каждый атом углерода , поддерживающий гидроксильную группу, является хиральным , за исключением тех, которые находятся на конце цепи. Это приводит к появлению ряда изомерных форм, имеющих одну и ту же химическую формулу. Например, галактоза и глюкоза являются альдогексозами , но имеют разную физическую структуру и химические свойства.
Моносахарид глюкоза играет ключевую роль в обмене веществ , где химическая энергия извлекается посредством гликолиза и цикла лимонной кислоты для обеспечения энергией живых организмов.
Мальтоза – это конденсация моносахаридов.
За немногими исключениями (например, дезоксирибоза ), моносахариды имеют такую химическую формулу : (CH 2 O) x , где условно x ≥ 3. Моносахариды можно классифицировать по количеству x содержащихся в них атомов углерода: триоза ( 3 ), тетроза (4 ), пентоза (5), гексоза (6), гептоза (7) и так далее.
Глюкоза, используемая в качестве источника энергии и для синтеза крахмала, гликогена и целлюлозы, представляет собой гексозу . Рибоза и дезоксирибоза (в РНК и ДНК соответственно) представляют собой пентозные сахара. Примеры гептоз включают кетозы , манногептулозу и седогептулозу . Моносахариды с восемью и более атомами углерода наблюдаются редко, поскольку они весьма нестабильны. В водных растворах моносахариды существуют в виде колец, если они содержат более четырех атомов углерода.
Простые моносахариды имеют линейный и неразветвленный углеродный скелет с одной карбонильной (C=O) функциональной группой и одной гидроксильной (OH) группой на каждом из остальных атомов углерода . Следовательно, молекулярную структуру простого моносахарида можно записать как H(CHOH) n (C=O)(CHOH) m H, где n + 1 + m = x ; так что его элементарная формула: C x H 2 x O x .
По соглашению атомы углерода нумеруются от 1 до x вдоль основной цепи, начиная с конца, ближайшего к группе C=O. Моносахариды — это простейшие единицы углеводов и простейшая форма сахара.
Если карбонил находится в положении 1 (то есть n или m равен нулю), молекула начинается с формильной группы H(C=O)- и технически является альдегидом . В этом случае соединение называется альдозой . В противном случае молекула имеет кетоновую группу, карбонильную группу -(C=O)- между двумя атомами углерода; тогда формально это кетон и называется кетозой. Кетозы, представляющие биологический интерес, обычно содержат карбонил в положении 2.
Различные приведенные выше классификации можно комбинировать, в результате чего возникают такие названия, как «альдогексоза» и «кетотриоза».
Более общая номенклатура моносахаридов с открытой цепью сочетает в себе греческий префикс для обозначения количества атомов углерода (три-, тетра-, пент-, гекс- и т. д.) с суффиксами «-оза» для альдоз и «-улоза» для альдоз. кетозы. [1] В последнем случае, если карбонил не находится в положении 2, его положение обозначается числовым индексом. Так, например, H(C=O)(CHOH) 4 H – пентоза, H(CHOH)(C=O)(CHOH) 3 H – пентулоза, а H(CHOH) 2 (C=O)(CHOH) 2H представляет собой пент-3-улозу.
Два моносахарида с эквивалентными молекулярными графами (одинаковая длина цепи и одинаковое карбонильное положение) все же могут быть разными стереоизомерами , молекулы которых различаются пространственной ориентацией. Это происходит только в том случае, если молекула содержит стереогенный центр , а именно хиральный атом углерода (связанный с четырьмя различными молекулярными подструктурами). Эти четыре связи могут иметь любую из двух конфигураций в пространстве, отличающихся направленностью . В простом моносахариде с открытой цепью каждый углерод является хиральным, за исключением первого и последнего атомов цепи, а также (в кетозах) углерода с кетогруппой.
Например, трикетоза H(CHOH)(C=O)(CHOH)H (глицерон, дигидроксиацетон ) не имеет стереогенного центра и поэтому существует в виде единственного стереоизомера. Другая триоза, альдоза H(C=O)(CHOH) 2 H ( глицериновый альдегид ), имеет один хиральный углерод – центральный, номер 2 – который связан с группами –H, –OH, –C(OH)H. 2 и -(C=O)H. Следовательно, он существует в виде двух стереоизомеров, молекулы которых являются зеркальным отражением друг друга (как левая и правая перчатки). Моносахариды с четырьмя или более атомами углерода могут содержать несколько хиральных атомов углерода, поэтому они обычно имеют более двух стереоизомеров. Число различных стереоизомеров с одинаковой диаграммой ограничено величиной 2 c , где c — общее количество хиральных атомов углерода.
Проекция Фишера — это систематический способ изображения скелетной формулы ациклического моносахарида, позволяющий четко определить направленность каждого хирального углерода. Каждый стереоизомер простого моносахарида с открытой цепью можно идентифицировать по положениям (справа или слева) на диаграмме Фишера хиральных гидроксилов (гидроксилов, присоединенных к хиральным атомам углерода).
Большинство стереоизомеров сами по себе хиральны (в отличие от их зеркальных изображений). В проекции Фишера два зеркальных изомера отличаются тем, что положения всех хиральных гидроксилов перевернуты справа налево. Зеркальные изомеры химически идентичны в нехиральной среде, но обычно имеют очень разные биохимические свойства и проявления в природе.
Хотя большинство стереоизомеров могут быть расположены парами зеркального отображения, существуют некоторые нехиральные стереоизомеры, которые идентичны своим зеркальным отображениям, несмотря на наличие хиральных центров. Это происходит всякий раз, когда молекулярный граф симметричен, как в 3-кепентозах H(CHOH) 2 (CO)(CHOH) 2 H, и две половины являются зеркальным отображением друг друга. В этом случае зеркальное отображение эквивалентно повороту на пол-оборота. По этой причине существует только три различных стереоизомера 3-кепентозы, хотя молекула имеет два хиральных атома углерода.
Отдельные стереоизомеры, которые не являются зеркальным отображением друг друга, обычно имеют разные химические свойства даже в нехиральной среде. Следовательно, каждой паре зеркал и каждому нехиральному стереоизомеру можно дать конкретное название моносахарида . Например, существует 16 различных стереоизомеров альдогексозы, но название «глюкоза» означает определенную пару зеркальных альдогексоз. В проекции Фишера один из двух изомеров глюкозы имеет гидроксил слева от C3 и справа от C4 и C5; в то время как другой изомер имеет обратную картину. Эти конкретные названия моносахаридов имеют обычные трехбуквенные сокращения, такие как «Glu» для глюкозы и «Thr» для треозы .
Обычно моносахарид с n асимметричными атомами углерода имеет 2 n стереоизомера. Число стереоизомеров с открытой цепью у альдозного моносахарида на единицу больше, чем у кетозного моносахарида той же длины. Каждая кетоза будет иметь 2 ( n -3) стереоизомера, где n > 2 — количество атомов углерода. Каждая альдоза будет иметь 2 ( n -2) стереоизомера, где n > 2 — количество атомов углерода. Их также называют эпимерами, которые имеют различное расположение групп -OH и -H у асимметричных или хиральных атомов углерода (это не относится к атомам углерода, имеющим карбонильную функциональную группу).
Как и многие хиральные молекулы, два стереоизомера глицеральдегида будут постепенно менять направление поляризации линейно поляризованного света при прохождении через него, даже в растворе. Два стереоизомера обозначаются префиксами D- и L- в зависимости от направления вращения: D -глицеральдегид является правовращающим (вращает ось поляризации по часовой стрелке), а L -глицеральдегид является левовращающим (вращает ее против часовой стрелки).

Префиксы D- и L- также используются с другими моносахаридами, чтобы различать два конкретных стереоизомера, которые являются зеркальным отображением друг друга. Для этого рассматривают хиральный углерод, наиболее удаленный от группы C=O. Его четыре связи должны соединяться с –H, –OH, –C(OH)H и остальной частью молекулы. Если молекулу можно вращать в пространстве так, что направления этих четырех групп совпадают с направлениями аналоговых групп в C2 D -глицеральдегида, то изомер получает префикс D- . В противном случае он получает префикс L- .
В проекции Фишера префиксы D- и L- указывают конфигурацию у второго снизу атома углерода: D – если гидроксил находится справа, и L – если он находится слева.
Обратите внимание, что префиксы D- и L- не указывают направление вращения поляризованного света, что представляет собой совокупный эффект расположения всех хиральных центров. Однако два энантиомера всегда будут вращать свет в противоположных направлениях на одинаковую величину. См. также систему D/L .
Моносахарид часто переходит из ациклической (с открытой цепью) формы в циклическую форму посредством реакции нуклеофильного присоединения между карбонильной группой и одной из гидроксильных групп той же молекулы. В результате реакции создается кольцо атомов углерода, замкнутое одним мостиковым атомом кислорода . Полученная молекула имеет полуацетальную или гемикетальную группу, в зависимости от того, была ли линейная форма альдозой или кетозой. Реакцию легко обратить вспять, приводя к исходной форме с открытой цепью.
В этих циклических формах кольцо обычно состоит из пяти или шести атомов. Эти формы называются фуранозами и пиранозами соответственно — по аналогии с фураном и пираном , простейшими соединениями с одинаковым углеродно-кислородным кольцом (хотя у них отсутствуют двойные связи этих двух молекул). Например, альдогексоза- глюкоза может образовывать полуацетальную связь между альдегидной группой на углероде 1 и гидроксилом на углероде 4, образуя молекулу с 5-членным кольцом, называемую глюкофуранозой . Та же самая реакция может происходить между атомами углерода 1 и 5 с образованием молекулы с 6-членным кольцом, называемой глюкопиранозой . Циклические формы с семиатомным кольцом (тот же, что и оксепан ), встречающиеся редко, называются гептозами .


Для многих моносахаридов (включая глюкозу) преобладают циклические формы, как в твердом состоянии, так и в растворах, поэтому одно и то же название обычно используется для изомеров с открытой и закрытой цепью. Так, например, термин «глюкоза» может означать глюкофуранозу, глюкопиранозу, форму с открытой цепью или смесь этих трех.
Циклизация создает новый стереогенный центр на карбонилсодержащем углероде. Группа -OH, которая заменяет кислород карбонила, может оказаться в двух разных положениях относительно средней плоскости кольца. Таким образом, каждый моносахарид с открытой цепью дает два циклических изомера ( аномера ), обозначаемые префиксами α- и β-. Молекула может переходить между этими двумя формами с помощью процесса, называемого мутаротацией , который заключается в изменении направления реакции образования кольца с последующим образованием другого кольца. [3]
Стереохимическую структуру циклического моносахарида можно представить в проекции Хаворта . На этой диаграмме α-изомер пиранозной формы D -альдогексозы имеет -OH аномерного углерода ниже плоскости атомов углерода, тогда как β-изомер имеет -OH аномерного углерода над плоскостью. Пиранозы обычно принимают конформацию стула, аналогичную конформации циклогексана . В этой конформации α-изомер имеет -OH аномерного углерода в аксиальном положении, тогда как β-изомер имеет -OH аномерного углерода в экваториальном положении (с учетом D -альдогексозных сахаров). [4]
Существует большое количество биологически важных модифицированных моносахаридов: