Развитие нервной системы или нейронное развитие ( нейроразвитие ) относится к процессам, которые формируют, формируют и перестраивают нервную систему животных, от самых ранних стадий эмбрионального развития до взрослой жизни. Область нейронного развития опирается как на нейронауку, так и на биологию развития, чтобы описать и предоставить понимание клеточных и молекулярных механизмов, посредством которых развиваются сложные нервные системы, от нематод и плодовых мушек до млекопитающих .
Дефекты в развитии нервной системы могут привести к порокам развития, таким как голопрозэнцефалия , и широкому спектру неврологических расстройств, включая парезы и параличи конечностей , нарушения равновесия и зрения, судороги , [1] а у людей и к другим расстройствам, таким как синдром Ретта , синдром Дауна и умственная отсталость . [2]
Центральная нервная система (ЦНС) позвоночных происходит из эктодермы — самого внешнего зародышевого слоя эмбриона. Часть дорсальной эктодермы становится определенной в нейральную эктодерму — нейроэктодерму , которая образует нервную пластинку вдоль дорсальной стороны эмбриона. [3] [4] Это часть раннего формирования эмбриона (включая эмбрион беспозвоночных), которая также устанавливает передне-заднюю ось. [5] [6] Нервная пластинка является источником большинства нейронов и глиальных клеток ЦНС. Нервная бороздка формируется вдоль длинной оси нервной пластинки, и нервная пластинка сгибается, давая начало нервной трубке . [7] Этот процесс известен как нейруляция . [8] Когда трубка закрыта с обоих концов, она заполнена эмбриональной спинномозговой жидкостью. [9] По мере развития эмбриона передняя часть нервной трубки расширяется и образует три первичных мозговых пузыря , которые становятся передним мозгом ( prosencephalon ), средним мозгом ( mesencephalon ) и задним мозгом ( rhombencephalon ). Эти простые ранние пузырьки увеличиваются и далее делятся на конечный мозг (будущую кору головного мозга и базальные ганглии ), промежуточный мозг (будущие таламус и гипоталамус ), средний мозг (будущие холмики ), задний мозг (будущий мост и мозжечок ) и продолговатый мозг (будущий продолговатый мозг ). [10] Центральная камера, заполненная цереброспинальной жидкостью, непрерывна от конечного мозга до центрального канала спинного мозга и составляет развивающуюся желудочковую систему ЦНС. Эмбриональная спинномозговая жидкость отличается от той, которая образуется на более поздних стадиях развития, и от взрослой цереброспинальной жидкости; он влияет на поведение нейронных предшественников. [9] Поскольку нервная трубка дает начало головному и спинному мозгу, любые мутации на этой стадии развития могут привести к фатальным деформациям, таким как анэнцефалия , или к пожизненным нарушениям, таким как spina bifida . В это время стенки нервной трубки содержат нервные стволовые клетки, которые стимулируют рост мозга, поскольку они делятся много раз. Постепенно некоторые клетки перестают делиться и дифференцируются в нейроны и глиальные клетки , которые являются основными клеточными компонентами ЦНС. [11] Вновь образованные нейроны мигрируют в различные части развивающегося мозга, чтобы самоорганизоваться в различные мозговые структуры. Как только нейроны достигают своих региональных положений, они удлиняют аксоны и дендриты , которые позволяют им общаться с другими нейронами через синапсы . Синаптическая связь между нейронами приводит к установлению функциональных нейронных цепей , которые опосредуют сенсорную и двигательную обработку и лежат в основе поведения. [12]
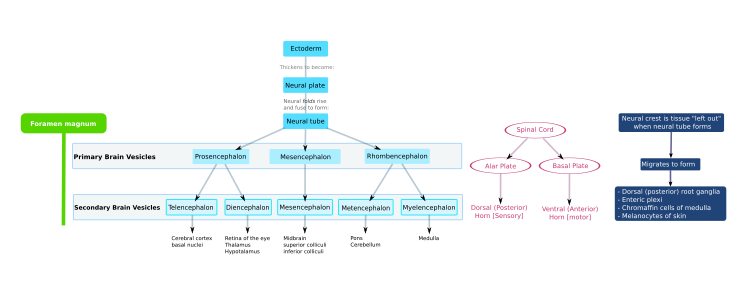
Во время раннего эмбрионального развития позвоночных дорсальная эктодерма становится специфической, чтобы дать начало эпидермису и нервной системе; часть дорсальной эктодермы становится специфической в нейральную эктодерму, чтобы сформировать нервную пластинку , которая дает начало нервной системе. [3] [13] Превращение недифференцированной эктодермы в нейроэктодерму требует сигналов от мезодермы . В начале гаструляции предполагаемые мезодермальные клетки перемещаются через дорсальную губу бластопора и образуют слой мезодермы между энтодермой и эктодермой. Мезодермальные клетки мигрируют вдоль дорсальной средней линии, чтобы дать начало хорде , которая развивается в позвоночный столб . Нейроэктодерма, покрывающая хорду, развивается в нервную пластинку в ответ на диффузный сигнал, производимый хордой. Оставшаяся часть эктодермы дает начало эпидермису. Способность мезодермы преобразовывать лежащую над ней эктодерму в нервную ткань называется нервной индукцией .
На раннем этапе развития эмбриона нервная пластинка сгибается наружу, образуя нервную бороздку . Начиная с будущей шейной области, нервные складки этой бороздки смыкаются, образуя нервную трубку . Формирование нервной трубки из эктодермы называется нейруляцией . Вентральная часть нервной трубки называется базальной пластинкой ; дорсальная часть называется крыловидной пластинкой . Полая внутренняя часть называется нервным каналом , а открытые концы нервной трубки, называемые нейропорами, закрываются. [14]
Трансплантированная губа бластопора может преобразовать эктодерму в нервную ткань и, как говорят, имеет индуктивный эффект. Нейральные индукторы — это молекулы, которые могут индуцировать экспрессию нейральных генов в эксплантатах эктодермы , не индуцируя также мезодермальные гены. Нейральная индукция часто изучается на эмбрионах Xenopus , поскольку у них простой план строения тела и существуют хорошие маркеры для различения нервной и не нервной ткани. Примерами нейральных индукторов являются молекулы ноггин и хордин .
Когда эмбриональные эктодермальные клетки культивируются при низкой плотности в отсутствие мезодермальных клеток, они подвергаются нейронной дифференциации (экспрессируют нейронные гены), что позволяет предположить, что нейронная дифференциация является судьбой эктодермальных клеток по умолчанию. В культурах эксплантатов (которые допускают прямое взаимодействие клеток) те же клетки дифференцируются в эпидермис. Это происходит из-за действия BMP4 ( белка семейства TGF-β ), который побуждает эктодермальные культуры дифференцироваться в эпидермис. Во время нейронной индукции ноггин и хордин вырабатываются дорсальной мезодермой (хордой) и диффундируют в вышележащую эктодерму, чтобы ингибировать активность BMP4. Это ингибирование BMP4 заставляет клетки дифференцироваться в нейронные клетки. Ингибирование сигналов TGF-β и BMP (костного морфогенетического белка) может эффективно индуцировать нервную ткань из плюрипотентных стволовых клеток . [15]
На более поздней стадии развития верхняя часть нервной трубки изгибается на уровне будущего среднего мозга — мезэнцефалона , в мезэнцефалическом изгибе или цефалическом изгибе . Выше среднего мозга находится прозэнцефалон (будущий передний мозг), а ниже — ромбэнцефалон (будущий задний мозг).
Крыловидная пластинка переднего мозга расширяется, образуя конечный мозг , который дает начало полушариям головного мозга , в то время как его базальная пластинка становится промежуточным мозгом . Зрительный пузырек (который в конечном итоге становится зрительным нервом, сетчаткой и радужной оболочкой) формируется на базальной пластинке переднего мозга.
У хордовых дорсальная эктодерма формирует всю нервную ткань и нервную систему. Паттернирование происходит из-за специфических условий окружающей среды - различных концентраций сигнальных молекул
Вентральная половина нервной пластинки контролируется хордой , которая действует как «организатор». Дорсальная половина контролируется эктодермальной пластинкой, которая фланкирует обе стороны нервной пластинки. [16]
Эктодерма следует по пути по умолчанию, чтобы стать нервной тканью. Доказательства этого получены из отдельных культивируемых клеток эктодермы, которые продолжают формировать нервную ткань. Предполагается, что это происходит из-за недостатка BMP , которые блокируются организатором. Организатор может производить такие молекулы, как фоллистатин , ноггин и хордин, которые ингибируют BMP.
Вентральная нервная трубка сформирована звуковым ежом (Shh) из хорды, которая действует как индуцирующая ткань. Shh, полученный из хорды, подает сигналы в пластинку основания и индуцирует экспрессию Shh в пластинке основания. Shh, полученный из пластинки основания, впоследствии подает сигналы другим клеткам в нервной трубке и необходим для правильной спецификации доменов-предшественников вентральных нейронов. Потеря Shh из хорды и/или пластинки основания препятствует правильной спецификации этих доменов-предшественников. Shh связывает Patched1 , снимая опосредованное Patched ингибирование Smoothened , что приводит к активации семейства факторов транскрипции Gli ( GLI1 , GLI2 и GLI3 ).
В этом контексте Shh действует как морфоген - он индуцирует клеточную дифференциацию в зависимости от его концентрации. При низких концентрациях он формирует вентральные интернейроны , при более высоких концентрациях он индуцирует развитие двигательных нейронов , а при самых высоких концентрациях он индуцирует дифференциацию пластинки дна. Нарушение дифференциации, модулируемой Shh, вызывает голопрозэнцефалию .
Дорсальная нервная трубка формируется BMP из эпидермальной эктодермы, фланкирующей нервную пластинку. Они индуцируют сенсорные интернейроны, активируя Sr/Thr киназы и изменяя уровни фактора транскрипции SMAD .
Сигналы, которые контролируют переднезаднее развитие нейронов, включают FGF и ретиноевую кислоту , которые действуют в заднем и спинном мозге. [17] Задний мозг, например, формируется генами Hox , которые экспрессируются в перекрывающихся доменах вдоль переднезадней оси под контролем ретиноевой кислоты. Гены 3 ′ (3-концевой) в кластере Hox индуцируются ретиноевой кислотой в заднем мозге, тогда как гены 5 ′ (5-концевой) Hox не индуцируются ретиноевой кислотой и экспрессируются более сзади в спинном мозге. Hoxb-1 экспрессируется в ромбомере 4 и дает начало лицевому нерву . Без этой экспрессии Hoxb-1 возникает нерв, похожий на тройничный нерв .
Нейрогенез — это процесс, посредством которого нейроны генерируются из нервных стволовых клеток и клеток-предшественников . Нейроны являются «постмитотическими», что означает, что они никогда больше не будут делиться в течение жизни организма. [12]
Эпигенетические модификации играют ключевую роль в регуляции экспрессии генов в дифференцирующихся нейральных стволовых клетках и имеют решающее значение для определения судьбы клеток в развивающемся и взрослом мозге млекопитающих. Эпигенетические модификации включают метилирование цитозина ДНК с образованием 5-метилцитозина и деметилирование 5-метилцитозина . [18] [19] Метилирование цитозина ДНК катализируется ДНК-метилтрансферазами (DNMT) . Деметилирование метилцитозина катализируется в несколько последовательных этапов ферментами TET , которые осуществляют окислительные реакции (например, 5-метилцитозин в 5-гидроксиметилцитозин ) и ферментами пути репарации оснований ДНК (BER). [18]

Миграция нейронов — это метод, с помощью которого нейроны перемещаются из места своего происхождения или рождения в свое конечное положение в мозге. Существует несколько способов, которыми они могут это сделать, например, радиальная миграция или тангенциальная миграция. Последовательности радиальной миграции (также известной как глиальное наведение) и сомальной транслокации были зафиксированы с помощью покадровой микроскопии . [20]

Клетки-предшественники нейронов размножаются в желудочковой зоне развивающегося неокортекса , где основной нейронной стволовой клеткой является радиальная глиальная клетка . Первые постмитотические клетки должны покинуть нишу стволовых клеток и мигрировать наружу, чтобы сформировать препластину, которой суждено стать клетками Кахаля-Ретциуса и нейронами субпластины . Эти клетки делают это путем сомальной транслокации. Нейроны, мигрирующие с помощью этого способа передвижения, являются биполярными и прикрепляют передний край отростка к мягкой мозговой оболочке . Затем сомовая оболочка транспортируется на поверхность мягкой мозговой оболочки с помощью нуклеокинеза, процесса, при котором микротрубочковая «клетка» вокруг ядра удлиняется и сокращается в ассоциации с центросомой , чтобы направить ядро к его конечному месту назначения. [21]
Радиальные глиальные клетки , чьи волокна служат в качестве каркаса для мигрирующих клеток и средства радиальной коммуникации, опосредованной динамической активностью кальция, [22] [23] действуют как основные возбуждающие нейрональные стволовые клетки коры головного мозга [24] [25] или транслоцируются в кортикальную пластинку и дифференцируются либо в астроциты , либо в нейроны . [26] Сомальная транслокация может происходить в любой момент развития. [20]
Последующие волны нейронов разделяют препластину, мигрируя вдоль радиальных глиальных волокон, чтобы сформировать кортикальную пластину. Каждая волна мигрирующих клеток проходит мимо своих предшественников, образуя слои изнутри наружу, что означает, что самые молодые нейроны находятся ближе всего к поверхности. [27] [28] По оценкам, глиальная направленная миграция составляет 90% мигрирующих нейронов у человека и около 75% у грызунов. [29]
Большинство интернейронов мигрируют тангенциально, используя несколько способов миграции, чтобы достичь своего соответствующего местоположения в коре. Примером тангенциальной миграции является перемещение интернейронов из ганглиозного возвышения в кору головного мозга. Одним из примеров продолжающейся тангенциальной миграции в зрелом организме, наблюдаемой у некоторых животных, является ростральный миграционный поток, соединяющий субвентрикулярную зону и обонятельную луковицу .
Многие нейроны, мигрирующие вдоль передне-задней оси тела, используют существующие аксонные тракты для миграции; это называется аксофильной миграцией. Примером этого способа миграции являются нейроны, экспрессирующие ГнРГ , которые совершают долгое путешествие от места своего рождения в носу через передний мозг и в гипоталамус. [30] Многие из механизмов этой миграции были разработаны, начиная с внеклеточных направляющих сигналов [31] , которые запускают внутриклеточную сигнализацию. Эти внутриклеточные сигналы, такие как кальциевая сигнализация , приводят к актиновой [32] и микротрубочковой [33] динамике цитоскелета , которая производит клеточные силы, которые взаимодействуют с внеклеточной средой через белки клеточной адгезии [34], вызывая движение этих клеток.
Существует также метод миграции нейронов, называемый мультиполярной миграцией . [35] [36] Это наблюдается в мультиполярных клетках, которые у человека в изобилии присутствуют в кортикальной промежуточной зоне . Они не похожи на клетки, мигрирующие путем локомоции или сомальной транслокации. Вместо этого эти мультиполярные клетки экспрессируют нейронные маркеры и расширяют множественные тонкие отростки в различных направлениях независимо от радиальных глиальных волокон. [35]
Выживание нейронов регулируется факторами выживания, называемыми трофическими факторами. Нейротрофическая гипотеза была сформулирована Виктором Гамбургером и Ритой Леви Монтальчини на основе исследований развивающейся нервной системы. Виктор Гамбургер обнаружил, что имплантация дополнительной конечности развивающемуся цыпленку приводит к увеличению числа спинальных двигательных нейронов. Первоначально он думал, что дополнительная конечность вызывает пролиферацию двигательных нейронов, но позже он и его коллеги показали, что во время нормального развития происходит значительная гибель двигательных нейронов, а дополнительная конечность предотвращает эту гибель клеток. Согласно нейротрофической гипотезе, растущие аксоны конкурируют за ограниченное количество целевых трофических факторов, а аксоны, которые не получают достаточной трофической поддержки, погибают в результате апоптоза. Теперь ясно, что факторы, вырабатываемые рядом источников, способствуют выживанию нейронов.
Большая часть нашего понимания формирования синапсов получена из исследований нервно-мышечного соединения. Передатчиком в этом синапсе является ацетилхолин. Ацетилхолиновый рецептор (AchR) присутствует на поверхности мышечных клеток до формирования синапса. Прибытие нерва вызывает кластеризацию рецепторов в синапсе. Макмахан и Сэйнс показали, что синаптогенный сигнал концентрируется в базальной пластинке . Они также показали, что синаптогенный сигнал производится нервом, и они определили фактор как Агрин . Агрин вызывает кластеризацию AchR на поверхности мышцы, и формирование синапсов нарушается у мышей с нокаутом агрина. Агрин передает сигнал через рецептор MuSK в рапсин . Фишбах и коллеги показали, что субъединицы рецептора селективно транскрибируются из ядер рядом с синаптической зоной. Это опосредовано нейрегулинами.
В зрелом синапсе каждое мышечное волокно иннервируется одним двигательным нейроном. Однако в процессе развития многие волокна иннервируются несколькими аксонами. Лихтман и его коллеги изучали процесс устранения синапсов. [37] Это событие зависит от активности. Частичная блокада рецептора приводит к ретракции соответствующих пресинаптических окончаний. Позже они использовали коннектомический подход, т. е. отслеживание всех связей между двигательными нейронами и мышечными волокнами, чтобы охарактеризовать устранение синапсов в процессе развития на уровне полной цепи. Анализ подтвердил массивную перестройку, 10-кратное уменьшение количества синапсов, которое происходит, когда аксоны сокращают свои двигательные единицы, но добавляют больше синаптических областей в НМС, с которыми они остаются в контакте. [38]
Агрин, по-видимому, не является центральным медиатором формирования синапсов ЦНС, и существует активный интерес к выявлению сигналов, которые опосредуют синаптогенез ЦНС. Нейроны в культуре развивают синапсы, которые похожи на те, которые образуются in vivo, что предполагает, что синаптогенетические сигналы могут нормально функционировать in vitro. Исследования синаптогенеза ЦНС были сосредоточены в основном на глутаматергических синапсах. Эксперименты с визуализацией показывают, что дендриты очень динамичны во время развития и часто инициируют контакт с аксонами. За этим следует набор постсинаптических белков в место контакта. Стивен Смит и коллеги показали, что контакт, инициированный дендритными филоподиями, может развиться в синапсы.
Индукция образования синапсов глиальными факторами: Баррес и коллеги сделали наблюдение, что факторы в глиальных кондиционированных средах вызывают образование синапсов в культурах ганглиозных клеток сетчатки. Образование синапсов в ЦНС коррелирует с дифференциацией астроцитов, что предполагает, что астроциты могут обеспечивать синаптогенный фактор. Идентичность астроцитарных факторов пока неизвестна.
Нейролигины и SynCAM как синаптогенетические сигналы: Судхоф, Серафини, Шейффеле и коллеги показали, что нейролигины и SynCAM могут действовать как факторы, которые вызывают пресинаптическую дифференциацию. Нейролигины концентрируются в постсинаптическом участке и действуют через нейрексины, концентрирующиеся в пресинаптических аксонах. SynCAM — это молекула клеточной адгезии, которая присутствует как в пре-, так и в постсинаптических мембранах.
Процессы миграции нейронов , дифференциации и аксонного наведения , как правило, считаются механизмами, независимыми от активности, и полагаются на жестко запрограммированные генетические программы в самих нейронах. Однако результаты исследований выявили роль механизмов, зависящих от активности , в посредничестве некоторых аспектов этих процессов, таких как скорость миграции нейронов, [39] аспекты нейронной дифференциации [40] и поиск пути аксонами. [41] Механизмы, зависящие от активности, влияют на развитие нейронных цепей и имеют решающее значение для составления ранних карт связей и постоянного совершенствования синапсов, которое происходит во время развития. [42] Существует два различных типа нейронной активности, которые мы наблюдаем в развивающихся цепях: ранняя спонтанная активность и сенсорно-вызванная активность. Спонтанная активность возникает на ранних стадиях развития нейронной цепи , даже когда отсутствует сенсорный вход, и наблюдается во многих системах, таких как развивающаяся зрительная система , [43] [44] слуховая система , [45] [46] двигательная система , [47] гиппокамп , [48] мозжечок [49] и неокортекс . [50]
Экспериментальные методы, такие как прямая электрофизиологическая запись, флуоресцентная визуализация с использованием кальциевых индикаторов и оптогенетические методы, пролили свет на природу и функцию этих ранних всплесков активности. [51] [52] Они имеют четкие пространственные и временные закономерности во время развития [53] , и их абляция во время развития, как известно, приводит к дефициту уточнения сети в зрительной системе. [54] В незрелой сетчатке волны спонтанных потенциалов действия возникают из ганглиозных клеток сетчатки и распространяются по поверхности сетчатки в первые несколько постнатальных недель. [55] Эти волны опосредуются нейротрансмиттером ацетилхолином в начальной фазе, а позднее глутаматом . [ 56] Считается, что они инструктируют формирование двух сенсорных карт — ретинотопической карты и глазоспецифической сегрегации. [57] Уточнение ретинотопической карты происходит в нижестоящих визуальных целях в мозге — верхнем холмике (SC) и дорсальном латеральном коленчатом ядре (LGN). [58] Фармакологическое нарушение и мышиные модели, в которых отсутствует субъединица β2 никотинового ацетилхолинового рецептора, показали, что отсутствие спонтанной активности приводит к выраженным дефектам ретинотопии и глазоспецифической сегрегации. [57]
Недавние исследования подтверждают, что микроглия , резидентная иммунная клетка мозга, устанавливает прямые контакты с телами клеток развивающихся нейронов и посредством этих связей регулирует нейрогенез, миграцию, интеграцию и формирование нейронных сетей в зависимости от активности. [59]
В развивающейся слуховой системе развивающаяся улитка генерирует всплески активности, которые распространяются по внутренним волосковым клеткам и нейронам спирального ганглия , которые передают слуховую информацию в мозг. [60] Высвобождение АТФ из поддерживающих клеток запускает потенциалы действия во внутренних волосковых клетках . [61] Считается, что в слуховой системе спонтанная активность участвует в формировании тонотопической карты путем разделения аксонов кохлеарных нейронов, настроенных на высокие и низкие частоты. [60] В двигательной системе периодические всплески спонтанной активности вызываются возбуждающими ГАМК и глутаматом на ранних стадиях и ацетилхолином и глутаматом на более поздних стадиях. [62] В развивающемся спинном мозге данио-рерио ранняя спонтанная активность необходима для формирования все более синхронных чередующихся всплесков между ипсилатеральными и контралатеральными областями спинного мозга и для интеграции новых клеток в цепь. [63] Считается, что двигательные нейроны, иннервирующие одни и те же сокращающиеся мышечные волокна, поддерживают синхронную активность, что позволяет обоим нейронам оставаться в контакте с мышечным волокном во взрослом возрасте. [38] В коре головного мозга ранние волны активности наблюдались в мозжечке и корковых срезах. [64] Как только сенсорный стимул становится доступным, окончательная тонкая настройка карт сенсорного кодирования и совершенствование цепей начинают все больше и больше полагаться на сенсорно-вызванную активность, как продемонстрировано в классических экспериментах о влиянии сенсорной депривации в критические периоды . [64]
Современные методы диффузионно-взвешенной МРТ также могут раскрыть макроскопический процесс развития аксонов. Коннектом может быть построен из данных диффузионной МРТ : вершины графа соответствуют анатомически обозначенным областям серого вещества, и две такие вершины, скажем, u и v , соединяются ребром, если фаза трактографии обработки данных находит аксональное волокно, которое соединяет две области, соответствующие u и v .
Многочисленные мозговые графики, вычисленные в рамках проекта Human Connectome Project, можно загрузить с сайта http://braingraph.org. Consensus Connectome Dynamics (CCD) — это замечательное явление, которое было обнаружено путем непрерывного уменьшения минимального параметра достоверности в графическом интерфейсе Budapest Reference Connectome Server. [65] [66] Budapest Reference Connectome Server (http://connectome.pitgroup.org) отображает мозговые связи n=418 субъектов с параметром частоты k: для любого k=1,2,...,n можно просмотреть график ребер, которые присутствуют по крайней мере в k коннектомах. Если параметр k уменьшается по одному от k=n до k=1, то в графике появляется все больше и больше ребер, поскольку условие включения ослаблено. Удивительным наблюдением является то, что появление ребер далеко не случайно: оно напоминает растущую сложную структуру, как дерево или кустарник (визуализировано на анимации слева).
В [67] выдвигается гипотеза , что растущая структура копирует развитие аксонов человеческого мозга : самые ранние развивающиеся связи (аксональные волокна) являются общими для большинства субъектов, а развивающиеся впоследствии связи имеют все большую и большую дисперсию, поскольку их дисперсия накапливается в процессе развития аксонов.
Несколько мотонейронов конкурируют за каждое нервно-мышечное соединение, но только один выживает до взрослого возраста. [37] Было показано, что конкуренция in vitro включает ограниченное нейротрофическое вещество, которое высвобождается, или что нейронная активность подразумевает преимущество сильных постсинаптических связей, давая сопротивление токсину, также высвобождаемому при стимуляции нерва. In vivo предполагается, что мышечные волокна выбирают самый сильный нейрон через ретроградный сигнал или что зависящие от активности механизмы элиминации синапса определяют идентичность «победившего» аксона на двигательной концевой пластинке. [38]
Картирование мозга может показать, как мозг животного меняется на протяжении всей его жизни. По состоянию на 2021 год ученые картировали и сравнивали весь мозг восьми червей C. elegans на протяжении их развития на нейронном уровне [68] [69] и полную проводку одной мышцы млекопитающего от рождения до взрослой жизни. [38]
Нейрогенез также происходит в определенных частях мозга взрослого человека.