В химии селективность связывания определяется по отношению к связыванию лигандов с субстратом, образуя комплекс . Селективность связывания описывает , как лиганд может связываться более предпочтительно с одним рецептором , чем с другим. Коэффициент селективности — это константа равновесия для реакции вытеснения одним лигандом другого лиганда в комплексе с субстратом. Селективность связывания имеет большое значение в биохимии [1] и в процессах химического разделения .
Концепция селективности используется для количественной оценки степени, в которой одно химическое вещество, A, связывает каждое из двух других химических веществ, B и C. Простейший случай — когда образованные комплексы имеют стехиометрию 1:1 . Тогда два взаимодействия могут быть охарактеризованы константами равновесия K AB и K AC . [примечание 1] где [X] представляет собой концентрацию вещества X (A, B, C, …).
Коэффициент селективности определяется как отношение двух констант равновесия. Этот коэффициент селективности фактически является константой равновесия для реакции замещения
Легко показать, что то же самое определение применимо к комплексам с другой стехиометрией, A p B q и A p C q . Чем больше коэффициент селективности, тем больше лиганд C вытеснит лиганд B из комплекса, образованного с субстратом A. Альтернативная интерпретация заключается в том, что чем больше коэффициент селективности, тем ниже концентрация C, необходимая для вытеснения B из AB. Коэффициенты селективности определяются экспериментально путем измерения двух констант равновесия, K AB и K AC .
В биохимии субстрат известен как рецептор. Рецептор — это белковая молекула, встроенная либо в плазматическую мембрану , либо в цитоплазму клетки, с которой могут связываться один или несколько определенных видов сигнальных молекул. Лигандом может быть пептид или другая небольшая молекула, такая как нейротрансмиттер , гормон , фармацевтический препарат или токсин. Специфичность рецептора определяется его пространственной геометрией и тем, как он связывается с лигандом посредством нековалентных взаимодействий , таких как водородные связи или силы Ван-дер-Ваальса . [2]
Если рецептор может быть изолирован, можно разработать синтетический препарат, который будет либо стимулировать рецептор, агонист , либо блокировать его, антагонист . Лекарство от язвы желудка циметидин было разработано как антагонист H2 путем химической инженерии молекулы для максимальной специфичности к изолированной ткани, содержащей рецептор. Дальнейшее использование количественных соотношений структура-активность (QSAR) привело к разработке других агентов, таких как ранитидин .
«Селективность» в отношении препарата относительна. Например, в более высокой дозе конкретная молекула препарата может также связываться с другими рецепторами, чем те, которые называются «селективными».
Хелатная терапия — это форма медицинского лечения, при котором хелатирующий лиганд [примечание 2] используется для селективного удаления металла из организма. Когда металл существует в виде двухвалентного иона, например, свинца , Pb 2+ или ртути , селективность Hg 2+ по отношению к кальцию , Ca 2+ и магнию , Mg 2+ , имеет важное значение для того, чтобы лечение не удаляло необходимые металлы. [3]
Селективность определяется различными факторами. В случае перегрузки железом , которая может возникнуть у людей с β- талессемией , которым делали переливание крови , целевой ион металла находится в степени окисления +3 и, таким образом, образует более прочные комплексы, чем двухвалентные ионы. Он также образует более прочные комплексы с лигандами-донорами кислорода, чем с лигандами-донорами азота. дефероксамин , встречающийся в природе сидерофор, вырабатываемый актинобактером Streptomyces pilosus и первоначально использовавшийся в качестве агента хелатной терапии. Были разработаны синтетические сидерофоры, такие как деферипрон и деферазирокс , с использованием известной структуры дефероксамина в качестве отправной точки. [4] [5] Хелатирование происходит с двумя атомами кислорода.
Болезнь Вильсона вызвана дефектом метаболизма меди , что приводит к накоплению металлической меди в различных органах тела. Целевой ион в этом случае двухвалентный, Cu2 + . Этот ион классифицируется как пограничный в схеме Арланда, Чатта и Дэвиса. [6] Это означает, что он образует примерно одинаково прочные комплексы с лигандами, донорными атомами которых являются N, O или F, как и с лигандами, донорными атомами которых являются P, S или Cl. Пеницилламин , который содержит донорные атомы азота и серы, используется, поскольку этот тип лиганда сильнее связывается с ионами меди, чем с ионами кальция и магния.
Лечение отравления тяжелыми металлами, такими как свинец и ртуть, более проблематично, поскольку используемые лиганды не обладают высокой специфичностью по отношению к кальцию. Например, ЭДТА может вводиться в виде кальциевой соли для снижения удаления кальция из костей вместе с тяжелым металлом. Факторы, определяющие селективность свинца по отношению к цинку, кадмию и кальцию, были рассмотрены, [7]
В колоночной хроматографии смесь веществ растворяется в подвижной фазе и пропускается через неподвижную фазу в колонке. Фактор селективности определяется как отношение коэффициентов распределения , которые описывают равновесное распределение аналита между неподвижной фазой и подвижной фазой. Фактор селективности равен коэффициенту селективности с добавленным предположением, что активность неподвижной фазы, субстрата в данном случае, равна 1, стандартное предположение для чистой фазы. [8] Разрешение хроматографической колонки, R S, связано с фактором селективности следующим образом:
где α — фактор селективности, N — число теоретических тарелок, k A и k B — факторы удерживания двух аналитов. Факторы удерживания пропорциональны коэффициентам распределения. На практике можно разделить вещества с фактором селективности, очень близким к 1. Это особенно актуально в газожидкостной хроматографии , где возможны колонки длиной до 60 м, что обеспечивает очень большое число теоретических тарелок.
В ионообменной хроматографии коэффициент селективности определяется несколько иначе [9]
Экстракция растворителем [10] используется для извлечения отдельных лантаноидов из смесей, встречающихся в природе в рудах, таких как монацит . В одном процессе ионы металла в водном растворе заставляют образовывать комплексы с трибутилфосфатом (ТБФ), которые извлекаются в органический растворитель, такой как керосин . Полное разделение осуществляется с помощью метода противоточного обмена . Ряд ячеек располагаются в виде каскада . После уравновешивания водный компонент каждой ячейки переносится в предыдущую ячейку, а органический компонент переносится в следующую ячейку, которая изначально содержит только воду. Таким образом, ион металла с наиболее стабильным комплексом проходит вниз по каскаду в органической фазе, а металл с наименее стабильным комплексом проходит вверх по каскаду в водной фазе. [11]
Если растворимость в органической фазе не является проблемой, коэффициент селективности равен отношению констант устойчивости комплексов ТБФ двух ионов металлов. Для лантаноидов, которые являются соседними в периодической таблице, это отношение не намного больше 1, поэтому в каскаде требуется много ячеек.
Коэффициент потенциометрической селективности определяет способность ион-селективного электрода отличать один конкретный ион от других. Коэффициент селективности, K B,C, оценивается с помощью отклика ЭДС ион-селективного электрода в смешанных растворах первичного иона, B, и мешающего иона, C (метод фиксированной интерференции) или, что менее желательно, в отдельных растворах B и C (метод раздельного раствора). [12] Например, калий -селективный мембранный электрод использует встречающийся в природе макроциклический антибиотик валиномицин . В этом случае полость в макроциклическом кольце имеет как раз нужный размер для инкапсуляции иона калия, но слишком велика для прочного связывания иона натрия, наиболее вероятного источника помех.
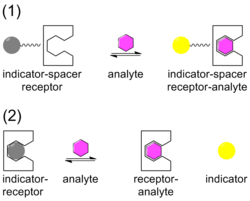
Химические сенсоры [ 13] [14] разрабатываются для специфических целевых молекул и ионов, в которых мишень (гость) образует комплекс с сенсором (хозяином). Сенсор разработан так, чтобы идеально соответствовать размеру и форме мишени, чтобы обеспечить максимальную селективность связывания. С сенсором связан индикатор, который претерпевает изменение, когда мишень образует комплекс с сенсором. Изменение индикатора обычно представляет собой изменение цвета (с серого на желтый на иллюстрации), наблюдаемое в поглощении или, с большей чувствительностью, люминесценции . Индикатор может быть прикреплен к сенсору через спейсер в компоновке ISR или может быть смещен от сенсора в компоновке IDA.