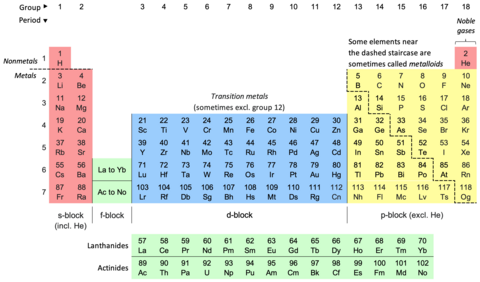
Периодическая таблица , также известная как периодическая таблица элементов , представляет собой упорядоченное расположение химических элементов в строках (« периоды ») и столбцах (« группы »). Это символ химии , широко используемый в физике и других науках. Это изображение периодического закона , который гласит, что когда элементы расположены в порядке их атомных номеров, то очевидна приблизительная повторяемость их свойств . Таблица разделена на четыре примерно прямоугольные области, называемые блоками . Элементы в одной группе, как правило, демонстрируют схожие химические характеристики.
Периодическую таблицу характеризуют вертикальные, горизонтальные и диагональные тенденции . Металлические свойства усиливаются при движении вниз по группе и справа налево по периоду. Неметаллические свойства усиливаются при движении от нижнего левого угла периодической таблицы к верхнему правому.
Первая периодическая таблица, которая стала общепринятой, была создана русским химиком Дмитрием Менделеевым в 1869 году; он сформулировал периодический закон как зависимость химических свойств от атомной массы . Поскольку не все элементы были тогда известны, в его периодической таблице были пробелы, и Менделеев успешно использовал периодический закон для предсказания некоторых свойств некоторых из недостающих элементов . Периодический закон был признан фундаментальным открытием в конце 19-го века. Он был объяснен в начале 20-го века с открытием атомных чисел и связанной с этим пионерской работой в квантовой механике , обе идеи служили для освещения внутренней структуры атома. Узнаваемая современная форма таблицы была достигнута в 1945 году с открытием Гленна Т. Сиборга , что актиниды на самом деле были f-блоковыми, а не d-блоковыми элементами. Периодическая таблица и закон в настоящее время являются центральной и неотъемлемой частью современной химии.
Периодическая таблица продолжает развиваться с прогрессом науки. В природе существуют только элементы до атомного номера 94; [a] чтобы пойти дальше, необходимо было синтезировать новые элементы в лаборатории. К 2010 году были известны первые 118 элементов, тем самым заполнив первые семь строк таблицы; [1] однако химическая характеристика по-прежнему необходима для самых тяжелых элементов, чтобы подтвердить, что их свойства соответствуют их позициям. Новые открытия расширят таблицу за пределы этих семи строк , хотя пока неизвестно, сколько еще элементов возможно; более того, теоретические расчеты предполагают, что эта неизвестная область не будет следовать закономерностям известной части таблицы. Также продолжается некоторая научная дискуссия относительно того, правильно ли расположены некоторые элементы в сегодняшней таблице. Существует множество альтернативных представлений периодического закона, и ведутся дискуссии относительно того, существует ли оптимальная форма периодической таблицы.

Каждый химический элемент имеет уникальный атомный номер ( Z — от «Zahl», по-немецки «число»), представляющий число протонов в его ядре . [4] Таким образом, каждый отдельный атомный номер соответствует классу атома: эти классы называются химическими элементами . [5] Химические элементы — это то, что классифицирует и организует периодическая таблица. Водород — это элемент с атомным номером 1; гелий — атомным номером 2; литий — атомным номером 3; и так далее. Каждое из этих названий может быть дополнительно сокращено одно- или двухбуквенным химическим символом ; для водорода, гелия и лития это соответственно H, He и Li. [6] Нейтроны не влияют на химическую идентичность атома, но влияют на его вес. Атомы с одинаковым числом протонов, но разным числом нейтронов называются изотопами одного и того же химического элемента. [6] Встречающиеся в природе элементы обычно встречаются в виде смесей различных изотопов; Поскольку каждый изотоп обычно встречается с характерным избытком, встречающиеся в природе элементы имеют четко определенные атомные веса , определяемые как средняя масса встречающегося в природе атома этого элемента. [7] Все элементы имеют несколько изотопов , вариантов с одинаковым числом протонов, но разным числом нейтронов . Например, у углерода есть три встречающихся в природе изотопа: все его атомы имеют шесть протонов, и большинство также имеют шесть нейтронов, но около одного процента имеют семь нейтронов, а очень небольшая часть имеет восемь нейтронов. Изотопы никогда не разделяются в периодической таблице; они всегда группируются вместе под одним элементом. Когда показывается атомная масса, это обычно взвешенное среднее значение встречающихся в природе изотопов; но если изотопы не встречаются в природе в значительных количествах, обычно появляется масса наиболее стабильного изотопа, часто в скобках. [8]
В стандартной периодической таблице элементы перечислены в порядке возрастания атомного номера. Новая строка ( период ) начинается, когда новая электронная оболочка имеет свой первый электрон . Столбцы ( группы ) определяются электронной конфигурацией атома; элементы с одинаковым числом электронов в определенной подоболочке попадают в одни и те же столбцы (например, кислород , сера и селен находятся в одном столбце, потому что все они имеют четыре электрона в самой внешней p-подоболочке). Элементы со схожими химическими свойствами обычно попадают в одну и ту же группу в периодической таблице, хотя в f-блоке и в некотором отношении в d-блоке элементы в одном и том же периоде, как правило, также имеют схожие свойства. Таким образом, сравнительно легко предсказать химические свойства элемента, если известны свойства элементов вокруг него. [9]
На сегодняшний день известно 118 элементов, первые 94 из которых, как известно, встречаются в природе на Земле в настоящее время. [10] [a] Остальные 24, от америция до оганесона (95–118), встречаются только при синтезе в лабораториях. Из 94 встречающихся в природе элементов 83 являются первичными , а 11 встречаются только в цепочках распада первичных элементов. Некоторые из последних настолько редки, что не были обнаружены в природе, но были синтезированы в лаборатории до того, как было установлено, что они вообще существуют в природе: технеций (элемент 43), прометий (элемент 61), астат (элемент 85), нептуний (элемент 93) и плутоний (элемент 94). [12] Ни один элемент тяжелее эйнштейния (элемент 99) никогда не наблюдался в макроскопических количествах в чистом виде, как и астат ; франций (элемент 87) был сфотографирован только в виде света , испускаемого микроскопическими количествами (300 000 атомов). [14] Из 94 природных элементов восемьдесят имеют стабильный изотоп, а еще один ( висмут ) имеет почти стабильный изотоп (с периодом полураспада 2,01×10 19 лет, что в миллиард раз больше возраста Вселенной ). [15] [b] Еще два, торий и уран , имеют изотопы, подвергающиеся радиоактивному распаду с периодом полураспада, сопоставимым с возрастом Земли . Стабильные элементы плюс висмут, торий и уран составляют 83 первичных элемента, которые сохранились со времен образования Земли. [c] Оставшиеся одиннадцать природных элементов распадаются достаточно быстро, так что их постоянное наличие в следовых количествах в первую очередь основано на постоянной регенерации в качестве промежуточных продуктов распада тория и урана. [d] Все 24 известных искусственных элемента являются радиоактивными. [6]
Согласно международному соглашению об именовании, группы нумеруются численно от 1 до 18 от самого левого столбца (щелочные металлы) до самого правого столбца (благородные газы). Группы f-блока в этой нумерации игнорируются. [22] Группы также могут быть названы по их первому элементу, например, «группа скандия» для группы 3. [22] Ранее группы были известны римскими цифрами . В Соединенных Штатах за римскими цифрами следовала либо «A», если группа находилась в s- или p-блоке , либо «B», если группа находилась в d-блоке . Используемые римские цифры соответствуют последней цифре сегодняшнего соглашения об именовании (например, элементы группы 4 были группой IVB, а элементы группы 14 были группой IVA). В Европе буквенное обозначение было похожим, за исключением того, что «A» использовалось для групп с 1 по 7, а «B» — для групп с 11 по 17. Кроме того, группы 8, 9 и 10 рассматривались как одна группа тройного размера, известная в обеих нотациях как группа VIII. В 1988 году была введена в действие новая система наименований ИЮПАК (Международный союз теоретической и прикладной химии) (1–18), а старые названия групп (I–VIII) были отменены. [23]
32 столбца
18 столбцов
Из соображений экономии места [30] [31] периодическая таблица обычно представлена с вырезанными элементами f-блока и размещенными как отдельная часть под основным текстом. [32] [30] [23] Это уменьшает количество столбцов элементов с 32 до 18. [30]
Обе формы представляют одну и ту же периодическую таблицу. [6] Форма с f-блоком, включенным в основную часть, иногда называется 32-колоночной [6] или длинной формой; [33] форма с вырезанным f-блоком — 18-колоночной [6] или средне-длинной формой. [33] 32-колоночная форма имеет преимущество в том, что показывает все элементы в их правильной последовательности, но имеет недостаток в том, что требует больше места. [34] Выбранная форма является редакционным выбором и не подразумевает никаких изменений научного утверждения или заявления. Например, при обсуждении состава группы 3 варианты могут быть показаны одинаково (непредвзято) в обеих формах. [35]
Периодические таблицы обычно по крайней мере показывают символы элементов; многие также предоставляют дополнительную информацию об элементах либо с помощью цветового кодирования, либо в виде данных в ячейках. В приведенной выше таблице показаны названия и атомные номера элементов, а также их блоки, природные проявления и стандартные атомные веса . Для короткоживущих элементов без стандартных атомных весов вместо этого используется массовое число наиболее стабильного известного изотопа. Другие таблицы могут включать такие свойства, как состояние вещества, температуры плавления и кипения, плотности, а также предоставлять различные классификации элементов. [e]
Периодическая таблица представляет собой графическое описание периодического закона, [36] который гласит, что свойства и атомные структуры химических элементов являются периодической функцией их атомного номера . [37] Элементы размещены в периодической таблице в соответствии с их электронными конфигурациями , [38] периодические повторения которых объясняют тенденции изменения свойств по всей периодической таблице. [39]
Электрон можно рассматривать как находящийся на атомной орбитали , которая характеризует вероятность его нахождения в любой конкретной области вокруг атома. Их энергии квантуются , то есть они могут принимать только дискретные значения. Кроме того, электроны подчиняются принципу исключения Паули : разные электроны всегда должны находиться в разных состояниях. Это позволяет классифицировать возможные состояния, которые может занимать электрон на различных энергетических уровнях, известных как оболочки, разделенные на отдельные подоболочки, каждая из которых содержит одну или несколько орбиталей. Каждая орбиталь может содержать до двух электронов: они различаются величиной, известной как спин , традиционно обозначаемый как «вверх» или «вниз». [40] [f] В холодном атоме (один в своем основном состоянии) электроны располагаются таким образом, что общая энергия, которой они обладают, сводится к минимуму за счет занятия орбиталей с наименьшей доступной энергией. [42] Только самые внешние электроны (так называемые валентные электроны ) обладают достаточной энергией, чтобы вырваться из ядра и участвовать в химических реакциях с другими атомами. Остальные называются электронами ядра . [43]
Известны элементы, в которых заняты до семи первых оболочек. Первая оболочка содержит только одну орбиталь, сферическую s-орбиталь. Как и в первой оболочке, она называется 1s-орбиталью. Она может содержать до двух электронов. Вторая оболочка аналогично содержит 2s-орбиталь, а также три гантелеобразные 2p-орбитали и, таким образом, может заполнить до восьми электронов (2×1 + 2×3 = 8). Третья оболочка содержит одну 3s-орбиталь, три 3p-орбитали и пять 3d-орбиталей, и, таким образом, имеет емкость 2×1 + 2×3 + 2×5 = 18. Четвертая оболочка содержит одну 4s-орбиталь, три 4p-орбитали, пять 4d-орбиталей и семь 4f-орбиталей, что приводит к емкости 2×1 + 2×3 + 2×5 + 2×7 = 32. [30] Более высокие оболочки содержат больше типов орбиталей, которые продолжают шаблон, но такие типы орбиталей не заполнены в основных состояниях известных элементов. [45] Типы подоболочек характеризуются квантовыми числами . Четыре числа полностью описывают орбиталь в атоме: главное квантовое число n , азимутальное квантовое число ℓ (тип орбитали), орбитальное магнитное квантовое число m ℓ и спиновое магнитное квантовое число m s . [39]

Последовательность, в которой заполняются подоболочки, в большинстве случаев задается принципом Ауфбау , также известным как правило Маделунга или Клечковского (в честь Эрвина Маделунга и Всеволода Клечковского соответственно). Это правило впервые было эмпирически обнаружено Маделунгом, а Клечковский и более поздние авторы дали ему теоретическое обоснование. [46] [47] [48] [49] [g] Оболочки перекрываются по энергиям, и правило Маделунга определяет последовательность заполнения согласно: [47]
Здесь знак ≪ означает «намного меньше», в отличие от знака <, означающего просто «меньше». [47] Другими словами, электроны попадают на орбитали в порядке возрастания n + ℓ, и если доступны две орбитали с одинаковым значением n + ℓ, то первой будет занята орбиталь с меньшим n . [45] [49] В общем, орбитали с одинаковым значением n + ℓ схожи по энергии, но в случае s-орбиталей (с ℓ = 0) квантовые эффекты повышают их энергию, приближаясь к энергии следующей группы n + ℓ. Поэтому периодическая таблица обычно рисуется так, чтобы начинать каждую строку (часто называемую периодом) с заполнения новой s-орбитали, что соответствует началу новой оболочки. [47] [48] [30] Таким образом, за исключением первой строки, каждая длина периода появляется дважды: [47]
Перекрытия становятся довольно близкими в точке, где d-орбитали входят в картину, [50] и порядок может немного смещаться в зависимости от атомного номера [51] и атомного заряда. [52] [h]
Начиная с простейшего атома, это позволяет нам выстраивать периодическую таблицу по одному за раз в порядке атомного номера, рассматривая случаи отдельных атомов. В водороде есть только один электрон, который должен пойти на орбиталь с самой низкой энергией 1s. Эта электронная конфигурация записывается как 1s 1 , где верхний индекс указывает число электронов в подоболочке. Гелий добавляет второй электрон, который также идет в 1s, полностью заполняя первую оболочку и давая конфигурацию 1s 2 . [39] [58] [i]
Начиная с третьего элемента, лития , первая оболочка заполнена, поэтому его третий электрон занимает 2s-орбиталь, давая конфигурацию 1s 2 2s 1. 2s-электрон является единственным валентным электроном лития, так как 1s-подоболочка теперь слишком сильно связана с ядром, чтобы участвовать в химических связях с другими атомами: такая оболочка называется « основной оболочкой ». 1s-подоболочка является основной оболочкой для всех элементов, начиная с лития. 2s-подоболочка завершается следующим элементом бериллием (1s 2 2s 2 ). Затем следующие элементы продолжают заполнять 2p-подоболочку. Бор (1s 2 2s 2 2p 1 ) помещает свой новый электрон на 2p-орбиталь; углерод (1s 2 2s 2 2p 2 ) заполняет вторую 2p-орбиталь; и с азотом (1s 2 2s 2 2p 3 ) все три 2p-орбитали становятся поодиночке занятыми. Это согласуется с правилом Хунда , которое гласит, что атомы обычно предпочитают поодиночке занимать каждую орбиталь одного типа, прежде чем заполнить их вторым электроном. Кислород (1s 2 2s 2 2p 4 ), фтор (1s 2 2s 2 2p 5 ) и неон (1s 2 2s 2 2p 6 ) затем дополняют уже поодиночке заполненные 2p-орбитали; последняя из них полностью заполняет вторую оболочку. [39] [58]
Начиная с элемента 11, натрия , вторая оболочка заполнена, что делает вторую оболочку основной оболочкой для этого и всех более тяжелых элементов. Одиннадцатый электрон начинает заполнение третьей оболочки, занимая 3s-орбиталь, давая конфигурацию 1s 2 2s 2 2p 6 3s 1 для натрия. Эта конфигурация сокращенно обозначается [Ne] 3s 1 , где [Ne] представляет конфигурацию неона. Магний ([Ne] 3s 2 ) завершает эту 3s-орбиталь, а следующие шесть элементов алюминий , кремний , фосфор , сера , хлор и аргон заполняют три 3p-орбитали ([Ne] 3s 2 3p 1 через [Ne] 3s 2 3p 6 ). [39] [58] Это создает аналогичный ряд, в котором внешние структуры оболочек от натрия до аргона аналогичны структурам от лития до неона, и является основой периодичности химических свойств, которую иллюстрирует периодическая таблица: [39] при регулярных, но изменяющихся интервалах атомных номеров свойства химических элементов приблизительно повторяются. [36]
Таким образом, первые восемнадцать элементов можно расположить в начале периодической таблицы. Элементы в одном столбце имеют одинаковое количество валентных электронов и имеют аналогичные конфигурации валентных электронов: эти столбцы называются группами. Единственным исключением является гелий, который имеет два валентных электрона, как бериллий и магний, но обычно помещается в столбец неона и аргона, чтобы подчеркнуть, что его внешняя оболочка заполнена. (Некоторые современные авторы подвергают сомнению даже это единственное исключение, предпочитая последовательно следовать валентным конфигурациям и помещать гелий над бериллием.) В этом фрагменте периодической таблицы восемь столбцов, что соответствует максимум восьми электронам внешней оболочки. [32] Период начинается, когда начинает заполняться новая оболочка. [30] Наконец, раскраска иллюстрирует блоки : элементы в s-блоке (окрашены в красный цвет) заполняют s-орбитали, в то время как элементы в p-блоке (окрашены в желтый цвет) заполняют p-орбитали. [30]
Начиная со следующего ряда, для калия и кальция подоболочка 4s имеет самую низкую энергию, и поэтому они ее заполняют. [39] [58] Калий добавляет один электрон к оболочке 4s ([Ar] 4s 1 ), а кальций затем дополняет ее ([Ar] 4s 2 ). Однако, начиная со скандия ([Ar] 3d 1 4s 2 ), подоболочка 3d становится следующей по величине энергии. Подоболочки 4s и 3d имеют примерно одинаковую энергию, и они конкурируют за заполнение электронов, и поэтому заполнение не совсем последовательно заполняет 3d-орбитали по одной за раз. Точный энергетический порядок 3d и 4s изменяется вдоль ряда, а также меняется в зависимости от того, сколько электронов удалено из атома. Например, из-за отталкивания между 3d-электронами и 4s-электронами у хрома энергетический уровень 4s становится немного выше, чем 3d, и поэтому для атома хрома становится выгоднее иметь конфигурацию [Ar] 3d 5 4s 1 , чем [Ar] 3d 4 4s 2 . Похожая аномалия возникает у меди , атом которой имеет конфигурацию [Ar] 3d 10 4s 1 , а не ожидаемую [Ar] 3d 9 4s 2 . [39] Это нарушения правила Маделунга. Такие аномалии, однако, не имеют никакого химического значения: [52] большая часть химии не касается изолированных газообразных атомов, [60] и различные конфигурации настолько близки по энергии друг к другу [50] , что присутствие соседнего атома может сместить баланс. [39] Поэтому периодическая таблица игнорирует их и рассматривает только идеализированные конфигурации. [38]
В цинке ([Ar] 3d 10 4s 2 ) 3d-орбитали полностью заполнены в общей сложности десятью электронами. [39] [58] Далее следуют 4p-орбитали, завершающие ряд, которые постепенно заполняются галлием ([Ar] 3d 10 4s 2 4p 1 ) через криптон ([Ar] 3d 10 4s 2 4p 6 ), аналогично предыдущим p-элементам. [39] [58] Начиная с галлия, 3d-орбитали образуют часть электронного ядра и больше не участвуют в химии. [57] Элементы s- и p-блоков, которые заполняют свои внешние оболочки, называются элементами главной группы ; элементы d-блока (окрашенные синим цветом ниже), которые заполняют внутреннюю оболочку, называются переходными элементами (или переходными металлами, поскольку все они являются металлами). [61]
Следующие восемнадцать элементов заполняют 5s-орбитали ( рубидий и стронций ), затем 4d ( от иттрия до кадмия , снова с несколькими аномалиями по пути), а затем 5p ( от индия до ксенона ). [30] [58] Опять же, начиная с индия, 4d-орбитали находятся в ядре. [58] [62] Следовательно, пятый ряд имеет ту же структуру, что и четвертый. [30]
Шестая строка таблицы также начинается с двух элементов s-блока: цезия и бария . [58] После этого начинают появляться первые элементы f-блока (окрашенные зеленым ниже), начиная с лантана . Иногда их называют внутренними переходными элементами. [61] Поскольку теперь существуют не только 4f-, но также 5d- и 6s-подоболочки с похожими энергиями, снова возникает конкуренция со многими нерегулярными конфигурациями; [50] это привело к некоторому спору о том, где именно должен начинаться f-блок, но большинство изучающих этот вопрос сходятся во мнении, что он начинается с лантана в соответствии с принципом Ауфбау. [27] Несмотря на то, что лантан сам по себе не заполняет 4f-подоболочку как отдельный атом, из-за отталкивания между электронами [52] его 4f-орбитали достаточно низки по энергии, чтобы участвовать в химии. [63] [53] [64] У иттербия семь 4f-орбиталей полностью заполнены четырнадцатью электронами; затем следует ряд из десяти переходных элементов ( от лютеция до ртути ) [58] [65] [66] [67] и, наконец, шесть элементов главной группы ( от таллия до радона ) завершают период. [58] [68] Начиная с лютеция, 4f-орбитали находятся в ядре, [58] [64] а начиная с таллия, то же самое происходит и с 5d-орбиталями. [58] [57] [69]
Седьмой ряд аналогичен шестому: 7s заполняет ( франций и радий ), затем 5f ( актиний до нобелия ), затем 6d ( лоуренсий до коперниция ) и, наконец, 7p ( нихоний до оганесона ). [58] Начиная с лоуренсия, 5f-орбитали находятся в ядре, [58] и, вероятно, 6d-орбитали присоединяются к ядру, начиная с нихония. [58] [70] [j] Опять же, по пути есть несколько аномалий: [30] например, как отдельные атомы, ни актиний, ни торий фактически не заполняют подоболочку 5f, а лоуренсий не заполняет оболочку 6d, но все эти подоболочки все еще могут заполняться в химических средах. [72] [73] [74] В течение очень долгого времени седьмой ряд был неполным, поскольку большинство его элементов не встречаются в природе. Недостающие элементы после урана начали синтезировать в лабораторных условиях в 1940 году, когда был получен нептуний. [75] (Однако первым элементом, который был открыт путем синтеза, а не в природе, был технеций в 1937 году.) Ряд был завершен синтезом теннессина в 2010 году [76] (последний элемент оганесон уже был получен в 2002 году), [77] а последние элементы в этом седьмом ряду получили названия в 2016 году. [78]
Это завершает современную периодическую таблицу, в которой все семь рядов полностью заполнены. [78]
В следующей таблице показана электронная конфигурация нейтрального атома газофазы каждого элемента. Различные конфигурации могут быть предпочтительны в различных химических средах. [52] Элементы основной группы имеют полностью регулярные электронные конфигурации; переходные и внутренние переходные элементы показывают двадцать нерегулярностей из-за вышеупомянутой конкуренции между подоболочками, близкими по уровню энергии. Для последних десяти элементов (109–118) экспериментальные данные отсутствуют [79] , поэтому вместо них показаны расчетные конфигурации. [80] Полностью заполненные подоболочки выделены серым цветом.
Хотя современная периодическая таблица сегодня является стандартной, размещение элементов периода 1 водорода и гелия остается открытым вопросом для обсуждения, и можно найти некоторые вариации. [57] [81] Согласно их соответствующим электронным конфигурациям s 1 и s 2 , водород будет помещен в группу 1, а гелий будет помещен в группу 2. [57] Размещение водорода в группе 1 является обычным, но гелий почти всегда помещается в группу 18 вместе с другими благородными газами. [6] Дебаты связаны с противоречивым пониманием того, в какой степени химические или электронные свойства должны определять размещение в периодической таблице. [81]
Как и металлы группы 1, водород имеет один электрон на своей внешней оболочке [82] и обычно теряет свой единственный электрон в химических реакциях. [83] Водород обладает некоторыми металлическими химическими свойствами, будучи способным вытеснять некоторые металлы из их солей . [83] Но он образует двухатомный неметаллический газ при стандартных условиях, в отличие от щелочных металлов, которые являются реакционноспособными твердыми металлами. Это и образование водородом гидридов , в которых он получает электрон, приближают его к свойствам галогенов , которые делают то же самое [83] (хотя водород реже образует H − , чем H + ). [84] Более того, два самых легких галогена ( фтор и хлор ) являются газообразными, как водород при стандартных условиях. [83] Некоторые свойства водорода не подходят ни для одной из групп: водород не является ни сильно окислительным, ни сильно восстановительным и не реагирует с водой. [84] Таким образом, водород обладает свойствами, соответствующими как свойствам щелочных металлов, так и галогенов, но не соответствует ни одной из групп идеально, и поэтому его трудно разместить по его химии. [83] Таким образом, в то время как электронное размещение водорода в группе 1 преобладает, некоторые более редкие расположения показывают либо водород в группе 17, [85] дублирующий водород в обеих группах 1 и 17, [86] [87] или плавающий отдельно от всех групп. [87] [88] [57] Этот последний вариант, тем не менее, подвергся критике со стороны химика и философа науки Эрика Шерри на том основании, что он, по-видимому, подразумевает, что водород находится выше периодического закона в целом, в отличие от всех других элементов. [89]
Гелий — единственный элемент, который обычно занимает положение в периодической таблице, не соответствующее его электронной структуре. У него два электрона на внешней оболочке, тогда как у других благородных газов их восемь; и он является элементом s-блока, тогда как все остальные благородные газы являются элементами p-блока. Однако он нереакционноспособен при стандартных условиях и имеет полную внешнюю оболочку: эти свойства похожи на свойства благородных газов в группе 18, но совсем не похожи на свойства реактивных щелочноземельных металлов группы 2. По этим причинам гелий почти повсеместно помещается в группу 18 [6] , которой лучше всего соответствуют его свойства; [57] предложение переместить гелий в группу 2 было отклонено ИЮПАК в 1988 году по этим причинам. [23] Тем не менее, гелий до сих пор иногда помещают в группу 2, [90] и некоторые его физические и химические свойства ближе к элементам группы 2 и поддерживают электронное размещение. [82] [57] Твердый гелий кристаллизуется в гексагональной плотноупакованной структуре, которая соответствует бериллию и магнию в группе 2, но не другим благородным газам в группе 18. [91] Недавние теоретические разработки в области химии благородных газов, в которых ожидается, что гелий проявит немного меньшую инертность, чем неон, и образует (HeO)(LiF) 2 со структурой, похожей на аналогичное соединение бериллия (но без ожидаемого аналога неона), привели к тому, что больше химиков выступают за размещение гелия в группе 2. Это относится к электронному аргументу, поскольку причиной большей инертности неона является отталкивание от его заполненной p-оболочки, которой нет у гелия, хотя реалистично маловероятно, что молекулы, содержащие гелий, будут стабильны за пределами экстремально низких температурных условий (около 10 К ). [92] [93] [94] [95]
Аномалия первой строки в периодической таблице дополнительно была упомянута в поддержку перемещения гелия в группу 2. Она возникает из-за того, что первая орбиталь любого типа необычно мала, поскольку в отличие от своих высших аналогов она не испытывает межэлектронного отталкивания от меньшей орбитали того же типа. Это делает первую строку элементов в каждом блоке необычно маленькой, и такие элементы имеют тенденцию демонстрировать характерные виды аномалий для своей группы. Некоторые химики, выступающие за изменение положения гелия, указали, что гелий демонстрирует эти аномалии, если он помещен в группу 2, но не если он помещен в группу 18: с другой стороны, неон, который был бы первым элементом группы 18, если бы гелий был удален из этого места, действительно демонстрирует эти аномалии. [92] Затем утверждается, что связь между гелием и бериллием напоминает связь между водородом и литием, размещение, которое является гораздо более общепринятым. [93] Например, из-за этой тенденции в размерах орбиталей большая разница в атомных радиусах между первым и вторым членами каждой основной группы наблюдается в группах 1 и 13–17: она существует между неоном и аргоном, а также между гелием и бериллием, но не между гелием и неоном. Это аналогичным образом влияет на точки кипения и растворимость благородных газов в воде, где гелий слишком близок к неону, а большая разница, характерная для первых двух элементов группы, проявляется только между неоном и аргоном. Перемещение гелия в группу 2 делает эту тенденцию последовательной также в группах 2 и 18, делая гелий первым элементом группы 2, а неон первым элементом группы 18: оба демонстрируют характерные свойства кайносимметричного первого элемента группы. [96] [97] Тем не менее, размещение гелия в группе 18 остается почти универсальным из-за его крайней инертности. [98] Кроме того, таблицы, в которых водород и гелий находятся вне всех групп, встречаются редко. [88] [57] [58]
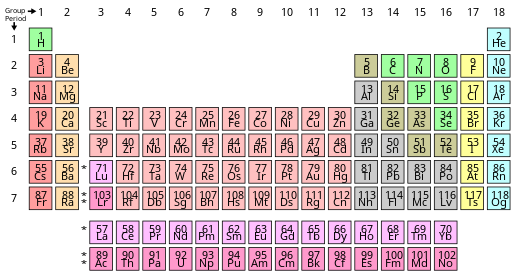
Во многих периодических таблицах f-блок смещен на один элемент вправо, так что лантан и актиний становятся элементами d-блока в группе 3, а Ce–Lu и Th–Lr образуют f-блок. Таким образом, d-блок разделен на две очень неровные части. Это пережиток ранних ошибочных измерений электронных конфигураций; современные измерения больше соответствуют форме с лютецием и лоуренсием в группе 3, и с La–Yb и Ac–No в качестве f-блока. [25] [99]
У иттербия оболочка 4f полностью заполнена, и по этой причине Лев Ландау и Евгений Лифшиц в 1948 году посчитали некорректным группировать лютеций как элемент f-блока. [26] Они еще не предприняли шаг по удалению лантана из d-блока, но Джун Кондо понял в 1963 году, что низкотемпературная сверхпроводимость лантана подразумевает активность его оболочки 4f. [100] В 1965 году Дэвид С. Гамильтон связал это наблюдение с его положением в периодической таблице и утверждал, что f-блок должен состоять из элементов La–Yb и Ac–No. [63] С тех пор физические, химические и электронные доказательства подтверждают это назначение. [25] [23] [99] Проблема была привлечена к широкому вниманию Уильямом Б. Дженсеном в 1982 году, [25] а перераспределение лютеция и лоуренсия в группу 3 было поддержано отчетами ИЮПАК, датированными 1988 годом (когда были рекомендованы номера групп 1–18) [23] и 2021 годом. [24] Тем не менее, вариация все еще существует, поскольку большинство авторов учебников не знают об этой проблеме. [25]
Иногда можно встретить третью форму, в которой пробелы под иттрием в группе 3 остаются пустыми, как, например, в таблице, представленной на веб-сайте ИЮПАК [6] , но это создает несоответствие с квантовой механикой, делая f-блок шириной 15 элементов (La–Lu и Ac–Lr), хотя в f-подоболочке может поместиться только 14 электронов. [24] Кроме того, в литературе существует некоторая путаница в отношении того, какие элементы затем подразумеваются как находящиеся в группе 3. [24] [33] [101] [102] [103] Хотя в отчете ИЮПАК 2021 года отмечалось, что f-блоки шириной 15 элементов поддерживаются некоторыми специалистами специализированной ветви релятивистской квантовой механики, сосредоточенными на свойствах сверхтяжелых элементов , мнение проекта состояло в том, что такие зависящие от интересов опасения не должны иметь никакого отношения к тому, как периодическая таблица представляется «общему химическому и научному сообществу». [24] Другие авторы, сосредоточившиеся на сверхтяжелых элементах, с тех пор пояснили, что «15-я запись f-блока представляет собой первый слот d-блока, который остается вакантным, чтобы указать место вставок f-блока», что подразумевает, что эта форма все еще имеет лютеций и лоуренсий (15-я запись, о которой идет речь) как элементы d-блока в группе 3. [104] Действительно, когда публикации ИЮПАК расширяют таблицу до 32 столбцов, они ясно дают это понять и помещают лютеций и лоуренсий под иттрием в группе 3. [105] [106]
В литературе можно встретить несколько аргументов в пользу Sc-Y-La-Ac, [107] [108], но они были оспорены как логически непоследовательные. [27] [28] [29] Например, утверждалось, что лантан и актиний не могут быть элементами f-блока, поскольку как отдельные атомы в газовой фазе они не начали заполнять f-подоболочки. [109] Но то же самое верно и для тория, который никогда не оспаривался как элемент f-блока, [24] [25] и этот аргумент упускает из виду проблему с другой стороны: что f-оболочки полностью заполняются у иттербия и нобелия, что соответствует форме Sc-Y-Lu-Lr, а не у лютеция и лоуренсия, как это было бы в форме Sc-Y-La-Ac. [110] Такие исключительные конфигурации не только встречаются в меньшинстве, [110] но они также никогда не рассматривались как имеющие отношение к позиционированию любых других элементов в периодической таблице: в газообразных атомах d-оболочки завершают свое заполнение на меди, палладии и золоте, но химики общепризнанно считают, что эти конфигурации являются исключительными и что d-блок действительно заканчивается в соответствии с правилом Маделунга на цинке, кадмии и ртути. [33] Соответствующим фактом для размещения [38] [65] является то, что лантан и актиний (как и торий) имеют валентные f-орбитали, которые могут быть заняты в химических средах, тогда как лютеций и лоуренсий этого не делают: [58] [111] [74] их f-оболочки находятся в ядре и не могут использоваться для химических реакций. [64] [112] Таким образом, связь между иттрием и лантаном является лишь вторичной связью между элементами с одинаковым числом валентных электронов, но разными типами валентных орбиталей, например, между хромом и ураном; тогда как связь между иттрием и лютецием является первичной, разделяющей как число валентных электронов, так и тип валентной орбитали. [58]
Поскольку химические реакции включают валентные электроны, [32] можно ожидать, что элементы с похожими внешними электронными конфигурациями будут реагировать аналогично и образовывать соединения с похожими пропорциями элементов в них. [113] Такие элементы помещаются в одну и ту же группу, и, таким образом, по мере продвижения вниз по группе, как правило, наблюдаются явные сходства и тенденции в химическом поведении. [114] Поскольку аналогичные конфигурации встречаются через регулярные интервалы, свойства элементов, таким образом, демонстрируют периодические повторения, отсюда и название периодической таблицы и периодического закона. Эти периодические повторения были замечены задолго до того, как была разработана лежащая в основе теория, объясняющая их. [115] [116]
Исторически физический размер атомов был неизвестен до начала 20-го века. Первая расчетная оценка атомного радиуса водорода была опубликована физиком Артуром Хаасом в 1910 году с точностью до порядка величины (множитель 10) от принятого значения, радиуса Бора (~0,529 Å). В своей модели Хаас использовал одноэлектронную конфигурацию, основанную на классической атомной модели, предложенной Дж. Дж. Томсоном в 1904 году, часто называемой моделью сливового пудинга . [117]
Атомные радиусы (размеры атомов) зависят от размеров их самых внешних орбиталей. [96] Они обычно уменьшаются слева направо вдоль элементов главной группы, потому что ядерный заряд увеличивается, но внешние электроны все еще находятся в той же оболочке. Однако, спускаясь вниз по столбцу, радиусы обычно увеличиваются, потому что самые внешние электроны находятся в более высоких оболочках, которые, таким образом, находятся дальше от ядра. [32] [118] Первая строка каждого блока аномально мала из-за эффекта, называемого кайносимметрией или примогенным отталкиванием: [119] подоболочки 1s, 2p, 3d и 4f не имеют внутренних аналогов. Например, 2p-орбитали не испытывают сильного отталкивания от 1s- и 2s-орбиталей, которые имеют совершенно разные угловые распределения заряда и, следовательно, не очень велики; но 3p-орбитали испытывают сильное отталкивание от 2p-орбиталей, которые имеют схожие угловые распределения заряда. Таким образом, более высокие s-, p-, d- и f-подоболочки испытывают сильное отталкивание от своих внутренних аналогов, которые имеют примерно такое же угловое распределение заряда, и должны расширяться, чтобы избежать этого. Это приводит к возникновению значительных различий между малыми 2p-элементами, которые предпочитают множественную связь , и более крупными 3p и более высокими p-элементами, которые этого не делают. [96] Аналогичные аномалии возникают для 1s, 2p, 3d, 4f и гипотетических 5g-элементов: [120] степень этой аномалии первой строки является самой высокой для s-блока, умеренной для p-блока и менее выраженной для d- и f-блоков. [121]
В переходных элементах внутренняя оболочка заполняется, но размер атома по-прежнему определяется внешними электронами. Увеличение заряда ядра по всей серии и увеличение числа внутренних электронов для экранирования в некоторой степени компенсируют друг друга, поэтому уменьшение радиуса меньше. [118] Атомы 4p и 5d, появляющиеся сразу после того, как впервые вводятся новые типы переходных серий, меньше, чем можно было бы ожидать, [122] потому что добавленные основные подоболочки 3d и 4f обеспечивают лишь неполное экранирование заряда ядра для внешних электронов. Поэтому, например, атомы галлия немного меньше атомов алюминия. [96] Вместе с кайносимметрией это приводит к четно-нечетной разнице между периодами (за исключением s-блока) [k] , что иногда называют вторичной периодичностью: элементы в четных периодах имеют меньшие атомные радиусы и предпочитают терять меньше электронов, в то время как элементы в нечетных периодах (за исключением первого) отличаются в противоположном направлении. Так, например, многие свойства в p-блоке показывают зигзагообразную, а не плавную тенденцию вдоль группы. Например, фосфор и сурьма в нечетных периодах группы 15 легко достигают степени окисления +5, тогда как азот, мышьяк и висмут в четных периодах предпочитают оставаться на уровне +3. [121] [123] Похожая ситуация имеет место для d-блока, где атомы лютеция через вольфрам немного меньше атомов иттрия через молибден соответственно. [124] [125]

Атомы таллия и свинца примерно такого же размера, как атомы индия и олова соответственно, но от висмута до радона атомы 6p больше, чем аналогичные атомы 5p. Это происходит потому, что когда атомные ядра становятся сильно заряженными, специальная теория относительности становится необходимой для оценки влияния ядра на электронное облако. Эти релятивистские эффекты приводят к тому, что тяжелые элементы все больше и больше обладают разными свойствами по сравнению с их более легкими гомологами в периодической таблице. Спин-орбитальное взаимодействие расщепляет p-подоболочку: одна p-орбиталь релятивистски стабилизируется и сжимается (она заполняет таллий и свинец), но две другие (заполняющие висмут через радон) релятивистски дестабилизируются и расширяются. [96] Релятивистские эффекты также объясняют, почему золото является золотым, а ртуть является жидкой при комнатной температуре. [126] [127] Ожидается, что они станут очень сильными в конце седьмого периода, что потенциально приведет к коллапсу периодичности. [128] Электронные конфигурации четко известны только до элемента 108 ( хассий ), а экспериментальная химия после 108 была проведена только для 112 ( коперниций ), 113 ( нихоний ) и 114 ( флеровий ), поэтому химическая характеристика самых тяжелых элементов остается темой текущих исследований. [129]
Тенденция к уменьшению атомных радиусов слева направо также присутствует в ионных радиусах , хотя ее сложнее исследовать, поскольку наиболее распространенные ионы последовательных элементов обычно различаются по заряду. Ионы с одинаковой электронной конфигурацией уменьшаются в размере по мере увеличения их атомного номера из-за увеличения притяжения со стороны более положительно заряженного ядра: так, например, ионные радиусы уменьшаются в ряду Se 2− , Br − , Rb + , Sr 2+ , Y 3+ , Zr 4+ , Nb 5+ , Mo 6+ , Tc 7+ . Ионы одного и того же элемента становятся меньше по мере удаления большего количества электронов, поскольку притяжение со стороны ядра начинает перевешивать отталкивание между электронами, что заставляет электронные облака расширяться: так, например, ионные радиусы уменьшаются в ряду V 2+ , V 3+ , V 4+ , V 5+ . [130]

Первая энергия ионизации атома — это энергия, необходимая для удаления из него электрона. Она меняется в зависимости от радиуса атома: энергия ионизации увеличивается слева направо и снизу вверх, поскольку электроны, которые находятся ближе к ядру, удерживаются более прочно и их труднее удалить. Таким образом, энергия ионизации минимизируется в первом элементе каждого периода — водороде и щелочных металлах — и затем, как правило, увеличивается, пока не достигнет благородного газа на правом краю периода. [32] Существуют некоторые исключения из этой тенденции, такие как кислород, где удаляемый электрон является парным, и, таким образом, межэлектронное отталкивание делает его удаление более легким, чем ожидалось. [131]
В переходной серии внешние электроны преимущественно теряются, хотя внутренние орбитали заполняются. Например, в 3d серии 4s-электроны теряются первыми, хотя 3d-орбитали заполняются. Экранирующий эффект добавления дополнительного 3d-электрона приблизительно компенсирует рост заряда ядра, и поэтому энергии ионизации остаются в основном постоянными, хотя есть небольшое увеличение, особенно в конце каждой переходной серии. [132]
Поскольку атомы металлов имеют тенденцию терять электроны в химических реакциях, энергия ионизации, как правило, коррелирует с химической реактивностью, хотя есть и другие факторы, которые также участвуют. [132]
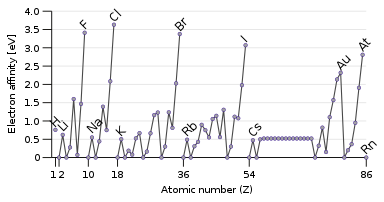
Противоположным свойством энергии ионизации является электронное сродство , которое представляет собой энергию, высвобождаемую при добавлении электрона к атому. [133] Проходящий электрон будет легче притягиваться к атому, если он сильнее чувствует притяжение ядра, и особенно если есть доступная частично заполненная внешняя орбиталь, которая может его вместить. Поэтому электронное сродство имеет тенденцию увеличиваться снизу вверх и слева направо. Исключением является последний столбец, благородные газы, которые имеют полную оболочку и не имеют места для другого электрона. Это дает галогенам в предпоследнем столбце самые высокие электронные сродства. [32]
Некоторые атомы, такие как благородные газы, не имеют сродства к электрону: они не могут образовывать стабильные анионы в газовой фазе. [134] (Они могут образовывать метастабильные резонансы , если входящий электрон имеет достаточную кинетическю энергию, но они неизбежно и быстро самоотщепляются : например, время жизни самого долгоживущего уровня He − составляет около 359 микросекунд.) [135] Благородные газы, имеющие высокие энергии ионизации и не имеющие сродства к электрону, имеют небольшую склонность к получению или потере электронов и, как правило, нереакционноспособны. [32]
Встречаются некоторые исключения из тенденций: кислород и фтор имеют более низкое сродство к электрону, чем их более тяжелые гомологи сера и хлор, потому что они являются небольшими атомами, и, следовательно, вновь добавленный электрон будет испытывать значительное отталкивание от уже имеющихся. Для неметаллических элементов сродство к электрону также в некоторой степени коррелирует с реакционной способностью, но не идеально, поскольку задействованы другие факторы. Например, фтор имеет более низкое сродство к электрону, чем хлор (из-за чрезвычайного межэлектронного отталкивания для очень маленького атома фтора), но более реакционноспособен. [133]
Валентность элемента может быть определена либо как число атомов водорода, которые могут соединиться с ним, образуя простой бинарный гидрид, либо как удвоенное число атомов кислорода, которые могут соединиться с ним, образуя простой бинарный оксид (то есть не пероксид или супероксид ) . [ 110] Валентности элементов главной группы напрямую связаны с номером группы: гидриды в главных группах 1–2 и 13–17 следуют формулам MH, MH 2 , MH 3 , MH 4 , MH 3 , MH 2 и, наконец, MH. Вместо этого высшие оксиды увеличивают валентность, следуя формулам M 2 O, MO, M 2 O 3 , MO 2 , M 2 O 5 , MO 3 , M 2 O 7 . [l] Сегодня понятие валентности было расширено понятием степени окисления , которая представляет собой формальный заряд, оставшийся на элементе, когда все другие элементы в соединении были удалены в виде их ионов. [113]
Электронная конфигурация предлагает готовое объяснение из числа электронов, доступных для связывания; [113] действительно, число валентных электронов начинается с 1 в группе 1, а затем увеличивается к правой стороне периодической таблицы, сбрасываясь до 3 всякий раз, когда начинается каждый новый блок. Таким образом, в периоде 6 Cs–Ba имеют 1–2 валентных электрона; La–Yb имеют 3–16; Lu–Hg имеют 3–12; и Tl–Rn имеют 3–8. [112] Однако, по направлению к правой стороне d- и f-блоков, теоретический максимум, соответствующий использованию всех валентных электронов, вообще недостижим; [136] та же ситуация влияет на кислород, фтор и легкие благородные газы вплоть до криптона. [137]
Полное объяснение требует рассмотрения энергии, которая будет выделяться при образовании соединений с различной валентностью, а не просто рассмотрения только электронных конфигураций. [138] Например, магний образует катионы Mg2 +, а не Mg + при растворении в воде, потому что последний спонтанно диспропорционирует на катионы Mg0 и Mg2+. Это происходит потому, что энтальпия гидратации ( окружение катиона молекулами воды) увеличивается по величине с зарядом и радиусом иона. В Mg + самая внешняя орбиталь (которая определяет ионный радиус) по-прежнему равна 3s, поэтому энтальпия гидратации мала и недостаточна для компенсации энергии, необходимой для удаления электрона; но повторная ионизация до Mg2 + раскрывает ядро 2p подоболочки, делая энтальпию гидратации достаточно большой, чтобы позволить образоваться соединениям магния(II). По аналогичным причинам общие состояния окисления более тяжелых элементов p-блока (где ns-электроны становятся ниже по энергии, чем np) имеют тенденцию изменяться с шагом 2, поскольку это необходимо для раскрытия внутренней подоболочки и уменьшения ионного радиуса (например, Tl + раскрывает 6s, а Tl 3+ раскрывает 5d, поэтому как только таллий теряет два электрона, он имеет тенденцию терять и третий). Аналогичные аргументы, основанные на орбитальной гибридизации, можно использовать для менее электроотрицательных элементов p-блока. [139] [m]

Для переходных металлов общие степени окисления почти всегда составляют не менее +2 по аналогичным причинам (раскрытие следующей подоболочки); это справедливо даже для металлов с аномальными конфигурациями d x+1 s 1 или d x+2 s 0 (за исключением серебра ), поскольку отталкивание между d-электронами означает, что перемещение второго электрона из s- в d-подоболочку не изменяет заметно его энергию ионизации. [141] Поскольку дальнейшая ионизация переходных металлов не раскрывает никаких новых внутренних подоболочек, их степени окисления, как правило, изменяются с шагом 1 вместо этого. [139] Лантаноиды и поздние актиноиды обычно показывают стабильную степень окисления +3, удаляя внешние s-электроны, а затем (обычно) один электрон из (n−2)f-орбиталей, которые по энергии близки к ns. [142] Общие и максимальные степени окисления d- и f-элементов, как правило, зависят от энергий ионизации. По мере того, как разница в энергии между (n−1)d- и ns-орбиталями увеличивается вдоль каждой серии переходов, становится менее энергетически выгодным ионизировать дальнейшие электроны. Таким образом, группы ранних переходных металлов, как правило, предпочитают более высокие степени окисления, но степень окисления +2 становится более стабильной для групп поздних переходных металлов. Таким образом, наивысшая формальная степень окисления увеличивается с +3 в начале каждого ряда d-блоков до +7 или +8 в середине (например, OsO 4 ), а затем уменьшается до +2 в конце. [141] Лантаноиды и поздние актиноиды обычно имеют высокие четвертые энергии ионизации и, следовательно, редко превосходят степень окисления +3, тогда как ранние актиноиды имеют низкие четвертые энергии ионизации и, например, нептуний и плутоний могут достигать +7. [110] [141] [142] Самые последние актиноиды идут дальше лантаноидов в направлении низких степеней окисления: менделевий легче восстанавливается до состояния +2, чем тулий или даже европий (лантаноид с наиболее стабильным состоянием +2 из-за его полузаполненной f-оболочки), а нобелий явно предпочитает +2, чем +3, в отличие от иттербия. [54]
Поскольку элементы в одной группе имеют одинаковые валентные конфигурации, они обычно демонстрируют схожее химическое поведение. Например, все щелочные металлы в первой группе имеют один валентный электрон и образуют очень однородный класс элементов: все они являются мягкими и реактивными металлами. Однако здесь задействовано много факторов, и группы часто могут быть довольно неоднородными. Например, водород также имеет один валентный электрон и находится в той же группе, что и щелочные металлы, но его химическое поведение совершенно иное. Стабильные элементы группы 14 включают неметалл ( углерод ), два полупроводника ( кремний и германий ) и два металла ( олово и свинец ); тем не менее, они объединены наличием четырех валентных электронов. [143] Это часто приводит к сходству в максимальных и минимальных степенях окисления (например, сера и селен в группе 16 оба имеют максимальную степень окисления +6, как в SO 3 и SeO 3 , и минимальную степень окисления −2, как в сульфидах и селенидах ); но не всегда (например, кислород не образует степень окисления +6, несмотря на то, что находится в той же группе, что и сера и селен). [58]

Другим важным свойством элементов является их электроотрицательность . Атомы могут образовывать ковалентные связи друг с другом, разделяя электроны попарно, создавая перекрытие валентных орбиталей. Степень, в которой каждый атом притягивает общую электронную пару, зависит от электроотрицательности атома [144] – тенденции атома к получению или потере электронов. [32] Более электроотрицательный атом будет стремиться притягивать электронную пару больше, а менее электроотрицательный (или более электроположительный) будет притягивать ее меньше. В крайних случаях электрон можно считать полностью переданным от более электроположительного атома к более электроотрицательному, хотя это упрощение. Затем связь связывает два иона, один положительный (отдавший электрон) и один отрицательный (принявший его), и называется ионной связью . [32]
Электроотрицательность зависит от того, насколько сильно ядро может притягивать электронную пару, и поэтому она демонстрирует похожее изменение с другими свойствами, которые уже обсуждались: электроотрицательность имеет тенденцию падать сверху вниз и расти слева направо. Щелочные и щелочноземельные металлы являются одними из самых электроположительных элементов, в то время как халькогены, галогены и благородные газы являются одними из самых электроотрицательных. [144]
Электроотрицательность обычно измеряется по шкале Полинга, по которой наиболее электроотрицательному реактивному атому ( фтору ) присваивается электроотрицательность 4,0, а наименее электроотрицательному атому ( цезию ) присваивается электроотрицательность 0,79. [32] Фактически неон является наиболее электроотрицательным элементом, но шкала Полинга не позволяет измерить его электроотрицательность, поскольку он не образует ковалентных связей с большинством элементов. [145]
Электроотрицательность элемента меняется в зависимости от идентичности и количества атомов, с которыми он связан, а также от того, сколько электронов он уже потерял: атом становится более электроотрицательным, когда он потерял больше электронов. [144] Иногда это имеет большое значение: свинец в степени окисления +2 имеет электроотрицательность 1,87 по шкале Полинга, тогда как свинец в степени окисления +4 имеет электроотрицательность 2,33. [146]

Простое вещество — это вещество, образованное из атомов одного химического элемента. Простые вещества с более электроотрицательными атомами имеют тенденцию делиться электронами (образовывать ковалентные связи) друг с другом. Они образуют либо небольшие молекулы (например, водород или кислород, атомы которых связаны парами), либо гигантские структуры, простирающиеся до бесконечности (например, углерод или кремний). Благородные газы просто остаются отдельными атомами, поскольку у них уже есть полная оболочка. [32] Вещества, состоящие из дискретных молекул или отдельных атомов, удерживаются вместе более слабыми силами притяжения между молекулами, такими как сила дисперсии Лондона : когда электроны движутся внутри молекул, они создают кратковременные дисбалансы электрического заряда, которые вызывают аналогичные дисбалансы в соседних молекулах и создают синхронизированные движения электронов через множество соседних молекул. [148]

Однако более электроположительные атомы, как правило, вместо этого теряют электроны, создавая «море» электронов, поглощающих катионы. [32] Внешние орбитали одного атома перекрываются, чтобы делиться электронами со всеми его соседями, создавая гигантскую структуру молекулярных орбиталей, простирающуюся на все атомы. [149] Это отрицательно заряженное «море» притягивает все ионы и удерживает их вместе в металлической связи . Элементы, образующие такие связи, часто называют металлами ; те, которые этого не делают, часто называют неметаллами . [32] Некоторые элементы могут образовывать несколько простых веществ с различными структурами: они называются аллотропами . Например, алмаз и графит являются двумя аллотропами углерода. [143] [n]
Металличность элемента можно предсказать по электронным свойствам. Когда атомные орбитали перекрываются во время металлической или ковалентной связи, они создают как связывающие, так и разрыхляющие молекулярные орбитали равной емкости, причем разрыхляющие орбитали имеют более высокую энергию. Чистый характер связи возникает, когда на связывающих орбиталях больше электронов, чем на разрыхляющих орбиталях. Таким образом, металлическая связь возможна, когда число электронов, делокализованных каждым атомом, меньше, чем в два раза больше числа орбиталей, способствующих перекрытию. Такая ситуация наблюдается для элементов в группах с 1 по 13; у них также слишком мало валентных электронов, чтобы образовывать гигантские ковалентные структуры, в которых все атомы занимают эквивалентные положения, и поэтому почти все они металлизируются. Исключениями являются водород и бор, которые имеют слишком высокую энергию ионизации. Таким образом, водород образует ковалентную молекулу H 2 , а бор образует гигантскую ковалентную структуру на основе икосаэдрических кластеров B 12 . В металле связывающие и разрыхляющие орбитали имеют перекрывающиеся энергии, создавая единую зону, через которую электроны могут свободно проходить, обеспечивая электрическую проводимость. [151]
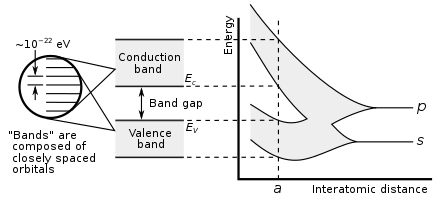
В группе 14 становятся возможными как металлические, так и ковалентные связи. В кристалле алмаза ковалентные связи между атомами углерода сильны, поскольку они имеют малый атомный радиус, и, таким образом, ядро сильнее удерживает электроны. Поэтому образующиеся связывающие орбитали имеют гораздо меньшую энергию, чем антисвязывающие орбитали, и перекрытия нет, поэтому электрическая проводимость становится невозможной: углерод является неметаллом. Однако ковалентная связь ослабевает для более крупных атомов, и энергетический зазор между связывающими и антисвязывающими орбиталями уменьшается. Поэтому кремний и германий имеют меньшие запрещенные зоны и являются полупроводниками при условиях окружающей среды: электроны могут пересекать щель при термическом возбуждении. (Бор также является полупроводником при условиях окружающей среды.) Запрещенная зона исчезает в олове, поэтому олово и свинец становятся металлами. [151] По мере повышения температуры все неметаллы приобретают некоторые полупроводниковые свойства, в большей или меньшей степени в зависимости от размера запрещенной зоны. Таким образом, металлы и неметаллы можно различить по температурной зависимости их электропроводности: проводимость металла снижается с ростом температуры (потому что тепловое движение затрудняет свободный поток электронов), тогда как проводимость неметалла возрастает (поскольку больше электронов могут быть возбуждены для пересечения зазора). [152]
Элементы в группах с 15 по 17 имеют слишком много электронов, чтобы образовывать гигантские ковалентные молекулы, которые простираются во всех трех измерениях. Для более легких элементов связи в небольших двухатомных молекулах настолько сильны, что конденсированная фаза неблагоприятна: так, азот (N 2 ), кислород (O 2 ), белый фосфор и желтый мышьяк (P 4 и As 4 ), сера и красный селен (S 8 и Se 8 ), а также стабильные галогены (F 2 , Cl 2 , Br 2 и I 2 ) легко образуют ковалентные молекулы с небольшим количеством атомов. Более тяжелые элементы имеют тенденцию образовывать длинные цепи (например, красный фосфор, серый селен, теллур) или слоистые структуры (например, углерод в виде графита, черный фосфор, серый мышьяк, сурьма, висмут), которые простираются только в одном или двух, а не в трех измерениях. Оба типа структур могут быть обнаружены как аллотропы фосфора, мышьяка и селена, хотя длинноцепочечные аллотропы более стабильны во всех трех. Поскольку эти структуры не используют все свои орбитали для связывания, они заканчиваются связывающими, несвязывающими и антисвязывающими полосами в порядке увеличения энергии. Подобно группе 14, запрещенные зоны сокращаются для более тяжелых элементов, и становится возможным свободное перемещение электронов между цепями или слоями. Так, например, черный фосфор, черный мышьяк, серый селен, теллур и йод являются полупроводниками; серый мышьяк, сурьма и висмут являются полуметаллами (демонстрирующими квазиметаллическую проводимость с очень небольшим перекрытием полос); а полоний и, вероятно, астат являются истинными металлами. [151] Наконец, все природные элементы группы 18 остаются отдельными атомами. [151] [o]
Разделительная линия между металлами и неметаллами примерно диагональна сверху слева направо вниз, причем переходные серии появляются слева от этой диагонали (поскольку у них много доступных орбиталей для перекрытия). Это ожидаемо, поскольку металличность имеет тенденцию коррелировать с электроположительностью и готовностью терять электроны, которая увеличивается справа налево и сверху вниз. Таким образом, металлы значительно превосходят неметаллы по численности. Элементы вблизи пограничной линии трудно классифицировать: они, как правило, обладают свойствами, которые являются промежуточными между свойствами металлов и неметаллов, и могут иметь некоторые свойства, характерные для обоих. Их часто называют полуметаллами или металлоидами . [32] Термин «полуметалл», используемый в этом смысле, не следует путать с его строгим физическим смыслом, связанным с зонной структурой: висмут физически является полуметаллом, но химики обычно считают его металлом. [154]
В следующей таблице рассматриваются наиболее стабильные аллотропы при стандартных условиях. Элементы, окрашенные в желтый цвет, образуют простые вещества, которые хорошо характеризуются металлической связью. Элементы, окрашенные в светло-голубой цвет, образуют гигантские сетчатые ковалентные структуры, тогда как окрашенные в темно-синий цвет, образуют небольшие ковалентно связанные молекулы, которые удерживаются вместе более слабыми силами Ван-дер-Ваальса . Благородные газы окрашены в фиолетовый цвет: их молекулы представляют собой отдельные атомы, и ковалентная связь не происходит. Серые ячейки предназначены для элементов, которые не были приготовлены в достаточных количествах для того, чтобы их наиболее стабильные аллотропы были охарактеризованы таким образом. Теоретические соображения и текущие экспериментальные данные предполагают, что все эти элементы металлизировались бы, если бы они могли образовывать конденсированные фазы, [151] за исключением, возможно, оганессона. [155] [p]
МеталлическийСетевая ковалентнаяМолекулярно -ковалентнаяОтдельные атомыНеизвестныйЦвет фона показывает связь простых веществ в периодической таблице. Если их несколько, рассматривается наиболее устойчивый аллотроп.
Как правило, металлы блестящие и плотные. [32] Они обычно имеют высокие температуры плавления и кипения из-за прочности металлической связи и часто являются ковкими и пластичными (легко растягиваются и формуются), потому что атомы могут двигаться относительно друг друга, не разрывая металлическую связь. [165] Они проводят электричество, потому что их электроны могут свободно перемещаться во всех трех измерениях. Аналогично они проводят тепло, которое передается электронами в виде дополнительной кинетической энергии : они движутся быстрее. Эти свойства сохраняются в жидком состоянии, поскольку, хотя кристаллическая структура разрушается при плавлении, атомы все еще соприкасаются, и металлическая связь сохраняется, хотя и ослабевает. [165] Металлы, как правило, реакционноспособны по отношению к неметаллам. [32] Из этих обобщений можно найти некоторые исключения: например, бериллий, хром, [84] марганец, [166] сурьма, [167] висмут, [168] и уран являются хрупкими (это не исчерпывающий список); [84] хром чрезвычайно тверд; [169] галлий, рубидий, цезий и ртуть являются жидкими при комнатной температуре или близкой к ней; [q] а благородные металлы, такие как золото, химически очень инертны. [170] [171]
Неметаллы проявляют различные свойства. Те, которые образуют гигантские ковалентные кристаллы, демонстрируют высокие температуры плавления и кипения, поскольку для преодоления сильных ковалентных связей требуется значительная энергия. Те, которые образуют дискретные молекулы, удерживаются вместе в основном дисперсионными силами, которые легче преодолеть; таким образом, они, как правило, имеют более низкие температуры плавления и кипения, [172] и многие из них являются жидкостями или газами при комнатной температуре. [32] Неметаллы часто выглядят тусклыми. Они, как правило, реагируют с металлами, за исключением благородных газов, которые инертны по отношению к большинству веществ. [32] Они хрупкие в твердом состоянии, поскольку их атомы крепко удерживаются на месте. Они менее плотные и плохо проводят электричество, [32] потому что нет подвижных электронов. [173] Вблизи границы запрещенные зоны малы, и поэтому многие элементы в этой области являются полупроводниками, такими как кремний, германий, [173] и теллур. [151] Селен имеет как полупроводниковую серую аллотропную модификацию, так и изолирующую красную аллотропную модификацию; Мышьяк имеет металлический серый аллотроп, полупроводниковый черный аллотроп и изолирующий желтый аллотроп (хотя последний нестабилен в условиях окружающей среды). [152] Опять же, есть исключения; например, алмаз имеет самую высокую теплопроводность из всех известных материалов, большую, чем любой металл. [174]
Обычно класс металлоидов обозначается как промежуточный между металлами и неметаллами, поскольку элементы в этой области являются промежуточными как по физическим, так и по химическим свойствам. [32] Однако в литературе нет единого мнения о том, какие именно элементы следует так обозначать. Когда используется такая категория, почти всегда включаются кремний, германий, мышьяк и теллур, а также обычно бор и сурьма; но большинство источников включают и другие элементы, без согласия о том, какие дополнительные элементы следует добавлять, а некоторые другие вместо этого вычитают из этого списка. [r] Например, в отличие от всех других элементов, обычно считающихся металлоидами или неметаллами, единственная стабильная форма сурьмы имеет металлическую проводимость. Более того, этот элемент напоминает висмут и, в более общем смысле, другие металлы p-блока по своему физическому и химическому поведению. На этом основании некоторые авторы утверждают, что его лучше классифицировать как металл, чем как металлоид. [84] [179] [152] С другой стороны, селен обладает некоторыми полупроводниковыми свойствами в своей наиболее стабильной форме (хотя он также имеет изолирующие аллотропы), и утверждается, что его следует считать металлоидом [179] – хотя эта ситуация также справедлива для фосфора, [152] который является гораздо более редким включением среди металлоидов. [r]
В периодической таблице существуют и другие связи между элементами, которые не находятся в одной и той же группе, например, диагональные связи между элементами, которые являются диагонально соседними (например, литий и магний). [121] Некоторые сходства можно также найти между основными группами и группами переходных металлов или между ранними актинидами и ранними переходными металлами, когда элементы имеют одинаковое число валентных электронов. Таким образом, уран несколько напоминает хром и вольфрам в группе 6, [121], поскольку все три имеют шесть валентных электронов. [180] Связи между элементами с одинаковым числом валентных электронов, но разными типами валентных орбиталей были названы вторичными или изодонорными связями: они обычно имеют одинаковые максимальные степени окисления, но не одинаковые минимальные степени окисления. Например, хлор и марганец имеют максимальную степень окисления +7 (например, Cl 2 O 7 и Mn 2 O 7 ), но их минимальные степени окисления равны −1 (например, HCl ) и −3 (K 2 [Mn(CO) 4 ]). Элементы с одинаковым числом валентных вакансий, но разным числом валентных электронов связаны третичным или изоакцепторным отношением: они обычно имеют схожие минимальные, но не максимальные степени окисления. Например, водород и хлор имеют минимальную степень окисления −1 (в гидридах и хлоридах ), но максимальная степень окисления водорода равна +1 (например, H 2 O ), а хлора — +7. [58]
Многие другие физические свойства элементов демонстрируют периодические изменения в соответствии с периодическим законом, такие как температуры плавления , температуры кипения , теплоты плавления , теплоты испарения , энергия атомизации и т. д. Аналогичные периодические изменения появляются для соединений элементов, которые можно наблюдать, сравнивая гидриды, оксиды, сульфиды, галогениды и т. д. [144] Химические свойства сложнее описать количественно, но они также демонстрируют свои собственные периодичности. Примерами служат изменение кислотных и основных свойств элементов и их соединений, стабильность соединений и методы выделения элементов. [113] Периодичность используется и использовалась очень широко для предсказания свойств неизвестных новых элементов и новых соединений и является центральной в современной химии. [181]
В литературе используется множество терминов для описания наборов элементов, которые ведут себя схожим образом. Названия групп щелочной металл , щелочноземельный металл , триэль , тетрель , пниктоген , халькоген , галоген и благородный газ признаны ИЮПАК; другие группы могут называться по их номеру или по их первому элементу (например, группа 6 — это группа хрома). [22] [182] Некоторые разделяют элементы p-блока из групп 13–16 по металличности, [177] [175] хотя нет ни определения ИЮПАК, ни точного консенсуса относительно того, какие именно элементы следует считать металлами, неметаллами или полуметаллами (иногда называемыми металлоидами). [177] [175] [22] Также нет консенсуса относительно того, как следует называть металлы, следующие за переходными металлами, при этом среди возможных вариантов были использованы постпереходный металл и плохой металл . Некоторые передовые монографии исключают элементы группы 12 из переходных металлов на основании их иногда совершенно разных химических свойств, но это не является универсальной практикой [183] , и ИЮПАК в настоящее время не упоминает это как допустимое в своих Принципах химической номенклатуры . [184]
Лантаноидами считаются элементы La–Lu, которые все очень похожи друг на друга: исторически они включали только Ce–Lu, но лантан был включен в общее употребление. [ 22] Редкоземельные элементы (или редкоземельные металлы) добавляют скандий и иттрий к лантаноидам. [22] Аналогично, актиноидами считаются элементы Ac–Lr (исторически Th–Lr), [22] хотя вариации свойств в этом наборе намного больше, чем внутри лантаноидов. [52] ИЮПАК рекомендует названия лантаноиды и актиноиды , чтобы избежать двусмысленности, поскольку суффикс -ид обычно обозначает отрицательный ион; однако лантаноиды и актиниды остаются распространенными. [22] С ростом признания лютеция и лоуренсия как элементов d-блока некоторые авторы начали определять лантаноиды как La–Yb, а актиноиды как Ac–No, что соответствует f-блоку. [57] [25] [185] [186] [187] [ 188] Трансактиниды или сверхтяжелые элементы — это короткоживущие элементы после актинидов, начинающиеся с лоуренсия или резерфордия (в зависимости от того, где заканчиваются актиниды). [188] [189] [190] [191] [192]
Существует и используется гораздо больше категоризаций в соответствии с определенными дисциплинами. В астрофизике металл определяется как любой элемент с атомным числом больше 2, т. е. все, кроме водорода и гелия. [193] Термин «полуметалл» имеет другое определение в физике, чем в химии: висмут является полуметаллом по физическим определениям, но химики обычно считают его металлом. [194] Несколько терминов широко используются, но без какого-либо очень формального определения, например, « тяжелый металл », которому был дан такой широкий спектр определений, что его критиковали как «фактически бессмысленный». [195]
Область применения терминов значительно различается у разных авторов. Например, согласно ИЮПАК, благородные газы распространяются на всю группу, включая очень радиоактивный сверхтяжелый элемент оганесон. [196] Однако среди тех, кто специализируется на сверхтяжелых элементах, это делается нечасто: в этом случае «благородный газ» обычно подразумевает нереакционноспособное поведение более легких элементов группы. Поскольку расчеты обычно предсказывают, что оганесон не должен быть особенно инертным из-за релятивистских эффектов и даже может не быть газом при комнатной температуре, если его можно было бы производить в больших количествах, его статус как благородного газа часто ставится под сомнение в этом контексте. [197] Кроме того, иногда встречаются национальные различия: в Японии щелочноземельные металлы часто не включают бериллий и магний, поскольку их поведение отличается от поведения более тяжелых металлов группы 2. [198]

В 1817 году немецкий физик Иоганн Вольфганг Дёберейнер начал формулировать одну из самых ранних попыток классификации элементов. [199] В 1829 году он обнаружил, что может сформировать некоторые элементы в группы по три, причем члены каждой группы имеют связанные свойства. Он назвал эти группы триадами . [200] [201] Хлор, бром и йод образовали триаду; как и кальций, стронций и барий; литий, натрий и калий; и сера, селен и теллур. Сегодня все эти триады являются частью современных групп: галогены, щелочноземельные металлы, щелочные металлы и халькогены. [202] Различные химики продолжили его работу и смогли выявить все больше и больше связей между небольшими группами элементов. Однако они не смогли построить одну схему, которая охватывала бы их все. [203]

Джон Ньюлендс опубликовал письмо в Chemical News в феврале 1863 года о периодичности среди химических элементов. [204] В 1864 году Ньюлендс опубликовал статью в Chemical News, показывающую, что если элементы расположены в порядке их атомных весов, то те, которые имеют последовательные номера, часто либо принадлежат к одной и той же группе, либо занимают схожие позиции в разных группах, и он указал, что каждый восьмой элемент, начиная с данного, является в этом расположении своего рода повторением первого, как восьмая нота октавы в музыке (Закон октав). [204] Однако формулировка Ньюлендса хорошо работала только для элементов главной группы и столкнулась с серьезными проблемами с другими. [58]
Немецкий химик Лотар Мейер отметил последовательности схожих химических и физических свойств, повторяющихся через периодические интервалы. По его словам, если атомные веса были нанесены на график как ординаты (т. е. вертикально), а атомные объемы как абсциссы (т. е. горизонтально) — кривая получила ряд максимумов и минимумов — наиболее электроположительные элементы появились бы на пиках кривой в порядке их атомных весов. В 1864 году была опубликована его книга; она содержала раннюю версию периодической таблицы, содержащую 28 элементов, и классифицировала элементы на шесть семейств по их валентности — впервые элементы были сгруппированы в соответствии с их валентностью. Работы по организации элементов по атомному весу до тех пор были заблокированы неточными измерениями атомных весов. [205] В 1868 году он пересмотрел свою таблицу, но эта редакция была опубликована в виде черновика только после его смерти. [206]

Окончательный прорыв был совершен русским химиком Дмитрием Менделеевым . Хотя другие химики (включая Мейера) нашли некоторые другие версии периодической системы примерно в то же время, Менделеев был наиболее предан разработке и защите своей системы, и именно его система больше всего повлияла на научное сообщество. [207] 17 февраля 1869 года (1 марта 1869 года по григорианскому календарю) Менделеев начал упорядочивать элементы и сравнивать их по атомным весам. Он начал с нескольких элементов, и в течение дня его система росла, пока не охватила большинство известных элементов. После того, как он нашел последовательное расположение, его печатная таблица появилась в мае 1869 года в журнале Русского химического общества. [208] Когда элементы, казалось, не вписывались в систему, он смело предсказывал, что либо валентности, либо атомные веса были измерены неправильно, либо что был отсутствующий элемент, который еще предстоит открыть. [58] В 1871 году Менделеев опубликовал длинную статью, включающую обновленную форму своей таблицы, в которой его предсказания для неизвестных элементов были явными. Менделеев предсказал свойства трех из этих неизвестных элементов в деталях: поскольку у них отсутствовали более тяжелые гомологи бора, алюминия и кремния, он назвал их эка-бор, эка-алюминий и эка-кремний («эка» на санскрите означает «один»). [208] [209] : 45

В 1875 году французский химик Поль-Эмиль Лекок де Буабодран , работая без знания предсказания Менделеева, открыл новый элемент в образце минерала сфалерита и назвал его галлием. Он выделил элемент и начал определять его свойства. Менделеев, прочитав публикацию де Буабодрана, отправил письмо, в котором утверждал, что галлий был его предсказанным экаалюминием. Хотя Лекок де Буабодран изначально был настроен скептически и подозревал, что Менделеев пытается присвоить себе заслугу своего открытия, позже он признал, что Менделеев был прав. [210] В 1879 году шведский химик Ларс Фредрик Нильсон открыл новый элемент, который он назвал скандием: он оказался экабором. Экакремний был обнаружен в 1886 году немецким химиком Клеменсом Винклером , который назвал его германием. Свойства галлия, скандия и германия совпали с тем, что предсказал Менделеев. [211] В 1889 году Менделеев отметил на Фарадеевской лекции в Королевском институте в Лондоне, что он не ожидал, что проживет достаточно долго, «чтобы упомянуть об их открытии Химическому обществу Великобритании как о подтверждении точности и общности периодического закона». [212] Даже открытие благородных газов в конце 19-го века, которое Менделеев не предсказал, аккуратно вписалось в его схему как восьмая главная группа. [213]
Тем не менее, Менделеев столкнулся с некоторыми трудностями при подгонке известных лантаноидов под свою схему, поскольку они не демонстрировали периодического изменения валентностей, как другие элементы. После долгих исследований чешский химик Богуслав Браунер в 1902 году предположил, что все лантаноиды можно поместить в одну группу в периодической таблице. Он назвал это «астероидной гипотезой» в качестве астрономической аналогии: так же, как между Марсом и Юпитером находится пояс астероидов вместо одной планеты, так и место под иттрием считалось занятым всеми лантаноидами вместо одного элемента. [33]

После того, как внутренняя структура атома была исследована, голландский физик-любитель Антониус ван ден Брук в 1913 году предположил, что заряд ядра определяет размещение элементов в периодической таблице. [214] [215] Новозеландский физик Эрнест Резерфорд придумал слово «атомный номер» для этого заряда ядра. [216] В опубликованной статье ван ден Брук проиллюстрировал первую электронную периодическую таблицу, показывающую элементы, расположенные в соответствии с числом их электронов. [217] Резерфорд подтвердил в своей статье 1914 года, что Бор принял точку зрения ван ден Брука. [218]
.jpg/440px-Henry_Moseley_(1887-1915).jpg)
В том же году английский физик Генри Мозли с помощью рентгеновской спектроскопии экспериментально подтвердил предположение ван ден Брука. Мозли определил значение заряда ядра каждого элемента от алюминия до золота и показал, что упорядочение Менделеева фактически размещает элементы в последовательном порядке по заряду ядра. [219] Заряд ядра идентичен количеству протонов и определяет значение атомного номера ( Z ) каждого элемента. Использование атомного номера дает определенную, основанную на целочисленных числах последовательность для элементов. Исследования Мозли немедленно разрешили несоответствия между атомным весом и химическими свойствами; это были такие случаи, как теллур и йод, где атомный номер увеличивается, но атомный вес уменьшается. [214] Хотя Мозли вскоре был убит в Первой мировой войне, шведский физик Манне Зигбан продолжил свою работу до урана и установил, что это был элемент с самым высоким атомным номером, известным на тот момент (92). [220] На основе исследований Мозели и Зигбана также было известно, какие атомные номера соответствуют отсутствующим элементам, которые еще не были найдены: 43, 61, 72, 75, 85 и 87. [214] (Элемент 75 на самом деле уже был обнаружен японским химиком Масатакой Огавой в 1908 году и назван ниппонием , но он ошибочно присвоил ему номер 43 вместо 75, и поэтому его открытие не было общепризнанным до более позднего времени. Современно признанное открытие элемента 75 произошло в 1925 году, когда Уолтер Ноддак , Ида Таке и Отто Берг независимо друг от друга переоткрыли его и дали ему его нынешнее название — рений .) [221]
Рассвет атомной физики также прояснил ситуацию с изотопами . В цепочках распада первичных радиоактивных элементов тория и урана вскоре стало очевидно, что существует множество новых элементов, которые имеют разные атомные веса, но совершенно одинаковые химические свойства. В 1913 году Фредерик Содди ввел термин «изотоп», чтобы описать эту ситуацию, и считал, что изотопы — это просто разные формы одного и того же химического элемента. Это также прояснило такие несоответствия, как теллур и йод: естественный изотопный состав теллура смещен в сторону более тяжелых изотопов, чем у йода, но теллур имеет более низкий атомный номер. [222]
Датский физик Нильс Бор применил идею квантования Макса Планка к атому. Он пришел к выводу, что энергетические уровни электронов квантуются: допускается только дискретный набор стабильных энергетических состояний. Затем Бор попытался понять периодичность через электронные конфигурации, предположив в 1913 году, что внутренние электроны должны отвечать за химические свойства элемента. [223] [224] В 1913 году он создал первую электронную периодическую таблицу, основанную на квантовом атоме. [225]
Бор назвал свои электронные оболочки «кольцами» в 1913 году: атомные орбитали внутри оболочек не существовали во времена его планетарной модели. Бор объясняет в части 3 своей знаменитой статьи 1913 года, что максимальное количество электронов в оболочке равно восьми, написав: «Мы видим, далее, что кольцо из n электронов не может вращаться в одном кольце вокруг ядра с зарядом ne, если только n < 8». Для меньших атомов электронные оболочки будут заполнены следующим образом: «кольца электронов будут соединяться только в том случае, если они содержат равное количество электронов; и что, соответственно, количество электронов на внутренних кольцах будет только 2, 4, 8». Однако в более крупных атомах самая внутренняя оболочка будет содержать восемь электронов: «с другой стороны, периодическая система элементов настоятельно предполагает, что уже в неоне N = 10 возникнет внутреннее кольцо из восьми электронов». Его предложенные электронные конфигурации для атомов (показаны справа) в основном не соответствуют тем, которые известны сейчас. [226] [227] Они были усовершенствованы еще больше после того, как Арнольд Зоммерфельд и Эдмунд Стоунер в своих работах открыли больше квантовых чисел. [222]
Первым, кто систематически расширил и скорректировал химические потенциалы атомной теории Бора, был Вальтер Коссель в 1914 и 1916 годах. Коссель объяснил, что в периодической таблице новые элементы будут создаваться по мере добавления электронов к внешней оболочке. В своей статье Коссель пишет: «Это приводит к выводу, что электроны, которые добавляются далее, должны быть помещены в концентрические кольца или оболочки, на каждой из которых ... должно быть расположено только определенное количество электронов — а именно восемь в нашем случае. Как только одно кольцо или оболочка завершены, для следующего элемента должно быть начато новое; количество электронов, которые наиболее легко доступны и лежат на самой внешней периферии, снова увеличивается от элемента к элементу и, следовательно, при образовании каждой новой оболочки химическая периодичность повторяется». [228] [229]
В статье 1919 года Ирвинг Ленгмюр постулировал существование «ячеек», которые мы теперь называем орбиталями, каждая из которых могла содержать только два электрона, и они были расположены в «эквидистантных слоях», которые мы теперь называем оболочками. Он сделал исключение для первой оболочки, чтобы она содержала только два электрона. [230] Химик Чарльз Рагели Бери предположил в 1921 году, что восемь и восемнадцать электронов в оболочке образуют стабильные конфигурации. Бери предположил, что электронные конфигурации в переходных элементах зависят от валентных электронов в их внешней оболочке. [231] Он ввел слово переход для описания элементов, которые теперь известны как переходные металлы или переходные элементы. [232] Теория Бора была подтверждена открытием элемента 72: Жорж Урбен утверждал, что открыл его как редкоземельный элемент целтий , но Бери и Бор предсказали, что элемент 72 не может быть редкоземельным элементом и должен быть гомологом циркония . Дирк Костер и Георг фон Хевеши искали элемент в циркониевых рудах и нашли элемент 72, который они назвали гафнием в честь родного города Бора Копенгагена ( Hafnia на латыни). [233] [234] Цельтий Урбена оказался просто очищенным лютецием (элемент 71). [235] Таким образом, гафний и рений стали последними стабильными элементами, которые были открыты. [222]
Подстрекаемый Бором, Вольфганг Паули занялся проблемой электронных конфигураций в 1923 году. Паули расширил схему Бора, чтобы использовать четыре квантовых числа , и сформулировал свой принцип исключения , который гласил, что никакие два электрона не могут иметь одинаковые четыре квантовых числа. Это объясняло длины периодов в периодической таблице (2, 8, 18 и 32), которые соответствовали числу электронов, которые могла занимать каждая оболочка. [236] В 1925 году Фридрих Хунд пришел к конфигурациям, близким к современным. [237] В результате этих достижений периодичность стала основываться на числе химически активных или валентных электронов, а не на валентностях элементов. [58] Принцип Ауфбау , описывающий электронные конфигурации элементов, был впервые эмпирически обнаружен Эрвином Маделунгом в 1926 году, [45] хотя первым, кто опубликовал его, был Владимир Карапетов в 1930 году. [238] [239] В 1961 году Всеволод Клечковский вывел первую часть правила Маделунга (что орбитали заполняются в порядке возрастания n + ℓ) из модели Томаса-Ферми ; [240] полное правило было выведено из аналогичного потенциала в 1971 году Юрием Н. Демковым и Валентином Н. Островским. [241] [s]

Квантовая теория прояснила, что переходные металлы и лантаноиды образуют свои собственные отдельные группы, переходные между основными группами, хотя некоторые химики уже предлагали таблицы, показывающие их таким образом до этого: английский химик Генри Бассетт сделал это в 1892 году, датский химик Юлиус Томсен в 1895 году и швейцарский химик Альфред Вернер в 1905 году. Бор использовал форму Томсена в своей Нобелевской лекции 1922 года; форма Вернера очень похожа на современную форму из 32 столбцов. В частности, она вытеснила астероидную гипотезу Браунера. [33]
Точное положение лантаноидов и, таким образом, состав группы 3 оставались предметом споров в течение десятилетий, поскольку их электронные конфигурации изначально были измерены неправильно. [25] [92] По химическим причинам Бассетт, Вернер и Бери сгруппировали скандий и иттрий с лютецием, а не с лантаном (первые два оставили пустое место под иттрием, поскольку лютеций еще не был открыт). [33] [231] В 1927 году Хунд предположил, что все атомы лантаноидов имеют конфигурацию [Xe]4f 0−14 5d 1 6s 2 из-за их преобладающей трехвалентности. Теперь известно, что связь между химией и электронной конфигурацией сложнее, чем эта. [t] [54] Ранние спектроскопические данные, казалось, подтверждали эти конфигурации, и, таким образом, периодическая таблица была структурирована так, чтобы иметь группу 3 как скандий, иттрий, лантан и актиний, с четырнадцатью f-элементами, разбивающими d-блок между лантаном и гафнием. [25] Но позже было обнаружено, что это верно только для четырех из пятнадцати лантаноидов (лантана, церия, гадолиния и лютеция), и что другие атомы лантаноидов не имеют d-электрона. В частности, иттербий завершает оболочку 4f, и, таким образом, советские физики Лев Ландау и Евгений Лифшиц отметили в 1948 году, что лютеций правильно рассматривать как элемент d-блока, а не f-блока; [26] то, что объемный лантан является f-металлом, впервые было предложено Дзюном Кондо в 1963 году на основании его низкотемпературной сверхпроводимости . [100] Это прояснило важность рассмотрения низколежащих возбужденных состояний атомов, которые могут играть роль в химических средах при классификации элементов по блокам и размещении их в таблице. [63] [65] [25] Многие авторы впоследствии переоткрыли эту поправку на основе физических, химических и электронных соображений и применили ее ко всем соответствующим элементам, таким образом, включив в группу 3 скандий, иттрий, лютеций и лоуренсий [63] [23] [92] и имея лантан через иттербий и актиний через нобелий в качестве рядов f-блока: [63] [23] эта исправленная версия достигает согласованности с правилом Маделунга и подтверждает первоначальное химическое размещение Бассетта, Вернера и Бери. [33]
В 1988 году ИЮПАК опубликовал отчет, поддерживающий этот состав группы 3, [23] решение, которое было подтверждено в 2021 году. [24] В учебниках по составу группы 3 все еще можно найти вариации, [35] и некоторые аргументы против этого формата все еще публикуются сегодня, [27] но химики и физики, которые рассматривали этот вопрос, в основном согласны с тем, что группа 3 содержит скандий, иттрий, лютеций и лоуренсий, и оспаривают контраргументы как непоследовательные. [27]

К 1936 году число недостающих элементов от водорода до урана сократилось до четырех: элементы 43, 61, 85 и 87 оставались недостающими. Элемент 43 в конечном итоге стал первым элементом, который был синтезирован искусственно с помощью ядерных реакций, а не обнаружен в природе. Он был открыт в 1937 году итальянскими химиками Эмилио Сегре и Карло Перье , которые назвали свое открытие технецием , в честь греческого слова «искусственный». [242] Элементы 61 ( прометий ) и 85 ( астат ) были также получены искусственно в 1945 и 1940 годах соответственно; Элемент 87 ( франций ) стал последним элементом, открытым в природе французским химиком Маргерит Перей в 1939 году. [243] [u] Элементы за ураном также были открыты искусственно, начиная с открытия нептуния Эдвином Макмилланом и Филиппом Абельсоном в 1940 году (путем бомбардировки урана нейтронами). [75] Гленн Т. Сиборг и его команда в Национальной лаборатории Лоуренса в Беркли (LBNL) продолжили открывать трансурановые элементы, начав с плутония в 1941 году, и обнаружили, что вопреки прежним представлениям, элементы, начиная с актиния, являются конгенерами лантаноидов, а не переходными металлами. [244] Ранее это предполагали Бассетт (1892), Вернер (1905) и французский инженер Шарль Жане (1928), но их идеи тогда не получили всеобщего признания. [33] Поэтому Сиборг назвал их актинидами. [244] Элементы до 101 (названные менделевием в честь Менделеева) были синтезированы до 1955 года либо путем облучения нейтронами или альфа-частицами, либо в ядерных взрывах в случаях 99 (эйнштейний) и 100 (фермий). [75]
Значительные разногласия возникли с элементами 102-106 в 1960-х и 1970-х годах, когда возникла конкуренция между командой LBNL (теперь во главе с Альбертом Гиорсо ) и группой советских ученых из Объединенного института ядерных исследований (ОИЯИ) во главе с Георгием Флёровым . Каждая команда заявляла об открытии, а в некоторых случаях каждая предлагала свое собственное название для элемента, создавая споры о наименовании элементов , которые длились десятилетия. Эти элементы были получены путем бомбардировки актинидов легкими ионами. [245] IUPAC сначала принял подход невмешательства, предпочитая подождать и посмотреть, будет ли достигнут консенсус. Но поскольку это был также разгар холодной войны , стало ясно, что этого не произойдет. Таким образом, ИЮПАК и Международный союз теоретической и прикладной физики (ИЮПАП) создали в 1985 году Рабочую группу по трансфермию (TWG, поскольку фермий является элементом 100) для разработки критериев открытия, [246] которые были опубликованы в 1991 году. [247] После некоторых дальнейших споров эти элементы получили свои окончательные названия в 1997 году, включая сиборгий (106) в честь Сиборга. [248]

Критерии TWG использовались для арбитража более поздних заявок на открытие элементов от LBNL и JINR, а также от научно-исследовательских институтов Германии ( GSI ) и Японии ( Riken ). [249] В настоящее время рассмотрение заявок на открытие осуществляется Совместной рабочей группой IUPAC/IUPAP . После присвоения приоритета элементы были официально добавлены в периодическую таблицу, и первооткрывателям было предложено предложить свои названия. [6] К 2016 году это произошло для всех элементов до 118, таким образом заполнив первые семь строк периодической таблицы. [6] [250] Открытия элементов за пределами 106 стали возможны благодаря методам, разработанным Юрием Оганесяном в ОИЯИ: холодный синтез (бомбардировка свинца и висмута тяжелыми ионами) сделал возможным открытие элементов со 107 по 112 в GSI и 113 в Riken в 1981–2004 годах, а также он руководил группой ОИЯИ (в сотрудничестве с американскими учеными) по открытию элементов со 114 по 118 с помощью горячего синтеза (бомбардировка актинидов ионами кальция) в 1998–2010 годах. [251] [252] Самый тяжелый известный элемент, оганесон (118), назван в честь Оганесяна. Элемент 114 назван флеровием в честь его предшественника и наставника Флерова. [252]
В ознаменование 150-летия периодической таблицы Организация Объединенных Наций объявила 2019 год Международным годом периодической таблицы, отмечая «одно из самых значительных достижений в науке». [253] Критерии открытия, установленные TWG, были обновлены в 2020 году в ответ на экспериментальный и теоретический прогресс, который не был предсказан в 1991 году. [254] Сегодня периодическая таблица является одним из самых узнаваемых символов химии. [81] Сегодня IUPAC участвует во многих процессах, связанных с периодической таблицей: распознавание и наименование новых элементов, рекомендация номеров групп и коллективных названий, а также обновление атомных весов. [6]

Последние названные элементы – нихоний (113), московий (115), теннессин (117) и оганесон (118) – завершили седьмую строку периодической таблицы. [6] Будущие элементы должны были бы начать восьмую строку . Эти элементы могут быть обозначены либо по их атомным номерам (например, « элемент 164 »), либо по систематическим названиям элементов ИЮПАК, принятым в 1978 году, которые напрямую связаны с атомными номерами (например, «унгексквадиум» для элемента 164, полученный от латинского unus «один», греческого hexa «шесть», латинского quadra «четыре» и традиционного суффикса -ium для металлических элементов). [6] Все попытки синтезировать такие элементы до сих пор не увенчались успехом. Попытка создать элемент 119 продолжается с 2018 года в исследовательском институте Riken в Японии. LBNL в США, ОИЯИ в России и Исследовательский центр тяжелых ионов в Ланьчжоу (HIRFL) в Китае также планируют предпринять собственные попытки синтеза первых нескольких элементов 8-го периода. [257] [258] [259] [260] [261] [262]
Если бы восьмой период следовал шаблону, установленному более ранними периодами, то он содержал бы пятьдесят элементов, заполняя подоболочки 8s, 5g, 6f, 7d и, наконец, 8p в этом порядке. Но к этому моменту релятивистские эффекты должны привести к значительным отклонениям от правила Маделунга. Были предложены различные модели для конфигураций элементов восьмого периода, а также того, как показать результаты в периодической таблице. Все согласны с тем, что восьмой период должен начинаться, как и предыдущие, с двух элементов 8s, 119 и 120. Однако после этого массивные энергетические перекрытия между подоболочками 5g, 6f, 7d и 8p означают, что все они начинают заполняться вместе, и неясно, как выделить конкретные серии 5g и 6f. [59] [263] [264] [265] [266] Таким образом, элементы с 121 по 156 не подходят в качестве химических аналогов какой-либо предыдущей группы в более ранних частях таблицы, [128] хотя иногда их помещали в ряды 5g, 6f и другие, чтобы формально отразить их электронные конфигурации. [128] Эрик Шерри поднял вопрос о том, должна ли расширенная периодическая таблица учитывать несостоятельность правила Маделунга в этой области или такие исключения следует игнорировать. [263] Структура оболочки также может быть довольно формальной на этом этапе: уже ожидается, что распределение электронов в атоме оганессона будет довольно равномерным, без различимой структуры оболочки. [267]
Ситуация с элементами 157 по 172 должна вернуться к норме и больше напоминать более ранние ряды. [256] Тяжелые p-оболочки разделены спин-орбитальным взаимодействием : одна p-орбиталь (p 1/2 ) более стабилизирована, а две другие (p 3/2 ) дестабилизированы. (Такие сдвиги квантовых чисел происходят для всех типов оболочек, но это вносит наибольшее различие в порядок для p-оболочек.) Вероятно, что к элементу 157 заполненные 8s и 8p 1/2 оболочки с четырьмя электронами в общей сложности погрузились в ядро. За ядром следующими орбиталями являются 7d и 9s при схожих энергиях, за которыми следуют 9p 1/2 и 8p 3/2 при схожих энергиях, а затем большой разрыв. [256] Таким образом, орбитали 9s и 9p 1/2 по сути заменяют орбитали 8s и 8p 1/2 , что делает элементы 157–172, вероятно, химически аналогичными группам 3–18: например, элемент 164 оказался бы на две позиции ниже свинца в группе 14 в рамках обычной модели, но, как вычисляется, он очень похож на палладий в группе 10 вместо этого. [54] [265] [59] [255] [128] Таким образом, требуется пятьдесят четыре элемента, а не пятьдесят, чтобы достичь следующего благородного элемента после 118. [268] Однако, хотя эти выводы о химии элементов 157–172 в целом согласуются с моделями, [128] [59] существуют разногласия по поводу того, следует ли составлять периодическую таблицу для отражения химических аналогий или же она должна отражать вероятные формальные электронные конфигурации, которые должны существенно отличаться от более ранних периодов и не согласованы между источниками. Таким образом, дискуссия о формате восьмой строки продолжается. [59] [265] [266] [104]
За пределами элемента 172 расчет усложняется тем, что уровень энергии электрона 1s становится мнимым. Такая ситуация имеет физическую интерпретацию и сама по себе не накладывает электронного предела на периодическую таблицу, но правильный способ включения таких состояний в многоэлектронные расчеты все еще остается открытой проблемой. Это необходимо решить, чтобы продолжить расчет структуры периодической таблицы за пределами этой точки. [269]
Ядерная стабильность, вероятно, окажется решающим фактором, ограничивающим число возможных элементов. Она зависит от баланса между электрическим отталкиванием между протонами и сильной силой, связывающей протоны и нейтроны вместе. [270] Протоны и нейтроны расположены в оболочках , как и электроны, и поэтому закрытая оболочка может значительно повысить стабильность: известные сверхтяжелые ядра существуют из-за такого замыкания оболочки, вероятно, около 114–126 протонов и 184 нейтронов. [269] Они, вероятно, близки к предсказанному острову стабильности , где сверхтяжелые нуклиды должны быть более долгоживущими, чем ожидалось: прогнозы для самых долгоживущих нуклидов на острове варьируются от микросекунд до миллионов лет. [104] [271] [272] Тем не менее, следует отметить, что это по сути экстраполяции в неизвестную часть таблицы нуклидов, и необходимо учитывать систематические неопределенности модели. [104]
При прохождении закрытых оболочек стабилизирующий эффект должен исчезнуть: [273] таким образом, ожидается, что сверхтяжелые нуклиды с более чем 184 нейтронами будут иметь гораздо более короткое время жизни, спонтанно делясь в течение 10 −15 секунд. Если это так, то не имеет смысла считать их химическими элементами: ИЮПАК определяет элемент как существующий только в том случае, если ядро живет дольше 10 −14 секунд, времени, необходимого для того, чтобы собрать электронное облако. Тем не менее, теоретические оценки периодов полураспада очень зависят от модели, варьируясь на многие порядки величины. [269] Предсказывается, что сильное отталкивание между протонами приведет к экзотическим ядерным топологиям с ожидаемыми пузырями, кольцами и торами: это еще больше усложняет экстраполяцию. [104] Неясно, существуют ли какие-либо более отдаленные замыкания оболочек из-за ожидаемого размывания отдельных ядерных оболочек (как уже ожидается для электронных оболочек в Оганессоне). [273] Более того, даже если существуют более поздние замыкания оболочек, неясно, позволили бы они существовать таким тяжелым элементам. [274] [275] [276] [177] Таким образом, может быть, что периодическая таблица фактически заканчивается около элемента 120, поскольку элементы становятся слишком короткоживущими, чтобы их можно было наблюдать, а затем слишком короткоживущими, чтобы иметь химию; таким образом, эра открытия новых элементов будет близка к своему концу. [177] [277] Если существует еще одно замыкание протонной оболочки за пределами 126, то оно, вероятно, происходит около 164; [274] таким образом, область, где периодичность нарушается, более или менее соответствует области нестабильности между замыканиями оболочек. [128]
В качестве альтернативы кварковая материя может стать стабильной при высоких массовых числах, в которых ядро состоит из свободно текущих вверх и вниз кварков вместо связывания их в протоны и нейтроны; это создало бы континент стабильности вместо острова. [278] [279] Могут вступить в игру и другие эффекты: например, в очень тяжелых элементах 1s-электроны, вероятно, проведут значительное количество времени так близко к ядру, что они фактически окажутся внутри него, что сделает их уязвимыми для электронного захвата . [280]
Даже если элементы восьмого ряда могут существовать, их производство, вероятно, будет сложным, и это должно стать еще более сложным по мере увеличения атомного числа. [281] Хотя ожидается, что элементы 8s 119 и 120 будут достижимы с помощью существующих средств, ожидается, что элементы за их пределами потребуют новых технологий, [282] если их вообще можно будет получить. [283] Экспериментальная химическая характеристика этих элементов также будет представлять собой серьезную проблему. [257]

Периодический закон может быть представлен несколькими способами, из которых стандартная периодическая таблица является только одним. [284] В течение 100 лет с момента появления таблицы Менделеева в 1869 году Эдвард Г. Мазурс собрал приблизительно 700 различных опубликованных версий периодической таблицы. [180] [285] Многие формы сохраняют прямоугольную структуру, включая левоступенчатую периодическую таблицу Чарльза Жане (на фото ниже) и модернизированную форму оригинальной 8-колоночной компоновки Менделеева, которая все еще распространена в России. Другие форматы периодической таблицы были сформированы гораздо более экзотически, например, спирали ( Отто Теодора Бенфея на фото справа), круги и треугольники. [286]
Альтернативные периодические таблицы часто разрабатываются для того, чтобы выделить или подчеркнуть химические или физические свойства элементов, которые не так очевидны в традиционных периодических таблицах, при этом другие таблицы больше смещены в сторону подчеркивания химии или физики на обоих концах. [287] Стандартная форма, которая остается наиболее распространенной, находится где-то посередине. [287]
Множество различных форм периодической таблицы вызвали вопросы о том, существует ли оптимальная или окончательная форма периодической таблицы, и если да, то какой она может быть. На данный момент нет единого ответа ни на один из этих вопросов. [288] [287] Таблица левых шагов Джанета все чаще обсуждается как кандидат на то, чтобы быть оптимальной или наиболее фундаментальной формой; Шерри написал в ее поддержку, поскольку она проясняет природу гелия как элемента s-блока, увеличивает регулярность за счет повторения всех длин периодов, точно следует правилу Маделунга, делая каждый период соответствующим одному значению n + ℓ , [g] и упорядочивает триады атомных чисел и тенденцию аномалии первой строки. Хотя он отмечает, что размещение гелия над щелочноземельными металлами можно рассматривать как недостаток с химической точки зрения, он возражает против этого, ссылаясь на аномалию первой строки, указывая на то, что периодическая таблица «в основе своей сводится к квантовой механике» и что она касается «абстрактных элементов» и, следовательно, атомных свойств, а не макроскопических свойств. [294]
В 15-й группе Периодической таблицы, как и в обеих соседних группах, металлический характер усиливается при движении вниз. Более конкретно, происходит переход от чисто неметаллического элемента (N) через элементы с неметаллическими и металлическими модификациями к чисто металлическим элементам (Sb, Bi). В этой главе рассматриваются два элемента, помимо азота, которые явно являются неметаллическими при стандартных условиях: фосфор и мышьяк. Однако химия мышьяка описана лишь кратко, поскольку многие соединения мышьяка напоминают соответствующие виды фосфора.
Сверхтяжелые элементы (
Z
> 102) балансируют на пределе массы и заряда.
「12.アルカリ土類金属」の範囲についても,△を含めれば,すべての教科書で提案が考慮されている。歴史的には第4 周期のカルシウム以下を指していた用語だったが,「周期表の2 族に対応する用語とする」というIUPAC の勧告1)に従うのは現在では自然な流れだろう。
Первое использование термина "переход" в его современном электронном смысле, по-видимому, связано с британским химиком CRBury, который впервые использовал этот термин в своей статье 1921 года об электронной структуре атомов и периодической таблице