В координационной химии константа стабильности (также называемая константой образования или константой связывания ) является константой равновесия для образования комплекса в растворе. Это мера силы взаимодействия между реагентами, которые объединяются, образуя комплекс . Существует два основных вида комплексов: соединения, образующиеся при взаимодействии иона металла с лигандом, и супрамолекулярные комплексы, такие как комплексы «хозяин-гость» и комплексы анионов. Константа(ы) стабильности предоставляет(ют) информацию, необходимую для расчета концентрации(й) комплекса(ов) в растворе. Существует множество областей применения в химии, биологии и медицине.
Янник Бьеррум (сын Нильса Бьеррума ) разработал первый общий метод определения констант устойчивости металл-амминных комплексов в 1941 году. [1] Причины, по которым это произошло так поздно, почти через 50 лет после того, как Альфред Вернер предложил правильные структуры координационных комплексов были резюмированы Беком и Надьпалом. [2] Ключом к методу Бьеррума было использование недавно разработанного стеклянного электрода и pH-метра для определения концентрации ионов водорода в растворе. Бьеррум признал, что образование комплекса металла с лигандом представляет собой своего рода кислотно-основное равновесие : за лиганд L существует конкуренция между ионом металла Mn + и ионом водорода H + . Это означает, что необходимо учитывать два одновременных равновесия. Далее электрические заряды для общности опущены. Два равновесия
Следовательно, следя за концентрацией ионов водорода во время титрования смеси М и HL основанием и зная константу кислотной диссоциации HL, можно определить константу устойчивости образования ML. Бьеррум определил константы устойчивости систем, в которых может образовываться множество комплексов.
В последующие двадцать лет произошел настоящий взрыв в количестве определенных констант устойчивости. Были обнаружены связи, подобные серии Ирвинга-Уильямса . Расчеты проводились вручную с использованием так называемых графических методов. Математика, лежащая в основе методов, использовавшихся в этот период, обобщена Россотти и Россотти. [3] Следующим ключевым событием стало использование компьютерной программы LETAGROP [4] [5] для выполнения расчетов. Это позволило исследовать системы, слишком сложные для оценки посредством ручных вычислений. Впоследствии были разработаны компьютерные программы, способные вообще работать со сложными состояниями равновесия, такие как SCOGS [6] и MINIQUAD [7], так что сегодня определение констант устойчивости стало почти «рутинной» операцией. Значения тысяч констант устойчивости можно найти в двух коммерческих базах данных. [8] [9]
Образование комплекса между ионом металла М и лигандом L на самом деле обычно представляет собой реакцию замещения. Например, в водных растворах ионы металлов будут присутствовать в виде акваионов , поэтому реакцию образования первого комплекса можно записать как
Константа равновесия для этой реакции определяется выражением
[L] следует читать как «концентрацию L», как и для других терминов в квадратных скобках. Выражение можно значительно упростить, удалив те члены, которые являются постоянными. Число молекул воды, присоединенных к каждому иону металла, постоянно. В разбавленных растворах концентрация воды практически постоянна. Выражение становится
Следуя этому упрощению, можно дать общее определение общего равновесия.
Это определение можно легко расширить, включив в него любое количество реагентов. Реагенты не обязательно должны представлять собой металл и лиганд, но могут представлять собой любые соединения, образующие комплекс. Константы устойчивости, определенные таким образом, являются константами ассоциации . Это может привести к некоторой путанице, поскольку значения p K a являются константами диссоциации . В компьютерных программах общего назначения все константы принято определять как константы ассоциации. Связь между двумя типами констант дается в константах ассоциации и диссоциации .
Кумулятивная или общая константа, обозначаемая символом β , представляет собой константу образования комплекса из реагентов. Например, кумулятивная константа образования ML 2 определяется выражением
Ступенчатые константы K 1 и K 2 относятся к образованию комплексов по одному этапу за раз.
Следует, что
Кумулятивную константу всегда можно выразить как произведение ступенчатых констант. И наоборот, любая ступенчатая константа может быть выражена как частное двух или более общих констант. Не существует общепринятого обозначения ступенчатых констант, хотя такой символ, как KЛ
МЛиногда встречается в литературе. Хорошей практикой является явное указание каждой константы устойчивости, как показано выше.
Образование гидроксокомплекса является типичным примером реакции гидролиза. Реакция гидролиза — это реакция, при которой субстрат реагирует с водой, расщепляя молекулу воды на ионы гидроксида и водорода. В этом случае гидроксид-ион образует комплекс с субстратом.
В воде концентрация гидроксида связана с концентрацией ионов водорода константой самоионизации K w .
Выражение для концентрации гидроксида подставляется в выражение константы образования
В общем, по реакции
В более старой литературе значение log K обычно указывается в качестве константы гидролиза. Значение log β * обычно указывается для гидролизованного комплекса с общей химической формулой M p L q (OH) r .
Можно считать, что кислота Льюиса A и основание Льюиса B образуют комплекс AB.
Существуют три основные теории, касающиеся силы кислот и оснований Льюиса и взаимодействия между ними.
Подробнее см.: Кислотно-основная реакция , Кислотный катализ , Экстракция (химия).
Термодинамика образования комплексов ионов металлов дает много важной информации. [13] В частности, это полезно для различения энтальпийных и энтропийных эффектов. Энтальпийные эффекты зависят от силы связи, а энтропийные эффекты связаны с изменениями порядка/беспорядка раствора в целом. Хелатный эффект, описанный ниже, лучше всего объясняется с точки зрения термодинамики.
Константа равновесия связана со стандартным изменением свободной энергии Гиббса для реакции
R — газовая постоянная , а T — абсолютная температура . При 25 °C Δ G ⊖ = (-5,708 кДж моль -1 ) ⋅ log β . Свободная энергия состоит из энтальпийного и энтропийного членов.
Стандартное изменение энтальпии можно определить калориметрическим методом или с помощью уравнения Ван-т-Гоффа , хотя калориметрический метод предпочтительнее. Когда определены как стандартное изменение энтальпии, так и константа стабильности, стандартное изменение энтропии легко рассчитать по приведенному выше уравнению.
Тот факт, что константы образования комплексов типа ML n ступенчато уменьшаются по величине с увеличением n , отчасти можно объяснить энтропийным фактором. Возьмем случай образования октаэдрических комплексов.
Для первого шага m = 6, n = 1 и лиганд может перейти в один из 6 сайтов. Для второго шага m = 5 и второй лиганд может войти только в один из 5 сайтов. Это означает, что на первом этапе больше случайности, чем на втором; Δ S ⊖ более положителен, поэтому Δ G ⊖ более отрицателен и . На этой основе можно рассчитать соотношение ступенчатых констант устойчивости, но экспериментальные соотношения не совсем одинаковы, поскольку Δ H ⊖ не обязательно одинаково для каждого шага. [14] Исключения из этого правила обсуждаются ниже, в разделах #хелатный эффект и #геометрические факторы.
Константа термодинамического равновесия K ⊖ для равновесия
можно определить [15] как
где {ML} — активность химического соединения ML и т. д. K ⊖ безразмерен , поскольку активность безразмерна. В числителе стоят активности продуктов, в знаменателе – активности реагирующих веществ. См. коэффициент активности для получения этого выражения.
Поскольку активность является продуктом концентрации и коэффициента активности ( γ ), определение также можно записать как
где [ML] представляет собой концентрацию ML, а Γ представляет собой частное коэффициентов активности. Это выражение можно обобщить как

Во избежание осложнений при использовании активностей константы устойчивости определяют , где это возможно, в среде, состоящей из раствора фонового электролита при высокой ионной силе , т. е. в условиях, при которых Г можно считать всегда постоянной. [15] Например, среда может представлять собой раствор 0,1 моль дм -3 нитрата натрия или 3 моль дм -3 перхлората натрия . Когда Γ постоянна, ею можно пренебречь и получить общее теоретическое выражение, приведенное выше.
Все опубликованные значения констант стабильности относятся к конкретной ионной среде, использованной при их определении, и разные значения получены в разных условиях, как показано для комплекса CuL (L = глицинат ). Кроме того, значения константы стабильности зависят от конкретного используемого электролита, поскольку значение Γ различно для разных электролитов даже при одинаковой ионной силе . Не обязательно должно быть какое-либо химическое взаимодействие между частицами, находящимися в равновесии, и фоновым электролитом, но такие взаимодействия могут иметь место в определенных случаях. Например, фосфаты образуют слабые комплексы с щелочными металлами , поэтому при определении констант устойчивости с участием фосфатов, таких как АТФ , в качестве фонового электролита будет использоваться, например, соль тетралкиламмония . Другой пример касается железа (III), которое образует слабые комплексы с галогенидами и другими анионами, но не с перхлорат -ионами.
Когда опубликованные константы относятся к ионной силе, отличной от той, которая требуется для конкретного применения, они могут быть скорректированы с помощью специфической теории ионов (SIT) и других теорий. [17]
Все константы равновесия изменяются с температурой согласно уравнению Ван 'т-Гоффа [18]
Альтернативно
R — газовая постоянная , а T — термодинамическая температура. Таким образом, для экзотермических реакций, где стандартное изменение энтальпии Δ H ⊖ отрицательно, K уменьшается с температурой, но для эндотермических реакций, где Δ H ⊖ положительно, K увеличивается с температурой.

Рассмотрим два равновесия в водном растворе между ионом меди (II), Cu 2+ и этилендиамином (en), с одной стороны, и метиламином , MeNH 2, с другой.
В первой реакции бидентатный лиганд этилендиамин образует хелатный комплекс с ионом меди. Хелатирование приводит к образованию пятичленного кольца. Во второй реакции бидентатный лиганд заменяется двумя монодентатными метиламиновыми лигандами примерно одинаковой донорной силы, а это означает, что энтальпия образования связей Cu–N примерно одинакова в обеих реакциях. В условиях равных концентраций меди и когда концентрация метиламина в два раза превышает концентрацию этилендиамина, концентрация бидентатного комплекса будет больше концентрации комплекса с двумя монодентатными лигандами. Эффект увеличивается с увеличением количества хелатных колец, поэтому концентрация комплекса ЭДТА , имеющего шесть хелатных колец, значительно выше, чем соответствующего комплекса с двумя монодентатными лигандами-донорами азота и четырьмя монодентатными карбоксилатными лигандами. Таким образом, явление хелатного эффекта является твердо установленным эмпирическим фактом: в сравнимых условиях концентрация хелатного комплекса будет выше, чем концентрация аналогичного комплекса с монодентатными лигандами.
Термодинамический подход к объяснению хелатного эффекта учитывает константу равновесия реакции: чем больше константа равновесия, тем выше концентрация комплекса.
Когда аналитическая концентрация метиламина в два раза превышает концентрацию этилендиамина, а концентрация меди одинакова в обеих реакциях, концентрация [Cu(en)] 2+ значительно превышает концентрацию [Cu(MeNH 2 ) 2 ] 2+ , поскольку β 11 ≫ β 12 .
Разница между двумя константами устойчивости в основном связана с разницей в стандартном изменении энтропии Δ S ⊖ . В реакции с хелатирующим лигандом находятся две частицы слева и одна справа, тогда как в уравнении с монодентатным лигандом — три частицы слева и одна справа. Это означает, что при образовании хелатного комплекса теряется меньшая энтропия беспорядка , чем при образовании комплекса с монодентатными лигандами. Это один из факторов, способствующих разнице энтропии. Другие факторы включают изменения сольватации и образование колец. Некоторые экспериментальные данные, иллюстрирующие эффект, показаны в следующей таблице. [19]

Эти данные показывают, что стандартные изменения энтальпии действительно примерно одинаковы для двух реакций и что основная причина, по которой хелатный комплекс настолько более стабилен, заключается в том, что стандартный энтропийный член гораздо менее неблагоприятен, более того, в данном случае он даже благоприятный. В общем, трудно точно объяснить термодинамические величины с точки зрения изменений раствора на молекулярном уровне, но ясно, что хелатный эффект является преимущественно эффектом энтропии. Другие объяснения, в том числе объяснение Шварценбаха [20] , обсуждаются у Гринвуда и Эрншоу. [19]
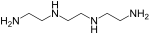
Хелатный эффект усиливается по мере увеличения количества хелатных колец. Например, комплекс [Ni(dien) 2 )] 2+ более устойчив, чем комплекс [Ni(en) 3 )] 2+ ; оба комплекса октаэдрические с шестью атомами азота вокруг иона никеля, но диен ( диэтилентриамин , 1,4,7-триазагептан) является тридентатным лигандом, а ен - бидентатным. Число хелатных колец на единицу меньше числа донорных атомов в лиганде. ЭДТА (этилендиаминтетрацетиновая кислота) имеет шесть донорных атомов, поэтому образует очень прочные комплексы с пятью хелатными кольцами. Лиганды, такие как DTPA , имеющие восемь донорных атомов, используются для образования комплексов с большими ионами металлов, такими как ионы лантаноидов или актинидов , которые обычно образуют 8- или 9-координационные комплексы. Пятичленные и шестичленные хелатные кольца дают наиболее устойчивые комплексы. 4-членные кольца подвержены внутренним напряжениям из-за небольшого угла между связями в кольце. Хелатный эффект также снижается при использовании 7- и 8-членных колец, поскольку более крупные кольца менее жесткие, поэтому при их образовании теряется меньше энтропии.


Отщепление протона от алифатической группы –ОН в водном растворе трудно осуществить, поскольку энергия, необходимая для этого процесса, достаточно велика. Таким образом, ионизация алифатических групп –ОН в водном растворе происходит лишь в особых случаях. Одно из таких обстоятельств обнаружено у соединений, содержащих субструктуру H 2 N–C–C–OH. Например, соединения, содержащие субструктуру 2-аминоэтанола, могут образовывать металл-хелатные комплексы с депротонированной формой H 2 N–C–C–O – . Хелатный эффект обеспечивает дополнительную энергию, необходимую для разрыва связи O–H.
Важный пример происходит с молекулой трис . Эту молекулу следует использовать с осторожностью в качестве буферного агента , поскольку она образует хелатные комплексы с такими ионами, как Fe 3+ и Cu 2+ .
Установлено, что стабильность комплекса меди(II) с макроциклическим лигандом цикламом (1,4,8,11-тетраазациклотетрадекан) оказалась значительно выше ожидаемой по сравнению со стабильностью комплекса с соответствующим амином с открытой цепью. . [21] Это явление было названо макроциклическим эффектом и его также интерпретировали как энтропийный эффект. Однако более поздние исследования показали, что здесь задействованы как энтальпийные, так и энтропийные факторы. [22]
Важным различием между макроциклическими лигандами и лигандами с открытой цепью (хелатирующими) является то, что они обладают селективностью в отношении ионов металлов, основанной на размере полости, в которую ион металла внедряется при образовании комплекса. Например, краун-эфир 18-краун-6 образует гораздо более прочные комплексы с ионом калия K + , чем с меньшим ионом натрия Na + . [23]
В гемоглобине ион железа(II) образует комплекс с макроциклическим порфириновым кольцом. В статье «Гемоглобин» неверно указано, что оксигемоглогин содержит железо (III). Сейчас известно, что железо(II) в гемоглобине представляет собой низкоспиновый комплекс , тогда как в оксигемоглобине — высокоспиновый комплекс. Низкоспиновый ион Fe 2+ плотно вписывается в полость порфиринового кольца, но высокоспиновый ион железа(II) значительно крупнее и атом железа вытесняется из плоскости макроциклического лиганда. [24] Этот эффект способствует способности гемоглобина обратимо связывать кислород в биологических условиях. В витамине B12 ион кобальта(II) удерживается в корриновом кольце . Хлорофилл представляет собой макроциклический комплекс магния(II).
Последовательные ступенчатые константы формирования K n в ряду типа ML n ( n = 1, 2, ...) обычно уменьшаются по мере увеличения n . Исключения из этого правила возникают, когда геометрия комплексов ML n не одинакова для всех членов ряда. Классическим примером является образование комплекса диамминсеребра(I) [Ag(NH 3 ) 2 ] + в водном растворе.
В этом случае К 2 > К 1 . Причина этого в том, что в водном растворе ион, записанный как Ag + , фактически существует в виде четырехкоординатной тетраэдрической формы воды [Ag(H 2 O) 4 ] + . Тогда первым шагом является реакция замещения, включающая замещение связанной молекулы воды аммиаком с образованием тетраэдрического комплекса [Ag(NH 3 )(H 2 O) 3 ] + . На втором этапе теряются все аквалиганды и образуется линейный двухкоординированный продукт [H 3 N–Ag–NH 3 ] + . Анализ термодинамических данных [25] показывает, что разница в изменении энтропии вносит основной вклад в разницу констант устойчивости двух реакций комплексообразования.
Существуют и другие примеры изменения октаэдра на тетраэдр, как при образовании [CoCl 4 ] 2- из [Co(H 2 O) 6 ] 2+ .
Арланд, Чатт и Дэвис предположили, что ионы металлов можно отнести к классу А, если они образуют более прочные комплексы с лигандами, донорными атомами которых являются азот , кислород или фтор , чем к лигандам, донорными атомами которых являются фосфор , сера или хлор , и к классу В, если наоборот. истинный. [26] Например, Ni 2+ образует более прочные комплексы с аминами , чем с фосфинами , а Pd 2+ образует более прочные комплексы с фосфинами, чем с аминами. Позднее Пирсон предложил теорию твердых и мягких кислот и оснований (теорию HSAB). [27] В этой классификации металлы класса А представляют собой жёсткие кислоты, а металлы класса В — мягкие кислоты. Некоторые ионы, такие как медь(I), классифицируются как пограничные. Жесткие кислоты образуют более прочные комплексы с твердыми основаниями, чем с мягкими основаниями. В общих чертах, взаимодействия «жесткое-жесткое» имеют преимущественно электростатический характер, тогда как взаимодействия «мягкое-мягкое» имеют преимущественно ковалентную природу. Теория HSAB, хотя и полезна, но носит лишь полуколичественный характер. [28]
Твердость иона металла увеличивается со степенью окисления. Примером такого эффекта может служить тот факт, что Fe 2+ имеет тенденцию образовывать более прочные комплексы с N -донорными лигандами, чем с O -донорными лигандами, а для Fe 3+ верно обратное .
Ряд Ирвинга -Вильямса относится к высокоспиновому октаэдрическому иону двухвалентного металла первой переходной серии. Он расставляет устойчивости комплексов в порядок
Было обнаружено, что этот порядок сохраняется для широкого спектра лигандов. [29] Есть три направления объяснения этой серии.
Другой пример влияния ионного радиуса - устойчивое увеличение устойчивости комплексов с данным лигандом по ряду трехвалентных ионов лантаноидов - эффект известного сжатия лантаноидов .
Значения констант стабильности используются в самых разных приложениях. Хелатная терапия используется при лечении различных заболеваний, связанных с металлами, таких как перегрузка железом у больных β- талассемией , которым переливали кровь. Идеальный лиганд связывается с ионом целевого металла, а не с другими, но такой степени селективности достичь очень трудно. Синтетический препарат деферипрон достигает селективности за счет наличия двух донорных атомов кислорода, благодаря чему он связывается с Fe 3+ , а не с любыми другими двухвалентными ионами, присутствующими в организме человека, такими как Mg 2+ , Ca 2+ и Zn 2+ . . Лечение отравления такими ионами, как Pb 2+ и Cd 2+, гораздо сложнее, поскольку оба они являются двухвалентными ионами, и селективность обеспечить труднее. [30] Избыток меди при болезни Вильсона можно удалить пеницилламином или триэтилентетрамином (ТЭТА). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило DTPA для лечения отравления плутонием .
DTPA также используется в качестве комплексообразователя гадолиния при усилении контрастности при МРТ . Требованием в этом случае является то, чтобы комплекс был очень прочным, так как Gd 3+ очень токсичен. Большая константа стабильности октадентатного лиганда гарантирует, что концентрация свободного Gd 3+ практически незначительна, что значительно ниже порога токсичности. [31] Кроме того, лиганд занимает только 8 из 9 координационных мест иона гадолиния. Девятый участок занимает молекула воды, которая быстро обменивается с окружающей ее жидкостью, и именно этот механизм превращает парамагнитный комплекс в контрастный реагент.
ЭДТА образует настолько прочные комплексы с большинством двухвалентных катионов, что находит множество применений . Например, он часто присутствует в стиральном порошке и действует как смягчитель воды, связывая ионы кальция и магния.
Селективность макроциклических лигандов может быть использована в качестве основы для создания ионоселективного электрода . Например, доступны калийселективные электроды , в которых используется встречающийся в природе макроциклический антибиотик валиномицин .
Ионообменная смола, такая как хелекс 100 , которая содержит хелатирующие лиганды, связанные с полимером , может использоваться в умягчителях воды и в методах хроматографического разделения. При экстракции растворителями образование электронейтральных комплексов позволяет экстрагировать катионы в органические растворители. Например , при переработке ядерного топлива уран (VI) и плутоний (VI) извлекаются в керосин в виде комплексов [МО 2 (ТБФ) 2 (NO 3 ) 2 ] (ТБФ = три- н -бутилфосфат ). При межфазном катализе вещество, нерастворимое в органическом растворителе, можно сделать растворимым путем добавления подходящего лиганда. Например, окисления перманганата калия можно добиться, добавляя к водной реакционной смеси каталитическое количество краун-эфира и небольшое количество органического растворителя, так что реакция окисления происходит в органической фазе.
Во всех этих примерах лиганд выбирают исходя из констант устойчивости образующихся комплексов. Например, ТБФ используется при переработке ядерного топлива, поскольку (помимо других причин) он образует комплекс, достаточно прочный для экстракции растворителем, но достаточно слабый, чтобы этот комплекс мог быть разрушен азотной кислотой с выделением уранил- катиона в виде нитратокомплексов . такие как [UO 2 (NO 3 ) 4 ] 2-, обратно в водную фазу.
Супрамолекулярные комплексы удерживаются вместе за счет водородных связей, гидрофобных сил, сил Ван-дер-Ваальса, π-π-взаимодействий и электростатических эффектов, которые можно описать как нековалентные связи . Приложения включают молекулярное распознавание , химию «гость-хозяин» и датчики анионов .
Типичное применение в молекулярном распознавании включало определение констант образования комплексов, образующихся между триподально замещенной молекулой мочевины и различными сахаридами . [32] Исследование проводилось с использованием неводного растворителя и измерений химического сдвига ЯМР . Целью было исследование селективности в отношении сахаридов.
Примером использования супрамолекулярных комплексов при разработке хемосенсоров является использование ансамблей переходных металлов для чувствительности к АТФ . [33]
Комплексообразование анионов может быть достигнуто путем инкапсуляции аниона в подходящую клетку. Селективность можно обеспечить путем разработки формы клетки. Например, дикарбоксилат-анионы могут быть инкапсулированы в эллипсоидальной полости в большую макроциклическую структуру, содержащую два иона металла. [34]
Метод, разработанный Бьеррумом, по-прежнему остается основным методом, используемым сегодня, хотя точность измерений значительно возросла. Чаще всего раствор, содержащий ион металла и лиганд в среде с высокой ионной силой , сначала подкисляют до точки, при которой лиганд полностью протонируется . Затем этот раствор титруют , часто с помощью автотитратора с компьютерным управлением, раствором основания, не содержащего CO 2 . Концентрацию или активность ионов водорода контролируют с помощью стеклянного электрода. Набор данных, используемый для расчета, состоит из трех компонентов: заявление, определяющее природу присутствующих химических веществ, называемое моделью системы, подробности, касающиеся концентраций реагентов, используемых при титровании, и, наконец, экспериментальные измерения в вид пар титр и рН (или ЭДС ).
Могут использоваться другие ионоселективные электроды (ИСЭ). Например, фторидный электрод может быть использован при определении устойчивости комплексов фторокомплексов иона металла.
Не всегда возможно использовать ISE. В этом случае титрование можно контролировать с помощью других типов измерений. Ультрафиолетово-видимая спектроскопия , флуоресцентная спектроскопия и ЯМР-спектроскопия являются наиболее часто используемыми альтернативами. Текущая практика заключается в измерении поглощения или флуоресценции в диапазоне длин волн и одновременной обработке этих данных. Различные химические сдвиги ЯМР также можно соединить вместе.
Химическая модель будет включать значения констант протонирования лиганда, которые будут определены в отдельных экспериментах, значение log K w и оценки неизвестных констант устойчивости образующихся комплексов. Эти оценки необходимы, поскольку в расчете используется нелинейный алгоритм наименьших квадратов. Оценки обычно получают на основе химически аналогичной системы. Базы данных констант стабильности [8] [9] могут быть очень полезны при поиске опубликованных значений констант стабильности для родственных комплексов.
В некоторых простых случаях расчеты можно выполнить в электронной таблице. [35] В противном случае расчеты выполняются с помощью компьютерных программ общего назначения. Наиболее часто используемые программы:
В биохимии константы образования аддуктов можно получить с помощью измерений изотермической титровальной калориметрии (ИТК). Этот метод дает как константу устойчивости, так и стандартное изменение энтальпии для равновесия. [45] В основном из-за наличия программного обеспечения он ограничивается комплексами стехиометрии 1:1.
Следующие ссылки предназначены для критических обзоров опубликованных констант стабильности для различных классов лигандов. Все эти обзоры публикуются ИЮПАК , а полный текст доступен бесплатно в формате pdf.
{{cite journal}}: CS1 maint: multiple names: authors list (link)Сигел, Роланд, нокаут; Скиландат, Мириам; Сигел, Астрид; Опершалл, Берт П.; Сигель, Хельмут (2013). «Глава 8. Комплексообразование кадмия с остатками сахаров , азотистыми основаниями , фосфатами , нуклеотидами и нуклеиновыми кислотами ». В Сигеле, Астрид; Сигель, Хельмут; Сигел, Роланд КО (ред.). Кадмий: от токсикологии к незаменимости (PDF) . Ионы металлов в науках о жизни. Том. 11. Спрингер. стр. 191–274. дои : 10.1007/978-94-007-5179-8_8. ПМИД 23430775.
Соваго, Имре; Варнадь, Каталин (2013). «Глава 9. Комплексы кадмия(II) аминокислот и пептидов». В Сигеле, Астрид; Сигель, Хельмут; Сигел, Роланд КО (ред.). Кадмий: от токсикологии к эссенциальности . Ионы металлов в науках о жизни. Том. 11. Спрингер. стр. 275–302. дои : 10.1007/978-94-007-5179-8_9. ПМИД 23430776.
Яцимирский Константин Борисович; Васильев, Владимир Павлович (1960). Константы неустойчивости сложных соединений . Перевод Паттерсона, DA OUP.