Болезнь Вильсона (также называемая гепатолентикулярной дегенерацией ) — это генетическое заболевание, характеризующееся избыточным накоплением меди в организме. Симптомы обычно связаны с мозгом и печенью . Симптомы, связанные с печенью, включают рвоту , слабость, накопление жидкости в животе , отек ног , желтоватую кожу и зуд . Симптомы, связанные с мозгом, включают тремор , мышечную скованность, проблемы с речью, изменения личности, беспокойство и психоз . [1]
Болезнь Вильсона вызывается мутацией в гене белка болезни Вильсона ( ATP7B ) . Этот белок переносит избыток меди в желчь , где она выводится с отходами. Заболевание является аутосомно-рецессивным ; чтобы люди заболели, они должны унаследовать мутировавшую копию гена от обоих родителей. Диагностика может быть сложной и часто включает в себя комбинацию анализов крови, мочи и биопсии печени . Генетическое тестирование может использоваться для скрининга членов семьи тех, кто заболел. [1]
Болезнь Вильсона обычно лечат с помощью диетических изменений и лекарств. Диетические изменения включают в себя диету с низким содержанием меди и отказ от использования медной посуды. Используемые лекарства включают хелатирующие агенты , такие как триентин и D -пеницилламин , и добавки цинка . Осложнения болезни Вильсона могут включать печеночную недостаточность и проблемы с почками . Трансплантация печени может быть полезна тем, для кого другие методы лечения неэффективны или если возникает печеночная недостаточность. [1]
Болезнь Вильсона встречается примерно у одного из 30 000 человек. [1] Симптомы обычно проявляются в возрасте от 5 до 35 лет. [1] Впервые она была описана в 1854 году немецким патологом Фридрихом Теодором фон Фрерихсом и названа в честь британского невролога Сэмюэля Вильсона . [4]
Основными местами накопления меди являются печень и мозг , и, следовательно, заболевание печени и нейропсихиатрические симптомы являются основными признаками, которые приводят к диагностике. [5] Люди с проблемами печени, как правило, обращаются за медицинской помощью раньше, как правило, в детском или подростковом возрасте, чем те, у кого есть неврологические и психиатрические симптомы, которым, как правило, 20 лет или больше. Некоторых выявляют только потому, что у родственников была диагностирована болезнь Вильсона; многие из них при тестировании оказываются испытывающими симптомы этого состояния, но не получают диагноза. [6]
Заболевание печени может проявляться усталостью , желтухой [7], повышенной склонностью к кровотечениям или спутанностью сознания (из-за печеночной энцефалопатии ) и портальной гипертензией . Последнее, состояние, при котором давление в воротной вене заметно увеличивается, приводит к варикозному расширению вен пищевода , кровеносным сосудам в пищеводе , которые могут кровоточить опасным для жизни образом, а также к увеличению селезенки ( спленомегалии ) и накоплению жидкости в брюшной полости ( асциту ). При осмотре могут наблюдаться признаки хронического заболевания печени, такие как паукообразные ангиомы (небольшие расширенные кровеносные сосуды, обычно на груди). Хронический активный гепатит вызвал цирроз печени у большинства к тому времени, как у них появились симптомы. В то время как большинство людей с циррозом имеют повышенный риск гепатоцеллюлярной карциномы (рака печени), этот риск относительно очень низок при болезни Вильсона. [5]
Около 5% всех людей диагностируются только тогда, когда у них развивается молниеносная острая печеночная недостаточность , часто в контексте гемолитической анемии (анемия из-за разрушения эритроцитов). Это приводит к аномалиям в выработке белка (определяется по нарушенной коагуляции ) и метаболизму печенью. Нарушенный метаболизм белка приводит к накоплению отходов, таких как аммиак , в кровотоке. Когда они раздражают мозг, у человека развивается печеночная энцефалопатия (спутанность сознания, кома, судороги и, наконец, опасный для жизни отек мозга ). [5]

Около половины людей с болезнью Вильсона имеют неврологические или психиатрические симптомы. У большинства изначально наблюдается легкое ухудшение когнитивных функций и неуклюжесть, а также изменения в поведении. Затем обычно следуют специфические неврологические симптомы, часто в форме паркинсонизма (ригидность по типу зубчатого колеса, брадикинезия или замедленные движения и отсутствие равновесия — наиболее распространенные черты паркинсонизма [8] ) с типичным тремором рук или без него , маскированным выражением лица, невнятной речью, атаксией (отсутствием координации) или дистонией (скручиванием и повторяющимися движениями части тела). Приступы и мигрень , по-видимому, более распространены при болезни Вильсона. [5] Характерный тремор, описываемый как «тремор хлопающих крыльев», встречается у многих людей с болезнью Вильсона; он отсутствует в состоянии покоя, но может быть спровоцирован отведением рук и сгибанием локтей к средней линии. [9]
Когнитивные функции также могут быть затронуты при болезни Вильсона, в двух, не исключающих друг друга, категориях - расстройство лобной доли (может проявляться как импульсивность , нарушение суждений, беспорядочные половые связи , апатия и исполнительная дисфункция с плохим планированием и принятием решений) и подкорковая деменция (может проявляться как замедленное мышление, потеря памяти и исполнительная дисфункция , без признаков афазии , апраксии или агнозии ). Считается, что эти когнитивные нарушения связаны и тесно связаны с психиатрическими проявлениями заболевания. [8]
Психиатрические проблемы, вызванные болезнью Вильсона, могут включать изменения поведения, депрессию , тревожные расстройства и психоз . [5] Психиатрические симптомы обычно наблюдаются в сочетании с неврологическими симптомами и редко проявляются сами по себе. Эти симптомы часто плохо определены и иногда могут быть отнесены к другим причинам. Из-за этого диагноз болезни Вильсона редко ставится, когда присутствуют только психиатрические симптомы. [8]
Медицинские состояния связаны с накоплением меди при болезни Вильсона:

Ген болезни Вильсона ( ATP7B ) находится на хромосоме 13 (13q14.3) и экспрессируется в основном в печени, почках и плаценте . Ген кодирует АТФазу P-типа (фермент транспорта катионов) , которая переносит медь в желчь и включает ее в церулоплазмин . [5] Большинство людей с болезнью Вильсона — 60% — гомозиготны по мутациям ATP7B (две аномальные копии), а 30% из них имеют только одну аномальную копию. Примерно в 10% случаев у людей с болезнью Вильсона не обнаруживается никаких мутаций. [6]
Хотя было описано 300 возможных мутаций ATP7B , очень небольшое количество из них вызывает большинство случаев болезни Вильсона; мутация, которая будет у человека, как правило, специфична для популяции, к которой он принадлежит. Например, в западных популяциях мутация H1069Q (замена гистидина на глутамин в позиции 1069 в белке) присутствует в 37%–63% случаев, в то время как в Китае эта мутация встречается очень редко; R778L ( аргинин на лейцин в позиции 778) там встречается чаще. Относительно мало известно об относительном влиянии различных мутаций, хотя мутация H1069Q, по-видимому, предсказывает более позднее начало и преимущественно неврологические проблемы, согласно некоторым исследованиям. [5] [15] Комплексный клинически аннотированный ресурс WilsonGen предоставляет клиническую классификацию вариантов в соответствии с последними рекомендациями ACMG и AMP. [16]
Нормальная вариация в гене PRNP может изменить течение заболевания, задерживая возраст начала и влияя на тип развивающихся симптомов. Этот ген производит прионный белок , который активен в мозге и других тканях, а также, по-видимому, участвует в транспортировке меди. [17] Первоначально предполагалась роль гена ApoE , но не была подтверждена. [15]
Заболевание наследуется по аутосомно-рецессивному типу. Чтобы унаследовать его, оба родителя человека должны быть носителями пораженного гена. У большинства людей с болезнью Вильсона нет семейной истории этого заболевания. [15] Люди с одним аномальным геном называются носителями (гетерозиготами) и могут иметь легкие, но незначительные с медицинской точки зрения нарушения метаболизма меди. [14]
Существует несколько наследственных заболеваний, которые вызывают перегрузку медью в печени; болезнь Вильсона является наиболее распространенной из них. Все они могут вызвать цирроз в молодом возрасте. Другие заболевания, связанные с перегрузкой медью, — это индийский детский цирроз печени (ICC), эндемический тирольский инфантильный цирроз печени и идиопатический медный токсикоз. Эти три, в отличие от болезни Вильсона, не связаны с мутациями ATP7B ; например, ICC была связана с мутациями в генах KRT8 и KRT18 . [15]

Медь необходима организму для выполнения ряда функций , в основном в качестве кофактора для ряда ферментов, таких как церулоплазмин, цитохром с оксидаза , дофамин β-гидроксилаза , супероксиддисмутаза и тирозиназа . [15]
Медь поступает в организм через пищеварительный тракт . Транспортный белок на клетках тонкого кишечника , мембранный транспортер меди 1 (Ctr1; SLC31A1), переносит медь внутрь клеток, где часть связывается с металлотионеином , а часть переносится ATOX1 в органеллу, известную как транс-сеть Гольджи . Здесь, в ответ на повышение концентрации меди, фермент, называемый ATP7A (белок Менкеса), высвобождает медь в воротную вену в печень. Клетки печени также переносят белок CMT1, а металлотионеин и ATOX1 связывают его внутри клетки, но здесь ATP7B связывает медь с церулоплазмином и высвобождает ее в кровоток, а также удаляет избыток меди, секретируя ее в желчь. Обе функции ATP7B нарушаются при болезни Вильсона. Медь накапливается в ткани печени; Церулоплазмин все еще секретируется, но в форме, в которой отсутствует медь (называемой апоцерулоплазмином), и быстро разрушается в кровотоке. [15]
Когда количество меди в печени превышает количество белков, которые обычно ее связывают, это вызывает окислительное повреждение печени посредством процесса, известного как химия Фентона ; это повреждение в конечном итоге приводит к хроническому активному гепатиту , фиброзу (отложению соединительной ткани) и циррозу . Печень также выделяет в кровоток медь, которая не связана с церулоплазмином. Эта свободная медь осаждается по всему телу, но особенно в почках, глазах и мозге. В мозге большая часть меди откладывается в базальных ганглиях , особенно в скорлупе и бледном шаре (вместе называемых чечевицеобразным ядром ); эти области обычно участвуют в координации движения и играют важную роль в нейрокогнитивных процессах, таких как обработка стимулов и регуляция настроения. Повреждение этих областей, опять же химией Фентона, вызывает нейропсихиатрические симптомы, наблюдаемые при болезни Вильсона. [15]
Неясно, почему болезнь Вильсона вызывает гемолиз, но различные данные свидетельствуют о том, что высокий уровень свободной (не связанной с церулоплазмином) меди может напрямую влиять на окисление гемоглобина , или ингибировать ферменты, обеспечивающие энергию в эритроцитах , или вызывать прямое повреждение клеточных мембран . [18]
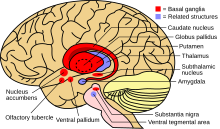
Болезнь Вильсона можно заподозрить на основе любого из симптомов, упомянутых выше, или когда у близкого родственника обнаружена болезнь Вильсона. У большинства из них наблюдаются слегка аномальные показатели печеночных тестов , такие как повышенный уровень аспартатаминотрансферазы , аланинаминотрансферазы и билирубина . Если повреждение печени значительное, альбумин может быть снижен из-за неспособности поврежденных клеток печени вырабатывать этот белок; аналогично, протромбиновое время (тест на коагуляцию ) может быть увеличено, поскольку печень неспособна вырабатывать белки, известные как факторы свертывания. [5] Уровни щелочной фосфатазы относительно низкие у людей с острой печеночной недостаточностью, связанной с болезнью Вильсона. [19] Если наблюдаются неврологические симптомы, обычно проводится магнитно-резонансная томография мозга; она показывает гиперинтенсивность в части мозга, называемой базальными ганглиями, в режиме T2 . [14] МРТ также может показать характерный рисунок «лица гигантской панды» . [20]
Неизвестно ни одного абсолютно надежного теста на болезнь Вильсона, но уровни церулоплазмина и меди в крови, а также количество меди, выделяемой с мочой в течение 24-часового периода, вместе используются для формирования впечатления о количестве меди в организме. Наиболее точным тестом является биопсия печени . [5]

Уровень церулоплазмина аномально низок (<0,2 г/л) в 80–95% случаев. [5] Однако он может присутствовать на нормальном уровне у людей с продолжающимся воспалением , поскольку является белком острой фазы . Низкий уровень церулоплазмина также обнаруживается при болезни Менкеса и ацерулоплазминемии , которые связаны с болезнью Вильсона, но встречаются гораздо реже. [5] [14] Сочетание неврологических симптомов, глазных признаков и низкого уровня церулоплазмина считается достаточным для диагностики болезни Вильсона. Однако во многих случаях необходимы дополнительные тесты. [14]
Уровень меди в сыворотке низкий, что может показаться парадоксальным, учитывая, что болезнь Вильсона является болезнью избытка меди. Однако 95% меди в плазме переносится церулоплазмином, который часто бывает низким при болезни Вильсона. Уровень меди в моче повышен при болезни Вильсона и собирается в течение 24 часов в бутылке с вкладышем без меди. Уровни выше 100 мкг/24 ч (1,6 мкмоль/24 ч) подтверждают болезнь Вильсона, а уровни выше 40 мкг/24 ч (0,6 мкмоль/24 ч) являются строго показательными. [5] Высокий уровень меди в моче не является уникальным для болезни Вильсона; он иногда наблюдается при аутоиммунном гепатите и холестазе (любом заболевании, препятствующем току желчи из печени в тонкую кишку). [14]
У детей может быть использован следующий тест на пеницилламин : назначается 500 мг пеницилламина перорально, и вся моча собирается в течение 24 часов. Если вся дневная моча содержит более 1600 мкг (25 мкмоль) меди, это надежный показатель болезни Вильсона. Этот тест не был проверен для взрослых. [14]
Глаза пациента осматриваются с помощью щелевой лампы для выявления колец Кайзера-Флейшера , которые тесно связаны с болезнью Вильсона и вызваны отложением меди на внутренней поверхности роговицы в десцеметовой оболочке . [10]
После того, как другие исследования указали на болезнь Вильсона, идеальным тестом является удаление небольшого количества ткани печени с помощью биопсии печени. Это оценивается микроскопически на предмет степени стеатоза и цирроза, а гистохимия и количественное определение меди используются для измерения тяжести накопления меди. Уровень 250 мкг меди на грамм высушенной ткани печени подтверждает болезнь Вильсона. Иногда обнаруживаются более низкие уровни меди; в этом случае сочетание результатов биопсии со всеми другими тестами все еще может привести к формальному диагнозу болезни Вильсона. [5]
На ранних стадиях заболевания биопсия обычно показывает стеатоз (отложение жирового материала), повышенное содержание гликогена в ядре и области некроза (гибель клеток). При более поздней стадии заболевания наблюдаемые изменения весьма схожи с изменениями, наблюдаемыми при аутоиммунном гепатите, такими как инфильтрация воспалительными клетками, частичный некроз и фиброз (рубцовая ткань). При поздней стадии заболевания, наконец, основным признаком является цирроз. При острой печеночной недостаточности наблюдается дегенерация клеток печени и разрушение архитектуры печеночной ткани, как правило, на фоне цирротических изменений. Гистохимические методы обнаружения меди непоследовательны и ненадежны, и их применение в одиночку считается недостаточным для установления диагноза. [14]
Может быть выполнен анализ мутаций гена ATP7B , а также других генов, связанных с накоплением меди в печени. После подтверждения мутации члены семьи могут быть обследованы на наличие заболевания в рамках клинического генетического семейного консультирования. [5] Важно отслеживать региональное распределение генов, связанных с болезнью Вильсона, поскольку это может помочь врачам разработать соответствующие стратегии скрининга. Поскольку мутации гена ATP7B различаются между популяциями, исследования и генетическое тестирование, проводимые в таких странах, как США или Великобритания, могут создавать проблемы, поскольку они, как правило, имеют более смешанное население. [21]
В целом рекомендуется диета с низким содержанием продуктов, содержащих медь. Продукты с высоким содержанием меди, которых следует избегать при болезни Вильсона, включают грибы , орехи , шоколад , сухофрукты , печень, семена кунжута, кунжутное масло и моллюсков . [5]
Существуют методы лечения болезни Вильсона. Некоторые из них увеличивают выведение меди из организма, в то время как другие препятствуют усвоению меди из рациона.
Обычно пеницилламин является первым используемым средством лечения. Он связывается с медью (путем хелатирования ) и приводит к выделению меди с мочой. Следовательно, можно проводить мониторинг количества меди в моче, чтобы убедиться, что принята достаточно высокая доза. Пеницилламин не лишен проблем; около 20% испытывают побочные эффекты или осложнения лечения пеницилламином, такие как лекарственная волчанка (вызывающая боли в суставах и кожную сыпь) или миастения (нервное заболевание, приводящее к мышечной слабости). Из тех, у кого наблюдались неврологические симптомы, почти половина испытывает парадоксальное ухудшение своих симптомов. Хотя это явление наблюдается и при других методах лечения болезни Вильсона, его обычно принимают как показание к прекращению приема пеницилламина и началу лечения второй линии. [5] [14] Те, у кого непереносимость пеницилламина, могут вместо этого начать принимать триентина гидрохлорид , который также обладает хелатирующими свойствами. Некоторые рекомендуют триентин в качестве терапии первой линии, но опыт применения пеницилламина более обширен. [14] Еще одним агентом с известной активностью при болезни Вильсона, находящимся в стадии клинического исследования Wilson Therapeutics , является тетратиомолибдат . Он считается экспериментальным, [14] хотя некоторые исследования показали его полезный эффект. [5]
После того, как все результаты вернутся к норме, цинк (обычно в форме рецепта на ацетат цинка под названием Galzin) может быть использован вместо хелаторов для поддержания стабильного уровня меди в организме. Цинк стимулирует металлотионеин , белок в клетках кишечника, который связывает медь и предотвращает ее всасывание и транспортировку в печень. Терапия цинком продолжается, если симптомы не возвращаются или если увеличивается выделение меди с мочой. [14]
В редких случаях, когда ни одно из пероральных средств не эффективно, особенно при тяжелых неврологических заболеваниях, иногда необходим димеркапрол (британский анти-люизит). Это лечение вводится внутримышечно (в мышцу) каждые несколько недель и имеет неприятные побочные эффекты, такие как боль. [22]
Людей, у которых нет симптомов (например, тех, кому поставили диагноз в ходе семейного скрининга или только в результате аномальных результатов тестов), как правило, лечат, поскольку накопление меди может вызвать долгосрочный ущерб в будущем. Неясно, лучше ли лечить этих людей пеницилламином или ацетатом цинка. [14]
Физиотерапия и трудотерапия полезны для пациентов с неврологической формой заболевания. Лечение хелатированием меди может занять до шести месяцев, чтобы начать работать, и эти методы лечения могут помочь справиться с атаксией , дистонией и тремором, а также предотвратить развитие контрактур , которые могут возникнуть в результате дистонии. [23]
Трансплантация печени является эффективным средством лечения болезни Вильсона, но применяется только в особых случаях из-за рисков и осложнений, связанных с процедурой. Она применяется в основном у людей с фульминантной печеночной недостаточностью, которые не реагируют на медикаментозное лечение, или у людей с прогрессирующим хроническим заболеванием печени. Трансплантации печени избегают при тяжелых нейропсихиатрических заболеваниях, при которых ее польза не была продемонстрирована. [5] [14]
При отсутствии лечения болезнь Вильсона имеет тенденцию прогрессировать и в конечном итоге приводит к летальному исходу. К серьезным осложнениям относятся цирроз печени, острая почечная недостаточность и психоз. Могут возникнуть рак печени и холангиокарцинома , но с меньшей частотой, чем другие хронические заболевания печени, и риск значительно снижается при лечении. [13] При раннем выявлении и лечении большинство из тех, кто страдает, могут жить относительно нормальной жизнью и иметь продолжительность жизни, близкую к продолжительности жизни населения в целом. [13] Печеночные и неврологические повреждения, которые возникают до лечения, могут улучшиться, но часто они необратимы. [24] Фертильность обычно нормальная, и осложнения беременности не увеличиваются у тех, у кого болезнь Вильсона, которую лечат. [13]
Заболевание носит имя британского врача Сэмюэля Александра Кинниера Уилсона (1878–1937), невролога, который описал это состояние, включая патологические изменения в мозге и печени, в 1912 году. [25] Работа Уилсона была предшествовавшей и основанной на отчетах немецкого невролога Карла Вестфаля (в 1883 году), который назвал его «псевдосклерозом»; британского невролога Уильяма Говерса (в 1888 году); [26] финского невропатолога Эрнста Александра Хомена (в 1889–1892 годах), который отметил наследственную природу заболевания; [27] и Адольфа Штрюмпелла (в 1898 году), который описал цирроз печени. [26] Невропатолог Джон Натаниэль Камингс установил связь с накоплением меди в печени и мозге в 1948 году. [28] Возникновение гемолиза было отмечено в 1967 году. [29]
В 1951 году Камингс (в Англии) и новозеландский невролог Дерек Денни-Браун (работавший в США) одновременно сообщили о первом эффективном лечении с использованием хелатора металлов британского анти-люизита . [30] [31] Это лечение должно было быть инъекционным, но было одним из первых методов лечения, доступных в области неврологии, области, которая классически могла наблюдать и диагностировать, но имела мало методов лечения. [26] [32] Первый пероральный хелатирующий агент, эффективный при болезни Вильсона, пеницилламин , был открыт в 1956 году британским неврологом Джоном Уолшем. [33] В 1982 году Уолш также представил триентин, [34] и был первым, кто разработал тетратиомолибдат для клинического использования. [35] Терапия ацетатом цинка первоначально появилась в Нидерландах, где врачи Схаувинк и Хугенрад использовали ее в 1961 и 1970-х годах соответственно, и была впоследствии доработана Брюэром и его коллегами из Мичиганского университета . [22] [36]
Генетическая основа болезни Вильсона и ее связь с мутациями ATP7B были выяснены несколькими исследовательскими группами в 1980-х и 1990-х годах. [37] [38]
Наследственное накопление меди было описано у бедлингтон-терьеров , [39] где оно обычно влияет только на печень. У бедлингтон-терьеров это происходит из-за мутаций в гене COMMD1 (или MURR1 ). [40] Открытие этих мутаций у собак побудило исследователей изучить соответствующие человеческие гены, но мутации COMMD1 не могли быть обнаружены у людей с не-Вильсоновскими состояниями накопления меди (такими как индийский детский цирроз ). [41]
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на июль 2024 г. ( ссылка )