
В биохимии нуклеаза (также архаично известная как нуклеодеполимераза или полинуклеотидаза ) — это фермент, способный расщеплять фосфодиэфирные связи , которые связывают нуклеотиды вместе , образуя нуклеиновые кислоты . Нуклеазы по-разному влияют на одно- и двухцепочечные разрывы в своих целевых молекулах. В живых организмах они являются важными механизмами для многих аспектов восстановления ДНК . Дефекты в некоторых нуклеазах могут вызывать генетическую нестабильность или иммунодефицит . [1] Нуклеазы также широко используются в молекулярном клонировании . [2]
Существуют две основные классификации, основанные на локусе активности. Экзонуклеазы переваривают нуклеиновые кислоты с концов. Эндонуклеазы действуют на области в середине молекул-мишеней. Они далее подразделяются на дезоксирибонуклеазы и рибонуклеазы . Первые действуют на ДНК , последние на РНК . [2]
В конце 1960-х годов ученые Стюарт Линн и Вернер Арбер выделили примеры двух типов ферментов, ответственных за ограничение роста фагов в бактериях Escherichia coli ( E. coli ). [3] [4] Один из этих ферментов добавлял метильную группу к ДНК, генерируя метилированную ДНК , в то время как другой расщеплял неметилированную ДНК в самых разных местах по длине молекулы. Первый тип фермента назывался « метилазой », а другой — « нуклеазой рестрикции ». Эти ферментативные инструменты были важны для ученых, которые собирали инструменты, необходимые для « вырезания и вставки » молекул ДНК. Затем потребовался инструмент, который бы разрезал ДНК в определенных местах, а не в случайных местах по длине молекулы, чтобы ученые могли разрезать молекулы ДНК предсказуемым и воспроизводимым образом.
Важное развитие произошло, когда HO Smith , KW Wilcox и TJ Kelly , работая в Университете Джонса Хопкинса в 1968 году, выделили и охарактеризовали первую рестриктазу , функционирование которой зависело от определенной последовательности нуклеотидов ДНК . Работая с бактериями Haemophilus influenzae , эта группа выделила фермент, названный HindII, который всегда разрезает молекулы ДНК в определенной точке в пределах определенной последовательности из шести пар оснований. Они обнаружили, что фермент Hind II всегда разрезает прямо в центре этой последовательности (между 3-й и 4-й парами оснований).
Большинство нуклеаз классифицируются по номеру Комиссии по ферментам "Номенклатурного комитета Международного союза биохимии и молекулярной биологии " как гидролазы (номер ЕС 3). Нуклеазы относятся, как и фосфодиэстераза , липаза и фосфатаза, к эстеразам (номер ЕС 3.1), подгруппе гидролаз. Эстеразы, к которым принадлежат нуклеазы, классифицируются по номерам ЕС 3.1.11 - номер ЕС 3.1.31.
Первичная структура нуклеазы в целом плохо сохраняется и минимально сохраняется в активных участках, поверхности которых в основном состоят из кислых и основных аминокислотных остатков. Нуклеазы можно классифицировать по складчатым семействам. [5]
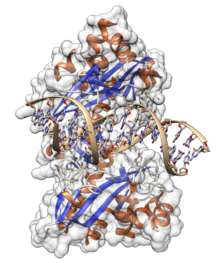
Нуклеаза должна ассоциироваться с нуклеиновой кислотой, прежде чем она сможет расщепить молекулу. Это влечет за собой определенную степень распознавания. Нуклеазы по-разному используют как неспецифические, так и специфические ассоциации в своих способах распознавания и связывания. Оба способа играют важную роль в живых организмах, особенно в репарации ДНК. [7]
Неспецифические эндонуклеазы, участвующие в репарации ДНК, могут сканировать ДНК на наличие целевых последовательностей или повреждений . Такая нуклеаза диффундирует вдоль ДНК до тех пор, пока не встретит цель, после чего остатки ее активного центра взаимодействуют с химическими группами ДНК. В случае эндонуклеаз, таких как EcoRV , BamHI и PvuII, это неспецифическое связывание включает электростатические взаимодействия между минимальной площадью поверхности белка и ДНК. Эта слабая ассоциация оставляет общую форму ДНК недеформированной, оставаясь в B-форме . [7]
АСайт-специфическая нуклеаза , напротив, формирует гораздо более сильные ассоциации. Она втягивает ДНК в глубокую бороздку своего домена связывания ДНК . Это приводит к значительной деформации третичной структуры ДНКи достигается с помощью поверхностей, богатых основными (положительно заряженными) остатками. Она участвует в обширном электростатическом взаимодействии с ДНК. [7]
Некоторые нуклеазы, участвующие в репарации ДНК, демонстрируют частичную специфичность последовательности. Однако большинство из них неспецифичны, вместо этого распознавая структурные аномалии, возникающие в остове ДНК из- за несовпадений пар оснований . [7]
Подробности см. в статье «Флэп-эндонуклеаза» .
С момента первоначального открытия Hind II из более чем 230 штаммов бактерий было выделено более 900 рестриктаз, некоторые из которых специфичны для последовательности, а некоторые нет. Эти рестриктазы обычно имеют названия, отражающие их происхождение — первая буква названия происходит от рода, а вторые две буквы — от вида прокариотической клетки, из которой они были выделены. Например, Eco RI происходит от бактерий Escherichia coli RY13, тогда как HindII происходит от штамма Haemophilus influenzae Rd. Числа после названий нуклеаз указывают порядок, в котором ферменты были выделены из отдельных штаммов бактерий: Eco RI , Eco RII .
Рестрикционная эндонуклеаза функционирует, «сканируя» длину молекулы ДНК. Как только она встречает свою конкретную специфическую последовательность распознавания, она связывается с молекулой ДНК и делает один разрез в каждом из двух сахарофосфатных остовов. Положение этих двух разрезов, как по отношению друг к другу, так и к самой последовательности распознавания, определяется идентичностью рестрикционной эндонуклеазы. Разные эндонуклеазы дают разные наборы разрезов, но одна эндонуклеаза всегда будет резать определенную последовательность оснований одинаково, независимо от того, на какую молекулу ДНК она действует. После того, как разрезы сделаны, молекула ДНК распадается на фрагменты.
Не все эндонуклеазы рестрикции режут симметрично и оставляют тупые концы, как описано выше в Hind II. Многие эндонуклеазы расщепляют остовы ДНК в положениях, которые не находятся прямо напротив друг друга, создавая свесы. Например, нуклеаза Eco RI имеет последовательность распознавания 5'—GAATTC—3'.
Когда фермент сталкивается с этой последовательностью, он расщепляет каждый остов между G и ближайшими остатками основания A. После того, как разрезы сделаны, полученные фрагменты удерживаются вместе только относительно слабыми водородными связями, которые удерживают комплементарные основания друг с другом. Слабость этих связей позволяет фрагментам ДНК отделяться друг от друга. Каждый полученный фрагмент имеет выступающий 5'-конец, состоящий из неспаренных оснований. Другие ферменты создают разрезы в остове ДНК, которые приводят к выступающим 3'-концам. Выступающие концы — как 3', так и 5' — иногда называют « липкими концами », потому что они имеют тенденцию связываться с комплементарными последовательностями оснований. Другими словами, если неспаренная длина оснований 5'—AATT—3'встречает другую неспаренную длину с последовательностью, с которой 3'—TTAA—5'они будут связываться друг с другом, они становятся «липкими» друг для друга. Затем фермент лигаза используется для соединения фосфатных остовов двух молекул. Клеточное или даже видовое происхождение липких концов не влияет на их липкость. Любая пара комплементарных последовательностей будет стремиться к связыванию, даже если одна из последовательностей происходит из отрезка человеческой ДНК, а другая — из отрезка бактериальной ДНК. Фактически, именно это качество липкости позволяет производить рекомбинантные молекулы ДНК, молекулы, которые состоят из ДНК из разных источников, и которое дало начало технологии генной инженерии .
Поскольку все клетки зависят от ДНК как носителя генетической информации, генетический контроль качества является важнейшей функцией всех организмов. Репликация ДНК — процесс, подверженный ошибкам, а сами молекулы ДНК уязвимы для модификации многими метаболическими и экологическими стрессорами. Повсеместные примеры включают активные формы кислорода , ближний ультрафиолет и ионизирующее излучение . Многие нуклеазы участвуют в восстановлении ДНК, распознавая места повреждений и отщепляя их от окружающей ДНК. Эти ферменты функционируют независимо или в комплексах . Большинство нуклеаз, участвующих в восстановлении ДНК, не являются специфичными для последовательности. Они распознают места повреждений посредством деформации вторичной структуры двухцепочечной ДНК (дцДНК). [5]
Во время репликации ДНК ДНК -полимеразы удлиняют новые цепи ДНК против комплементарных цепей матрицы. Большинство ДНК-полимераз включают два различных ферментативных домена : полимеразу и корректирующую экзонуклеазу . Полимераза удлиняет новую цепь в направлении 5' → 3'. Экзонуклеаза удаляет ошибочные нуклеотиды из той же цепи в направлении 3' → 5'. Эта экзонуклеазная активность необходима для способности ДНК-полимеразы корректировать. Делеции , инактивирующие или удаляющие эти нуклеазы, увеличивают скорость мутаций и смертности у пораженных микробов и рака у мышей. [8]
Многие формы повреждения ДНК останавливают прогрессирование репликативной вилки , заставляя ДНК-полимеразы и связанные с ними механизмы покидать вилку. Затем она должна быть обработана специфическими для вилки белками. Наиболее заметным является MUS81 . Делеции которого вызывают чувствительность к повреждениям УФ-излучением или метилированием у дрожжей , в дополнение к мейотическим дефектам. [5]
Повсеместной задачей в клетках является удаление праймеров фрагмента Оказаки РНК из репликации. Большинство таких праймеров вырезаются из вновь синтезированной отстающей цепи ДНК эндонуклеазами семейства РНКазы H. У эукариот и архей лоскутная эндонуклеаза FEN1 также участвует в обработке фрагментов Оказаки. [5]
Репарация несоответствий ДНК в любом организме осуществляется набором эндонуклеаз, специфичных для несоответствий. У прокариот эта роль в первую очередь выполняется MutSLH и связанными с ним белками репарации очень коротких заплат (VSP-репарация).
Система MutSLH (включающая MutS , MutL и MutH) исправляет точечные мутации и небольшие повороты . MutS распознает и связывается с несовпадениями, где он рекрутирует MutL и MutH. MutL опосредует взаимодействие между MutS и MutH и усиливает эндонуклеазную активность последнего. MutH распознает полуметилированные 5'—GATC—3'сайты и расщепляет рядом с Gнеметилированной цепью (более недавно синтезированной цепью).
Репарация VSP инициируется эндонуклеазой Vsr. Она исправляет специфическое T/Gнесоответствие, вызванное спонтанным дезаминированием метилированных цитозинов в тимины. Vsr распознает последовательность , где она разрезает цепь ДНК на 5'-стороне несоответствующего тимина (подчеркнутого в предыдущей последовательности). Затем одна из экзонуклеаз RecJ, ExoVII или ExoI разрушает сайт, прежде чем ДНК-полимераза ресинтезирует разрыв в цепи. [5]5'—CTWGG—3'
Образование AP-сайта является обычным явлением в dsDNA. Это результат спонтанного гидролиза и активности ДНК-гликозилаз как промежуточного шага в репарации удаления оснований . Эти AP-сайты удаляются AP-эндонуклеазами , которые вызывают одноцепочечные разрывы вокруг сайта. [5]
Нуклеотидная эксцизионная репарация , не путать с базисной эксцизионной репарацией, включает удаление и замену поврежденных нуклеотидов. Случаи сшивания , аддуктов и повреждений (генерируемых ультрафиолетовым светом или активными формами кислорода ) могут запустить этот путь репарации. Короткие отрезки одноцепочечной ДНК, содержащие такой поврежденный нуклеотид, удаляются из дуплексной ДНК отдельными эндонуклеазами, которые производят надрезы выше и ниже повреждения. Делеции или мутации, которые влияют на эти нуклеазы, вызывают повышенную чувствительность к ультрафиолетовому повреждению и канцерогенезу. Такие аномалии могут даже нарушать развитие нервной системы.
У бактерий оба разреза выполняются комплексом UvrB-UvrC . У почкующихся дрожжей комплекс Rad2 и комплекс Rad1-Rad10 выполняют разрезы 5' и 3' соответственно. У млекопитающих гомологи XPG и XPF - ERCC1 затрагивают те же самые соответствующие надрезы. [9]
Двухцепочечные разрывы , как преднамеренные, так и непреднамеренные, регулярно происходят в клетках. Непреднамеренные разрывы обычно возникают под действием ионизирующего излучения , различных экзогенных и эндогенных химических агентов и остановленных репликационных вилок. Преднамеренные разрывы возникают как посредники в мейозе и рекомбинации V(D)J , которые в первую очередь восстанавливаются посредством гомологичной рекомбинации и негомологичного соединения концов . В обоих случаях требуется, чтобы концы двухцепочечных разрывов были обработаны нуклеазами до того, как может произойти восстановление. Одной из таких нуклеаз является Mre11 в комплексе с Rad50 . Мутации Mre11 могут спровоцировать расстройство, подобное атаксии-телеангиэктазии . [9]
Рекомбинация V(D)J включает открытие структур стебель-петля , связанных с двухцепочечными разрывами, и последующее соединение обоих концов. Комплекс Artemis-DNAPK cs участвует в этой реакции. Хотя Artemis проявляет 5' → 3' ssDNA экзонуклеазную активность, когда он один, его комплексообразование с DNA-PK cs позволяет осуществлять эндонуклеазную обработку стебель-петля. Дефекты любого из белков вызывают тяжелый иммунодефицит. [9]
Гомологичная рекомбинация, с другой стороны, включает два гомологичных дуплекса ДНК, соединенных D-петлями или соединениями Холлидея . У бактерий эндонуклеазы, такие как RuvC, разделяют соединения Холлидея на две отдельные dsDNA, расщепляя соединения в двух симметричных участках вблизи центра соединения. У эукариот FEN1 , XPF - ERCC1 и MUS81 расщепляют D-петли, а Cce1 / Ydc2 обрабатывает соединения Холлидея в митохондриях. [9]
Частота, с которой конкретная нуклеаза будет резать данную молекулу ДНК, зависит от сложности ДНК и длины последовательности распознавания нуклеазы; из-за статистической вероятности случайного нахождения оснований в определенном порядке более длинная последовательность распознавания приведет к менее частому перевариванию. Например, заданная последовательность из четырех оснований (соответствующая участку распознавания для гипотетической нуклеазы) будет, как предсказано, встречаться каждые 256 пар оснований в среднем (где 4^4=256), но любая заданная последовательность из шести оснований, как ожидается, будет встречаться один раз на каждые 4096 пар оснований в среднем (4^6=4096).
Одно уникальное семейство нуклеаз — мегануклеазы , которые характеризуются более крупными и, следовательно, менее распространенными последовательностями распознавания, состоящими из 12–40 пар оснований. Эти нуклеазы особенно полезны для генной инженерии и генной инженерии сложных организмов, таких как растения и млекопитающие, где обычно более крупные геномы (числом в миллиарды пар оснований) приводят к частому и вредному сайт-специфическому расщеплению с использованием традиционных нуклеаз.