Озон ( / ˈ oʊ z oʊ n / ) (или трикислород ) — неорганическая молекула с химической формулой O
3. Это бледно-голубой газ с отчетливо резким запахом. Это аллотроп кислорода , который гораздо менее стабилен, чем двухатомный аллотроп O
2, распадающийся в нижних слоях атмосферы до O
2( дикислород ). Озон образуется из дикислорода под действием ультрафиолетового (УФ) света и электрических разрядов в атмосфере Земли . Он присутствует в очень низких концентрациях по всей атмосфере, причем его самая высокая концентрация находится в озоновом слое стратосферы , который поглощает большую часть ультрафиолетового (УФ) излучения Солнца .
Запах озона напоминает запах хлора , и многие люди могут его почувствовать даже при концентрации0,1 ppm в воздухе. Структура озона O 3 была определена в 1865 году. Позднее было доказано, что молекула имеет изогнутую структуру и является слабодиамагнитной . В стандартных условиях озон представляет собой бледно-голубой газ, который конденсируется при криогенных температурах в темно-синюю жидкость и, наконец, в фиолетово-черное твердое вещество . Нестабильность озона по отношению к более распространенному дикислороду такова, что как концентрированный газ, так и жидкий озон могут взрывообразно разлагаться при повышенных температурах, физическом ударе или быстром нагревании до точки кипения. [5] [6] Поэтому он используется в коммерческих целях только в низких концентрациях.
Озон является мощным окислителем (гораздо более сильным, чем дикислород) и имеет множество промышленных и потребительских применений, связанных с окислением. Однако этот же самый высокий окислительный потенциал приводит к тому, что озон повреждает слизистые и дыхательные ткани животных, а также ткани растений, при концентрациях выше примерно0,1 ppm . Хотя это делает озон потенциально опасным для органов дыхания и загрязняющим веществом вблизи поверхности земли , более высокая концентрация в озоновом слое (от двух до восьми ppm) полезна, предотвращая попадание вредоносного ультрафиолетового излучения на поверхность Земли.
Тривиальное название озон является наиболее часто используемым и предпочтительным названием ИЮПАК . Систематические названия 2λ 4 -триоксидиен [ сомнительный – обсудить ] и катена-триоксиген , действительные названия ИЮПАК , построены в соответствии с заместительной и аддитивной номенклатурами соответственно. Название озон происходит от озеин (ὄζειν), греческого среднего рода настоящего причастия для запаха, [7] ссылаясь на характерный запах озона.
В соответствующих контекстах озон можно рассматривать как триоксидан с двумя удаленными атомами водорода, и как таковой, триоксиданилиден может использоваться как систематическое название, согласно заместительной номенклатуре. По умолчанию эти названия не учитывают радикальность молекулы озона. В еще более конкретном контексте это также может называть нерадикальное синглетное основное состояние, тогда как бирадикальное состояние называется триоксидандиил .
Триоксидандиил (или озонид ) используется несистематически для обозначения группы заместителя (-OOO-). Следует проявлять осторожность, чтобы не путать название группы с контекстно-специфическим названием озона, данным выше.

.jpg/440px-Smyths_revised_ozonometer,_1865._(9660571191).jpg)
В 1785 году голландский химик Мартинус ван Марум проводил эксперименты с электрическими искрами над водой, когда он заметил необычный запах, который он приписал электрическим реакциям, не понимая, что на самом деле он создал озон. [8] [9]
Полвека спустя Кристиан Фридрих Шёнбейн заметил тот же резкий запах и узнал в нем запах, часто следующий за ударом молнии . В 1839 году ему удалось выделить газообразное химическое вещество и назвать его «озоном», от греческого слова ozein ( ὄζειν ), означающего «пахнуть». [10] [11] По этой причине Шёнбейну обычно приписывают открытие озона. [12] [13] [14] [8] Он также отметил сходство запаха озона с запахом фосфора, а в 1844 году доказал, что продукт реакции белого фосфора с воздухом идентичен. [10] Последующую попытку назвать озон «электрифицированным кислородом» он высмеял, предложив называть озон из белого фосфора «фосфорированным кислородом». [10] Формула озона, O 3 , была определена только в 1865 году Жаком-Луи Соре [15] и подтверждена Шёнбейном в 1867 году. [10] [16]
На протяжении большей части второй половины 19-го века и вплоть до 20-го века озон считался здоровым компонентом окружающей среды натуралистами и сторонниками здорового образа жизни. Официальным лозунгом Бомонта, Калифорния , было «Бомонт: Зона озона», о чем свидетельствуют открытки и бланки Торговой палаты. [17] Натуралисты, работающие на открытом воздухе, часто считали возвышенности полезными из-за содержания в них озона. «На возвышенностях совершенно другая атмосфера с достаточным количеством озона для поддержания необходимой энергии [для работы]», — писал натуралист Генри Хеншоу , работающий на Гавайях. [18] Приморский воздух считался здоровым из-за предполагаемого содержания в нем озона. Запах, породивший это убеждение, на самом деле является запахом галогенированных метаболитов морских водорослей [19] и диметилсульфида . [20]
Большая часть привлекательности озона, по-видимому, была обусловлена его «свежим» запахом, который вызывал ассоциации с очищающими свойствами. Ученые отметили его вредное воздействие. В 1873 году Джеймс Дьюар и Джон Грей Маккендрик задокументировали, что лягушки становились вялыми, птицы задыхались, а в крови кроликов наблюдалось снижение уровня кислорода после воздействия «озонированного воздуха», который «оказывал разрушительное действие». [21] [12] Сам Шёнбейн сообщал, что вдыхание озона приводило к болям в груди, раздражению слизистых оболочек и затрудненному дыханию, а мелкие млекопитающие погибали. [22] В 1911 году Леонард Хилл и Мартин Флэк заявили в Трудах Королевского общества B, что целебные эффекты озона «стали, благодаря простому повторению, неотъемлемой частью общепринятого мнения; и все же точные физиологические доказательства в пользу его полезных эффектов до сих пор почти полностью отсутствовали... Единственное полностью достоверное знание относительно физиологического эффекта озона, достигнутое до сих пор, заключается в том, что он вызывает раздражение и отек легких, а также смерть при вдыхании в относительно высокой концентрации в течение любого времени». [12] [23]
Во время Первой мировой войны озон испытывался в военном госпитале королевы Александры в Лондоне как возможное дезинфицирующее средство для ран. Газ наносился непосредственно на раны в течение 15 минут. Это приводило к повреждению как бактериальных клеток, так и тканей человека. Другие методы дезинфекции, такие как орошение антисептиками , были признаны предпочтительными. [12] [24]
До 1920-х годов не было уверенности в том, что небольшие количества оксозона , O
4, также присутствовали в образцах озона из-за сложности применения методов аналитической химии к взрывоопасным концентрированным химикатам. [25] [26] В 1923 году Георг-Мария Шваб (работавший над докторской диссертацией под руководством Эрнста Германа Ризенфельда ) был первым, кто успешно затвердел озоном и выполнил точный анализ, который окончательно опроверг гипотезу оксозона. [25] [26] Дальнейшие до сих пор неизмеренные физические свойства чистого концентрированного озона были определены группой Ризенфельда в 1920-х годах. [25]

Озон — бесцветный или бледно-голубой газ, слабо растворимый в воде и гораздо более растворимый в инертных неполярных растворителях, таких как четыреххлористый углерод или фторуглероды, в которых он образует синий раствор. При температуре 161 К (−112 °C; −170 °F) он конденсируется, образуя темно-синюю жидкость . Опасно доводить эту жидкость до температуры кипения, поскольку как концентрированный газообразный озон, так и жидкий озон могут взорваться. При температуре ниже 80 К (−193,2 °C; −315,7 °F) он образует фиолетово-черное твердое вещество . [27]
Большинство людей могут обнаружить около 0,01 мкмоль/моль озона в воздухе, где он имеет очень специфический резкий запах, несколько напоминающий хлорный отбеливатель . Воздействие от 0,1 до 1 мкмоль/моль вызывает головные боли, жжение в глазах и раздражение дыхательных путей. [28] Даже низкие концентрации озона в воздухе очень разрушительны для органических материалов, таких как латекс, пластик и легочная ткань животных.
Молекула озона диамагнитна. [29]
Согласно экспериментальным данным микроволновой спектроскопии , озон представляет собой изогнутую молекулу с симметрией C 2v (аналогично молекуле воды ). [30] Расстояния O–O составляют 127,2 пм (1,272 Å ). Угол O–O–O составляет 116,78°. [31] Центральный атом гибридизован sp ² с одной неподеленной парой. Озон представляет собой полярную молекулу с дипольным моментом 0,53 D. [32] Молекула может быть представлена как резонансный гибрид с двумя участвующими структурами, каждая с одинарной связью с одной стороны и двойной связью с другой. Расположение имеет общий порядок связи 1,5 для обеих сторон. Он изоэлектронен с анионом нитрита . Встречающийся в природе озон может состоять из замещенных изотопов ( 16 O, 17 O, 18 O). Циклическая форма была предсказана, но не наблюдалась .

Озон является одним из самых мощных известных окислителей , гораздо сильнее O 2 . Он также нестабилен при высоких концентрациях, распадаясь на обычный двухатомный кислород. Его период полураспада зависит от атмосферных условий, таких как температура, влажность и движение воздуха. В лабораторных условиях период полураспада в среднем составит ~1500 минут (25 часов) в неподвижном воздухе при комнатной температуре (24 °C), нулевой влажности и нулевом воздухообмене в час. [33]
Эта реакция протекает быстрее с повышением температуры. Дефлаграция озона может быть вызвана искрой и может происходить при концентрации озона 10 % по весу или выше. [34]
Озон также может быть получен из кислорода на аноде электрохимической ячейки. Эта реакция может создавать меньшие количества озона для исследовательских целей. [35]
Это можно наблюдать как нежелательную реакцию в газовом аппарате Гофмана во время электролиза воды, когда напряжение устанавливается выше необходимого.
Озон окисляет большинство металлов (кроме золота , платины и иридия ) до оксидов металлов в их наивысшей степени окисления . Например:
Озон также окисляет оксид азота до диоксида азота :
Эта реакция сопровождается хемилюминесценцией . NO 2 может далее окисляться до нитратного радикала :
Образовавшийся NO 3 может реагировать с NO 2 с образованием пентаоксида диазота ( N 2 O 5 ).
Твердый перхлорат нитрония можно получить из газов NO 2 , ClO 2 и O 3 :
Озон не реагирует с солями аммония , но окисляет аммиак до нитрата аммония :
Озон реагирует с углеродом , образуя углекислый газ , даже при комнатной температуре:
Озон окисляет сульфиды до сульфатов . Например, сульфид свинца(II) окисляется до сульфата свинца(II) :
Серную кислоту можно получить из озона, воды и элементарной серы или диоксида серы :
В газовой фазе озон реагирует с сероводородом с образованием диоксида серы:
Однако в водном растворе одновременно протекают две конкурирующие реакции: одна с образованием элементарной серы, а другая с образованием серной кислоты :
Алкены могут подвергаться окислительному расщеплению озоном в процессе, называемом озонолизом , с образованием спиртов, альдегидов, кетонов и карбоновых кислот, в зависимости от второго этапа обработки.
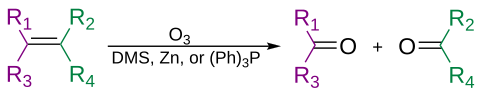
Озон также может расщеплять алкины с образованием ангидрида кислоты или дикетона . [37] Если реакция проводится в присутствии воды, ангидрид гидролизуется с образованием двух карбоновых кислот .
Обычно озонолиз проводят в растворе дихлорметана при температуре −78 °C. После последовательности расщеплений и перегруппировок образуется органический озонид. При восстановительной обработке (например, цинком в уксусной кислоте или диметилсульфиде ) образуются кетоны и альдегиды, при окислительной обработке (например, водной или спиртовой перекисью водорода ) образуются карбоновые кислоты. [38]
Все три атома озона также могут реагировать, как в реакции хлорида олова(II) с соляной кислотой и озоном:
Перхлорат йода можно получить путем обработки йода, растворенного в холодной безводной хлорной кислоте, озоном:
Озон также может реагировать с йодидом калия, образуя кислород и газообразный йод, которые можно титровать для количественного определения: [39]
Озон может быть использован для реакций горения и горючих газов; озон обеспечивает более высокие температуры, чем горение в дикислороде ( O 2 ). Ниже приведена реакция горения субнитрида углерода , которая также может вызывать более высокие температуры:
Озон может реагировать при криогенных температурах. При 77 К (−196,2 °C; −321,1 °F) атомарный водород реагирует с жидким озоном, образуя радикал супероксида водорода , который димеризуется : [40]
Озон является токсичным веществом, [41] [42] часто встречающимся или образующимся в среде обитания человека (салоны самолетов, офисы с копировальными аппаратами, лазерными принтерами, стерилизаторами...), и его каталитическое разложение очень важно для снижения загрязнения. Этот тип разложения является наиболее широко используемым, особенно с твердыми катализаторами, и имеет много преимуществ, таких как более высокая конверсия при более низкой температуре. Кроме того, продукт и катализатор могут быть мгновенно разделены, и таким образом катализатор может быть легко восстановлен без использования какой-либо операции разделения. Более того, наиболее используемыми материалами при каталитическом разложении озона в газовой фазе являются благородные металлы, такие как Pt, Rh или Pd, и переходные металлы, такие как Mn, Co, Cu, Fe, Ni или Ag.
Существуют еще две возможности разложения озона в газовой фазе:
Первый — это термическое разложение, при котором озон может быть разложен только под действием тепла. Проблема в том, что этот тип разложения очень медленный при температурах ниже 250 °C. Однако скорость разложения может быть увеличена при работе с более высокими температурами, но это потребует больших затрат энергии.
Второй — фотохимическое разложение, которое заключается в облучении озона ультрафиолетовым излучением (УФ), в результате чего образуется кислород и радикальный пероксид. [43]
Процесс разложения озона представляет собой сложную реакцию, включающую две элементарные реакции, которые в конечном итоге приводят к образованию молекулярного кислорода, а это означает, что порядок реакции и закон скорости не могут быть определены стехиометрией подобранного уравнения.
Общая реакция:
Закон ставки (соблюдается):
Было установлено, что разложение озона подчиняется кинетике первого порядка, и из приведенного выше закона скорости можно определить, что частичный порядок по отношению к молекулярному кислороду равен -1, а по отношению к озону равен 2, поэтому глобальный порядок реакции равен 1.
Разложение озона состоит из двух элементарных стадий: Первая соответствует мономолекулярной реакции, поскольку одна единственная молекула озона распадается на два продукта (молекулярный кислород и кислород). Затем кислород из первой стадии является промежуточным продуктом, поскольку он участвует в качестве реагента во второй стадии, которая является бимолекулярной реакцией, поскольку существуют два различных реагента (озон и кислород), которые дают один продукт, соответствующий молекулярному кислороду в газовой фазе.
Шаг 1: Мономолекулярная реакция
Шаг 2: Бимолекулярная реакция
Эти два шага имеют разные скорости реакции, первый из них обратим и быстрее, чем вторая реакция, которая медленнее, поэтому это означает, что определяющим шагом является вторая реакция, и это используется для определения наблюдаемой скорости реакции. Законы скорости реакции для каждого шага следующие:
Следующий механизм позволяет объяснить закон скорости разложения озона, наблюдаемый экспериментально, а также позволяет определить порядки реакции по озону и кислороду, с помощью которых будет определяться общий порядок реакции. Более медленная стадия, бимолекулярная реакция, является той, которая определяет скорость образования продукта, и, учитывая, что эта стадия приводит к образованию двух молекул кислорода, закон скорости имеет следующий вид:
Однако это уравнение зависит от концентрации кислорода (промежуточного продукта), которую можно определить, учитывая первый шаг. Поскольку первый шаг более быстрый и обратимый, а второй шаг более медленный, реагенты и продукты первого шага находятся в равновесии, поэтому концентрацию промежуточного продукта можно определить следующим образом:
Тогда, используя эти уравнения, скорость образования молекулярного кислорода будет такой, как показано ниже:
Наконец, представленный механизм позволяет установить скорость, наблюдаемую экспериментально, с константой скорости ( K obs ) и соответствующую кинетике первого порядка, следующим образом: [44]
где
Восстановление озона дает анион озонида , O−3. Производные этого аниона взрывоопасны и должны храниться при криогенных температурах. Известны озониды всех щелочных металлов . KO 3 , RbO 3 и CsO 3 могут быть получены из их соответствующих супероксидов:
Хотя KO3 может быть образован, как указано выше, он также может быть образован из гидроксида калия и озона: [45]
NaO 3 и LiO 3 должны быть получены действием CsO 3 в жидком NH 3 на ионообменную смолу, содержащую ионы Na + или Li + : [46]
Раствор кальция в аммиаке реагирует с озоном, образуя озонид аммония , а не озонид кальция: [40]
Озон можно использовать для удаления железа и марганца из воды , образуя осадок , который можно отфильтровать:
Озон также окисляет растворенный в воде сероводород до сернистой кислоты :
Эти три реакции играют центральную роль в использовании озонирования для очистки скважинной воды.
Озон также обезвреживает цианиды , преобразуя их в цианаты .
Озон также полностью разложит мочевину : [47]
Озон представляет собой изогнутую трехатомную молекулу с тремя колебательными модами: симметричное растяжение (1103,157 см −1 ), изгиб (701,42 см −1 ) и антисимметричное растяжение (1042,096 см −1 ). [48] Симметричное растяжение и изгиб являются слабыми поглотителями, но антисимметричное растяжение является сильным и отвечает за то, что озон является важным второстепенным парниковым газом . Этот ИК-диапазон также используется для обнаружения окружающего и атмосферного озона, хотя измерения на основе УФ-излучения более распространены. [49]
Электромагнитный спектр озона довольно сложен. Обзор можно увидеть в MPI Mainz UV/VIS Spectral Atlas of Gaseous Molecules of Atmospheric Interest. [50]
Все полосы являются диссоциативными, что означает, что молекула распадается на O + O 2 после поглощения фотона. Наиболее важным поглощением является полоса Хартли, простирающаяся от чуть выше 300 нм до чуть выше 200 нм. Именно эта полоса отвечает за поглощение УФ-С в стратосфере.
На стороне высоких длин волн полоса Хартли переходит в так называемую полосу Хаггинса, которая быстро спадает, пока не исчезает на ~360 нм. Выше 400 нм, простираясь далеко в ближний ИК, находятся полосы Чаппиуса и Вульфа. Там неструктурированные полосы поглощения полезны для обнаружения высоких концентраций озона в окружающей среде, но они настолько слабы, что не имеют большого практического эффекта.
В дальнем УФ-диапазоне имеются дополнительные полосы поглощения, которые медленно увеличиваются от 200 нм и достигают максимума при ~120 нм.
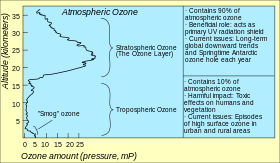


Стандартный способ выражения общего уровня озона (количества озона в данном вертикальном столбце) в атмосфере — использование единиц Добсона . Точечные измерения представляются в виде мольных долей в нмоль/моль (частей на миллиард, ppb) или в виде концентраций в мкг/м 3 . Изучение концентрации озона в атмосфере началось в 1920-х годах. [51]
Самые высокие уровни озона в атмосфере находятся в стратосфере , в области, также известной как озоновый слой, между примерно 10 и 50 км над поверхностью (или между примерно 6 и 31 милей). Однако даже в этом «слое» концентрация озона составляет всего от двух до восьми частей на миллион, поэтому большая часть кислорода там — это дикислород, O 2 , с объёмной концентрацией около 210 000 частей на миллион. [52]
Озон в стратосфере в основном образуется из коротковолновых ультрафиолетовых лучей между 240 и 160 нм. Кислород начинает слабо поглощать при 240 нм в полосах Герцберга, но большая часть кислорода диссоциирует путем поглощения в сильных полосах Шумана-Рунге между 200 и 160 нм, где озон не поглощает. В то время как более коротковолновый свет, простирающийся даже до предела рентгеновского излучения, достаточно энергичен, чтобы диссоциировать молекулярный кислород, его относительно мало, и сильное солнечное излучение при Лайман-альфа, 121 нм, приходится на точку, где поглощение молекулярного кислорода минимально. [53]
Процесс создания и разрушения озона называется циклом Чепмена и начинается с фотолиза молекулярного кислорода.
затем следует реакция атома кислорода с другой молекулой кислорода с образованием озона.
где "M" обозначает третье тело, которое уносит избыточную энергию реакции. Молекула озона может затем поглотить фотон УФ-С и диссоциировать
Избыточная кинетическая энергия нагревает стратосферу, когда атомы O и молекулярный кислород разлетаются и сталкиваются с другими молекулами. Это преобразование ультрафиолетового света в кинетическую энергию нагревает стратосферу. Атомы кислорода, полученные при фотолизе озона, затем реагируют с другой молекулой кислорода, как на предыдущем этапе, образуя больше озона. В чистой атмосфере, содержащей только азот и кислород, озон может реагировать с атомарным кислородом, образуя две молекулы O 2 :
Оценку скорости этого этапа прекращения цикла атомарного кислорода обратно в озон можно получить, просто взяв отношения концентраций O 2 к O 3 . Реакция прекращения катализируется присутствием определенных свободных радикалов, из которых наиболее важными являются гидроксил (OH), оксид азота (NO) и атомарный хлор (Cl) и бром (Br). Во второй половине 20-го века было обнаружено, что количество озона в стратосфере снижается, в основном из-за увеличения концентрации хлорфторуглеродов (CFC) и подобных хлорированных и бромированных органических молекул . Озабоченность по поводу последствий для здоровья от этого снижения привела к Монреальскому протоколу 1987 года , запрету на производство многих озоноразрушающих химикатов и началу восстановления концентраций стратосферного озона в первом и втором десятилетии 21-го века.

Озон в озоновом слое отфильтровывает солнечные лучи длиной волны от около 200 нм до 315 нм, с пиком поглощения озона около 250 нм. [54] Это поглощение УФ-излучения озоном важно для жизни, поскольку оно расширяет поглощение УФ-излучения обычным кислородом и азотом в воздухе (которые поглощают все длины волн < 200 нм) через нижний УФ-С (200–280 нм) и весь диапазон УФ-В (280–315 нм). Небольшая непоглощенная часть, которая остается от УФ-В после прохождения через озон, вызывает солнечные ожоги у людей и прямое повреждение ДНК в живых тканях как у растений, так и у животных. Влияние озона на лучи УФ-В среднего диапазона иллюстрируется его влиянием на УФ-В при 290 нм, интенсивность излучения которого в верхних слоях атмосферы в 350 миллионов раз выше, чем на поверхности. Тем не менее, достаточное количество УФ-В-излучения на аналогичной частоте достигает земли, чтобы вызвать солнечные ожоги, и эти же длины волн также отвечают за выработку витамина D в организме человека.
Озоновый слой мало влияет на более длинные волны ультрафиолета, называемые УФ-А (315–400 нм), но это излучение не вызывает солнечных ожогов или прямого повреждения ДНК. Хотя УФ-А, вероятно, вызывает долгосрочное повреждение кожи у некоторых людей, оно не так опасно для растений и для здоровья организмов, обитающих на поверхности Земли в целом (см. ультрафиолет для получения дополнительной информации о ближнем ультрафиолете).
Низкоуровневый озон (или тропосферный озон) является загрязнителем атмосферы. [55] Он не выбрасывается напрямую двигателями автомобилей или промышленными предприятиями, а образуется в результате реакции солнечного света с воздухом, содержащим углеводороды и оксиды азота , которые реагируют с образованием озона непосредственно в источнике загрязнения или на расстоянии многих километров по ветру.
Озон напрямую реагирует с некоторыми углеводородами, такими как альдегиды , и таким образом начинает их удаление из воздуха, но продукты сами по себе являются ключевыми компонентами смога . Фотолиз озона под действием ультрафиолетового света приводит к образованию гидроксильного радикала HO•, и это играет роль в удалении углеводородов из воздуха, но также является первым шагом в создании компонентов смога, таких как пероксиацилнитраты , которые могут быть сильными раздражителями глаз. Атмосферное время жизни тропосферного озона составляет около 22 дней; его основные механизмы удаления - осаждение на землю, вышеупомянутая реакция дает HO•, и реакции с OH и пероксидным радикалом HO 2 •. [56]
Имеются данные о значительном снижении урожайности сельскохозяйственных культур из-за увеличения приземного озона и загрязнения, которое препятствует фотосинтезу и замедляет общий рост некоторых видов растений. [57] [58] Агентство по охране окружающей среды США ( EPA ) предложило вторичный регламент для снижения ущерба урожаю в дополнение к первичному регламенту, разработанному для защиты здоровья человека.
Некоторые примеры городов с повышенными показателями озона: Денвер, Колорадо ; Хьюстон, Техас ; и Мехико , Мексика . В Хьюстоне показатель составляет около 41 нмоль/моль, в то время как Мехико гораздо более опасен, с показателем около 125 нмоль/моль. [58]
Низкий уровень озона, или тропосферный озон, является наиболее тревожным типом загрязнения озоном в городских районах и в целом увеличивается. [59] Загрязнение озоном в городских районах влияет на более плотное население и усугубляется большим количеством транспортных средств, которые выбрасывают загрязняющие вещества NO2 и ЛОС , основные факторы, способствующие проблемным уровням озона. [60] Загрязнение озоном в городских районах особенно тревожно в связи с повышением температуры, увеличивая смертность, связанную с жарой во время волн тепла . [61] Во время волн тепла в городских районах загрязнение приземного озона может быть на 20% выше обычного. [62] Загрязнение озоном в городских районах достигает более высоких уровней превышения летом и осенью, что может быть объяснено погодными условиями и схемами движения. [60] Люди, живущие в нищете, в целом больше страдают от загрязнения, хотя эти группы населения с меньшей вероятностью способствуют уровням загрязнения. [63]
Как упоминалось выше, Денвер, штат Колорадо, является одним из многих городов в США с высоким содержанием озона. По данным Американской ассоциации легких , район Денвер-Аврора является 14-м по уровню загрязнения озоном районом в США [64] . Проблема высокого уровня озона не нова для этого района. В 2004 году Агентство по охране окружающей среды выделило Денверский метрополитен / Северный фронтальный хребет [b] в качестве территорий, не соответствующих 8-часовому стандарту озона 1997 года [65] , но позже отложило этот статус до 2007 года. Стандарт несоответствия указывает на то, что район не соответствует стандартам качества воздуха Агентства по охране окружающей среды. В ответ был создан План действий по озону в Колорадо, и в этот план были внесены многочисленные изменения. Первым крупным изменением стало расширение тестирования выбросов автомобилей по всему штату на большее количество округов, в которых ранее не было обязательных испытаний выбросов, например, округа Лаример и округ Велд. Также были внесены изменения с целью сокращения выбросов оксидов азота (NOx) и летучих органических соединений (ЛОС), что должно способствовать снижению уровня озона.
Одним из крупных факторов, способствующих повышению уровня озона в этом районе, является нефтегазовая промышленность , расположенная в бассейне Денвер-Джулесбург (DJB), который совпадает с большинством столичных районов Колорадо. Озон естественным образом образуется в стратосфере Земли, но также создается в тропосфере в результате деятельности человека. Кратко упомянуто выше, NOx и ЛОС реагируют с солнечным светом, создавая озон посредством процесса, называемого фотохимией. События повышения уровня озона на один час (<75 ppb) «происходят в период с июня по август, что указывает на то, что повышение уровня озона обусловлено региональной фотохимией». [66] Согласно статье из Университета Колорадо в Боулдере, «выбросы ЛОС от нефти и природного газа играют важную роль в образовании озона и потенциально могут способствовать повышению уровня O 3 в Северном Колорадском фронтальном хребте (NCFR)». [66] Используя комплексный анализ для исследования ветровых схем и выбросов от крупных нефтяных и газовых операций, авторы пришли к выводу, что «повышенные уровни O 3 в NCFR в основном коррелируют с воздушным транспортом с севера на восток-юго-восток, которые являются наветренными секторами, где расположены нефтегазовые операции в районе месторождения Ваттенберг в DJB». [66]
В Плане действий по озону Колорадо, созданном в 2008 году, содержатся планы по оценке «контроля выбросов для крупных промышленных источников NOx» и «требований к контролю на уровне штата для новых резервуаров для нефтяного и газового конденсата и пневматических клапанов». [67] В 2011 году был выпущен Региональный план по дымке, который включал более конкретный план по снижению выбросов NOx. Эти усилия становится все труднее реализовать, и на их реализацию уходит много лет. Конечно, есть и другие причины, по которым уровень озона остается высоким. К ним относятся: рост населения, означающий увеличение выбросов автомобилей, и горы вдоль NCFR, которые могут улавливать выбросы. Если интересно, ежедневные показатели качества воздуха можно найти на веб-сайте Департамента общественного здравоохранения и окружающей среды Колорадо. [68] Как отмечалось ранее, Денвер по сей день продолжает испытывать высокий уровень озона. Потребуются многие годы и системный подход для борьбы с этой проблемой высокого уровня озона в Передовом хребте Колорадо.

Озоновый газ воздействует на любой полимер, содержащий олефиновые или двойные связи в своей цепной структуре, например, на натуральный каучук , нитрильный каучук и стирол-бутадиеновый каучук. Изделия, изготовленные с использованием этих полимеров, особенно подвержены воздействию, что приводит к тому, что трещины со временем становятся длиннее и глубже, скорость роста трещин зависит от нагрузки, переносимой резиновым компонентом, и концентрации озона в атмосфере. Такие материалы можно защитить, добавив антиозонанты , такие как воски, которые связываются с поверхностью, создавая защитную пленку, или смешиваются с материалом и обеспечивают долгосрочную защиту. Растрескивание под действием озона раньше было серьезной проблемой в автомобильных шинах, [69] например, но это не проблема для современных шин. С другой стороны, многие критически важные изделия, такие как прокладки и уплотнительные кольца , могут подвергаться воздействию озона, образующегося в системах сжатого воздуха. Топливные магистрали, изготовленные из армированной резины, также подвержены воздействию, особенно в моторном отсеке, где некоторое количество озона вырабатывается электрическими компонентами. Хранение резиновых изделий в непосредственной близости от электродвигателя постоянного тока может ускорить растрескивание озона. Коллектор двигателя генерирует искры, которые в свою очередь производят озон.

Хотя озон присутствовал на уровне земли до промышленной революции , пиковые концентрации сейчас намного выше, чем доиндустриальные уровни, и даже фоновые концентрации вдали от источников загрязнения существенно выше. [71] [72] Озон действует как парниковый газ , поглощая часть инфракрасной энергии, испускаемой Землей. Количественная оценка парникового потенциала озона затруднена, поскольку он не присутствует в равномерных концентрациях по всему земному шару. Однако наиболее широко принятые научные оценки, касающиеся изменения климата (например , Третий оценочный доклад Межправительственной группы экспертов по изменению климата ) [73] предполагают, что радиационное воздействие тропосферного озона составляет около 25% от воздействия углекислого газа .
Годовой потенциал глобального потепления тропосферного озона составляет от 918 до 1022 тонн эквивалента углекислого газа /тонну тропосферного озона. Это означает, что на основе молекулы озон в тропосфере имеет радиационный вынуждающий эффект примерно в 1000 раз сильнее, чем углекислый газ . Однако тропосферный озон является короткоживущим парниковым газом, который распадается в атмосфере гораздо быстрее, чем углекислый газ . Это означает, что за 20-летний период потенциал глобального потепления тропосферного озона намного меньше, примерно от 62 до 69 тонн эквивалента углекислого газа /тонну тропосферного озона. [74]
Из-за своей недолговечной природы тропосферный озон не имеет сильных глобальных эффектов, но имеет очень сильные радиационные воздействия в региональных масштабах. Фактически, есть регионы мира, где тропосферный озон имеет радиационное воздействие до 150% углекислого газа . [75] Например, показано, что увеличение озона в тропосфере ответственно за ~30% потепления верхней части Южного океана между 1955 и 2000 годами. [76]
За последние несколько десятилетий ученые изучали влияние острого и хронического воздействия озона на здоровье человека. Сотни исследований показывают, что озон вреден для людей в уровнях, которые в настоящее время наблюдаются в городских районах. [77] [78] Было показано, что озон влияет на дыхательную, сердечно-сосудистую и центральную нервную систему. Также показано, что ранняя смерть и проблемы репродуктивного здоровья и развития связаны с воздействием озона. [79]
Американская ассоциация пульмонологов определила пять групп населения, которые особенно уязвимы к воздействию вдыхания озона: [80]
Дополнительные данные свидетельствуют о том, что женщины, люди с ожирением и малообеспеченные слои населения также могут подвергаться более высокому риску воздействия озона, хотя необходимы дополнительные исследования. [80]
Острое воздействие озона длится от нескольких часов до нескольких дней. Поскольку озон — это газ, он напрямую влияет на легкие и всю дыхательную систему. Вдыхаемый озон вызывает воспаление и острые, но обратимые, изменения функции легких, а также гиперреактивность дыхательных путей. [81] Эти изменения приводят к одышке, хрипам и кашлю, которые могут усугубить заболевания легких, такие как астма или хроническая обструктивная болезнь легких (ХОБЛ), что приводит к необходимости получения медицинской помощи. [82] [83] Было показано, что острое и хроническое воздействие озона вызывает повышенный риск респираторных инфекций из-за следующего механизма. [84]
Было проведено множество исследований для определения механизма вредного воздействия озона, особенно на легкие. Эти исследования показали, что воздействие озона вызывает изменения в иммунном ответе в легочной ткани, что приводит к нарушению как врожденного, так и адаптивного иммунного ответа, а также изменению защитной функции эпителиальных клеток легких. [85] Считается, что эти изменения в иммунном ответе и связанная с ним воспалительная реакция являются факторами, которые, вероятно, способствуют повышению риска легочных инфекций, а также ухудшению или возникновению астмы и реактивных дыхательных путей после воздействия загрязнения озоном на уровне земли. [85] [86]
Врожденная (клеточная) иммунная система состоит из различных химических сигналов и типов клеток, которые работают широко и против множества типов патогенов, как правило, бактерий или инородных тел/веществ в организме хозяина. [86] [87] Клетки врожденной системы включают фагоциты, нейтрофилы, [87] и, как полагают, вносят вклад в механизм озоновой патологии в легких, поскольку было показано, что функционирование этих типов клеток изменяется после воздействия озона. [86] Было показано , что макрофаги, клетки, которые служат для устранения патогенов или инородного материала посредством процесса «фагоцитоза», [87] изменяют уровень воспалительных сигналов, которые они высвобождают в ответ на озон, либо повышая регуляцию и приводя к воспалительной реакции в легких, либо понижая регуляцию и снижая иммунную защиту. [85] Нейтрофилы, еще один важный тип клеток врожденной иммунной системы, который в первую очередь нацелен на бактериальные патогены, [87] присутствуют в дыхательных путях в течение 6 часов после воздействия высоких уровней озона. Однако, несмотря на высокие уровни в тканях легких, их способность очищать от бактерий, по-видимому, снижается под воздействием озона. [85]
Адаптивная иммунная система — это ветвь иммунитета, которая обеспечивает долгосрочную защиту посредством выработки антител, нацеленных на определенные патогены, и на которую также влияет сильное воздействие озона. [86] [87] Лимфоциты, клеточный компонент адаптивного иммунного ответа, вырабатывают повышенное количество воспалительных химических веществ, называемых «цитокинами», после воздействия озона, что может способствовать гиперреактивности дыхательных путей и ухудшению симптомов астмы. [85]
Эпителиальные клетки дыхательных путей также играют важную роль в защите людей от патогенов. В нормальной ткани эпителиальный слой образует защитный барьер, а также содержит специализированные реснитчатые структуры, которые работают над очисткой легких от инородных тел, слизи и патогенов. При воздействии озона реснички повреждаются, а мукоцилиарный клиренс патогенов снижается. Кроме того, эпителиальный барьер ослабевает, что позволяет патогенам пересекать барьер, размножаться и распространяться в более глубокие ткани. В совокупности эти изменения в эпителиальном барьере помогают сделать людей более восприимчивыми к легочным инфекциям. [85]
Вдыхание озона влияет не только на иммунную систему и легкие, но также может повлиять на сердце. Озон вызывает кратковременный вегетативный дисбаланс, что приводит к изменению частоты сердечных сокращений и снижению вариабельности сердечного ритма; [88] а воздействие высоких уровней в течение всего лишь одного часа приводит к наджелудочковой аритмии у пожилых людей, [89] оба увеличивают риск преждевременной смерти и инсульта. Озон также может приводить к вазоконстрикции, что приводит к повышению системного артериального давления, что способствует повышению риска сердечной заболеваемости и смертности у пациентов с уже существующими сердечными заболеваниями. [90] [91]
Вдыхание озона в течение более восьми часов подряд в течение недель, месяцев или лет определяет хроническое воздействие. Многочисленные исследования указывают на серьезное воздействие на здоровье различных групп населения в результате такого воздействия.
В одном исследовании обнаружены значительные положительные ассоциации между хроническим озоном и смертностью от всех причин, сердечно-сосудистой и респираторной смертностью с 2%, 3% и 12% увеличением риска на 10 ppb [92] и сообщается о связи (95% ДИ) ежегодного озона и смертности от всех причин с отношением рисков 1,02 (1,01–1,04) и со смертностью от сердечно-сосудистых заболеваний 1,03 (1,01–1,05). Аналогичное исследование обнаруживает аналогичные ассоциации со смертностью от всех причин и даже более значительные эффекты для смертности от сердечно-сосудистых заболеваний. [93] Повышенный риск смертности от респираторных причин связан с долгосрочным хроническим воздействием озона. [94]
Хронический озон оказывает пагубное воздействие на детей, особенно больных астмой. Риск госпитализации у детей с астмой увеличивается при хроническом воздействии озона; дети младшего возраста и дети с низким доходом подвергаются еще большему риску. [95]
Взрослые, страдающие респираторными заболеваниями (астма, [96] ХОБЛ, [97] рак легких [98] ), подвержены более высокому риску смертности и заболеваемости, а тяжелобольные пациенты также подвержены повышенному риску развития острого респираторного дистресс-синдрома при хроническом воздействии озона. [99]
Генераторы озона, продаваемые как воздухоочистители, намеренно производят газ озон. [42] Они часто рекламируются как устройства для контроля загрязнения воздуха в помещениях и используют вводящие в заблуждение термины для описания озона. Некоторые примеры описывают его как «заряженный кислород» или «чистый воздух», предполагая, что озон является здоровым или «лучшим» видом кислорода. [42] Однако, по данным Агентства по охране окружающей среды, «есть доказательства того, что при концентрациях, не превышающих стандарты общественного здравоохранения, озон не эффективен для удаления многих вызывающих запах химических веществ», и «Если озон используется в концентрациях, не превышающих стандарты общественного здравоохранения, он неэффективно удаляет вирусы, бактерии, плесень или другие биологические загрязнители». [42] Кроме того, в другом отчете говорится, что «результаты некоторых контролируемых исследований показывают, что концентрации озона, значительно превышающие эти стандарты [безопасности для человека], возможны, даже если пользователь следует инструкциям производителя по эксплуатации». [100]
На странице Калифорнийского совета по воздушным ресурсам перечислены воздухоочистители (многие из которых оснащены ионизаторами ), соответствующие предельному уровню озона в помещениях в 0,050 частей на миллион. [101] Из этой статьи:
Все портативные устройства для очистки воздуха в помещениях, продаваемые в Калифорнии, должны быть сертифицированы Калифорнийским советом по воздушным ресурсам (CARB). Для получения сертификата воздухоочистители должны пройти испытания на электробезопасность и выбросы озона, а также соответствовать пределу концентрации выбросов озона 0,050 частей на миллион. Для получения дополнительной информации о регламенте посетите регламент воздухоочистителей.


Прекурсоры озона — это группа загрязняющих веществ, в основном тех, которые выбрасываются при сжигании ископаемого топлива . Загрязнение приземного озона ( тропосферный озон ) создается вблизи поверхности Земли под действием дневных ультрафиолетовых лучей на эти прекурсоры. Озон на уровне земли в основном образуется из прекурсоров ископаемого топлива, но метан является естественным прекурсором, и очень низкий естественный фоновый уровень озона на уровне земли считается безопасным. В этом разделе рассматриваются последствия для здоровья сжигания ископаемого топлива, которое повышает уровень приземного озона намного выше фоновых уровней.
Существует множество доказательств того, что приземный озон может нанести вред функции легких и вызвать раздражение дыхательной системы . [55] [103] Воздействие озона (и загрязняющих веществ, которые его производят) связано с преждевременной смертью , астмой , бронхитом , сердечным приступом и другими сердечно-легочными проблемами. [104] [105]
Было показано, что длительное воздействие озона увеличивает риск смерти от респираторных заболеваний . [42] Исследование 450 000 человек, живущих в городах США, выявило значительную корреляцию между уровнем озона и респираторными заболеваниями в течение 18-летнего периода наблюдения. Исследование показало, что люди, живущие в городах с высоким уровнем озона, таких как Хьюстон или Лос-Анджелес, имели более чем 30% повышенный риск смерти от заболеваний легких. [106] [107]
Рекомендации по качеству воздуха, принятые Всемирной организацией здравоохранения , Агентством по охране окружающей среды США (EPA) и Европейским союзом, основаны на подробных исследованиях, направленных на определение уровней, которые могут вызвать измеримые последствия для здоровья .
По словам ученых из Агентства по охране окружающей среды, восприимчивые люди могут пострадать от уровня озона всего лишь в 40 нмоль/моль. [105] [108] [109] В ЕС текущее целевое значение концентрации озона составляет 120 мкг/м 3 , что составляет около 60 нмоль/моль. Этот целевой показатель применяется ко всем государствам-членам в соответствии с Директивой 2008/50/EC. [110] Концентрация озона измеряется как максимальное дневное среднее значение за 8 часов, и целевой показатель не должен превышаться более 25 календарных дней в году, начиная с января 2010 года. Хотя директива требует в будущем строгого соблюдения предела в 120 мкг/м 3 (т. е. средняя концентрация озона не должна превышаться ни в один день года), дата для этого требования не установлена, и это рассматривается как долгосрочная цель. [111]
В США Закон о чистом воздухе предписывает Агентству по охране окружающей среды устанавливать национальные стандарты качества окружающего воздуха для нескольких загрязняющих веществ, включая приземный озон, и округа, не соблюдающие эти стандарты, обязаны принять меры по снижению их уровня. В мае 2008 года по решению суда Агентство по охране окружающей среды снизило свой стандарт озона с 80 нмоль/моль до 75 нмоль/моль. Этот шаг оказался спорным, поскольку собственные ученые и консультативный совет Агентства рекомендовали снизить стандарт до 60 нмоль/моль. [105] Многие группы общественного здравоохранения и охраны окружающей среды также поддержали стандарт 60 нмоль/моль, [112] а Всемирная организация здравоохранения рекомендует 100 мкг/м 3 (51 нмоль/моль). [113]
7 января 2010 года Агентство по охране окружающей среды США (EPA) объявило о предлагаемых изменениях в Национальном стандарте качества окружающего воздуха (NAAQS) в отношении загрязняющего вещества озона, основного компонента смога:
... Агентство по охране окружающей среды предлагает установить уровень 8-часового первичного стандарта, который в окончательном варианте правил 2008 года был установлен на уровне 0,075 мкмоль/моль, на более низком уровне в диапазоне от 0,060 до 0,070 мкмоль/моль, чтобы обеспечить повышенную защиту детей и других групп риска от ряда O
3– сопутствующие неблагоприятные последствия для здоровья, которые варьируются от снижения функции легких и усиления респираторных симптомов до серьезных показателей респираторной заболеваемости, включая посещения отделений неотложной помощи и госпитализации по поводу респираторных заболеваний, а также, возможно, сердечно-сосудистую заболеваемость, а также общую смертность не от несчастных случаев и сердечно-легочную смертность... [114]
26 октября 2015 года Агентство по охране окружающей среды опубликовало окончательное правило со вступлением в силу 28 декабря 2015 года, которое пересмотрело 8-часовой первичный NAAQS с 0,075 ppm до 0,070 ppm. [115]
Агентство по охране окружающей среды разработало индекс качества воздуха (AQI), чтобы помочь объяснить уровень загрязнения воздуха для широкой общественности. Согласно действующим стандартам, восьмичасовые средние мольные доли озона от 85 до 104 нмоль/моль описываются как «вредные для чувствительных групп», от 105 нмоль/моль до 124 нмоль/моль — как «вредные для здоровья», а от 125 нмоль/моль до 404 нмоль/моль — как «очень вредные для здоровья». [116]
Озон также может присутствовать в загрязнении воздуха внутри помещений , частично из-за электронного оборудования, такого как фотокопировальные аппараты. Также известно, что существует связь между увеличением количества пыльцы, спор грибков и озона, вызванным грозами, и госпитализацией больных астмой . [117]
В викторианскую эпоху один британский народный миф утверждал, что запах моря был вызван озоном. На самом деле, характерный «запах моря» вызван диметилсульфидом , химическим веществом, вырабатываемым фитопланктоном . Викторианские британцы считали полученный запах «бодрящим». [118]
Исследование, направленное на оценку совместного воздействия озона и тепла на смертность во время европейских волн жары в 2003 году, пришло к выводу, что они, по-видимому, являются аддитивными. [119]
Озон, наряду с реактивными формами кислорода, такими как супероксид , синглетный кислород , перекись водорода и гипохлорит -ионы, вырабатывается лейкоцитами и другими биологическими системами (например, корнями бархатцев ) в качестве средства уничтожения инородных тел. Озон напрямую реагирует с органическими двойными связями. Кроме того, когда озон распадается на дикислород, он дает начало свободным радикалам кислорода , которые являются высокореактивными и способны повреждать многие органические молекулы . Более того, считается, что мощные окислительные свойства озона могут быть фактором, способствующим воспалению . Причинно-следственная связь между тем, как озон создается в организме и что он делает, все еще рассматривается и все еще является предметом различных интерпретаций, поскольку другие химические процессы в организме могут вызывать некоторые из тех же реакций. Существуют доказательства, связывающие катализируемый антителами путь окисления воды иммунного ответа человека с выработкой озона. В этой системе озон образуется в результате катализируемого антителами образования триоксидана из воды и нейтрофилами синглетного кислорода. [120]
При вдыхании озон реагирует с соединениями, выстилающими легкие, образуя специфические метаболиты, полученные из холестерина, которые, как считается, способствуют образованию и патогенезу атеросклеротических бляшек (форма сердечного заболевания ). Было подтверждено, что эти метаболиты естественным образом встречаются в атеросклеротических артериях человека и относятся к классу секостеролов, называемых атероналами , которые генерируются путем озонолиза двойной связи холестерина с образованием 5,6-секостерола [121] , а также вторичного продукта конденсации посредством альдолизации. [122]
Озон, как предполагалось, оказывает неблагоприятное воздействие на рост растений: «... озон снизил общую концентрацию хлорофиллов, каротиноидов и углеводов и увеличил содержание 1-аминоциклопропан-1-карбоновой кислоты (ACC) и выработку этилена. У обработанных растений пул аскорбата в листьях был снижен, в то время как перекисное окисление липидов и утечка растворенных веществ были значительно выше, чем у контрольных растений без озона. Данные показали, что озон запускал защитные механизмы против окислительного стресса у цитрусовых». [123] Исследования, в которых в качестве модели использовались растения перца, показали, что озон снижал урожайность плодов и изменял качество плодов. [124] [125] Кроме того, также наблюдалось снижение уровня хлорофиллов и антиоксидантной защиты на листьях, а также повышение уровня активных форм кислорода (ROS) и повреждений липидов и белков. [124] [125]
Исследование 2022 года пришло к выводу, что Восточная Азия теряет 63 миллиарда долларов урожая в год из-за загрязнения озоном, побочного продукта сжигания ископаемого топлива. Китай теряет около трети своего потенциального производства пшеницы и четверть своего производства риса. [126] [127]
Из-за сильных окислительных свойств озона, озон является основным раздражителем, особенно воздействующим на глаза и дыхательную систему, и может быть опасным даже при низких концентрациях. Канадский центр по безопасности и гигиене труда сообщает, что:
Даже очень низкие концентрации озона могут быть вредны для верхних дыхательных путей и легких. Тяжесть поражения зависит как от концентрации озона, так и от продолжительности воздействия. Тяжелое и постоянное повреждение легких или смерть могут возникнуть даже в результате очень кратковременного воздействия относительно низких концентраций». [128]
Для защиты работников, потенциально подвергающихся воздействию озона, Управление по охране труда и промышленной гигиене США установило допустимый предел воздействия (PEL) в размере 0,1 мкмоль/моль (29 CFR 1910.1000, таблица Z-1), рассчитанный как средневзвешенное значение за 8 часов. Более высокие концентрации особенно опасны, и NIOSH установил предел немедленной опасности для жизни и здоровья (IDLH) в размере 5 мкмоль/моль. [129] Рабочие среды, где используется озон или где он, вероятно, будет производиться, должны иметь достаточную вентиляцию, и разумно иметь монитор озона, который подаст сигнал тревоги, если концентрация превысит OSHA PEL. Непрерывные мониторы озона доступны у нескольких поставщиков.
Повышенное воздействие озона может иметь место на пассажирских самолетах , причем уровни зависят от высоты и атмосферной турбулентности. [130] Правила Федерального управления гражданской авиации США устанавливают предел в 250 нмоль/моль с максимальным четырехчасовым средним значением 100 нмоль/моль. [131] Некоторые самолеты оснащены преобразователями озона в системе вентиляции для снижения воздействия на пассажиров. [130]

Генераторы озона , или озонаторы , [132] используются для получения озона для очистки воздуха или удаления запахов дыма в нежилых помещениях. Эти генераторы озона могут производить более 3 г озона в час. Озон часто образуется в природе в условиях, когда O 2 не будет реагировать. [28] Озон, используемый в промышленности, измеряется в мкмоль/моль (ppm, частей на миллион), нмоль/моль (ppb, частей на миллиард), мкг/м 3 , мг/ч (миллиграммы в час) или весовых процентах. Режим применяемых концентраций колеблется от 1% до 5% (в воздухе) и от 6% до 14% (в кислороде) для методов старого поколения. Новые электролитические методы могут достигать концентраций растворенного озона в выходной воде до 20%-30%.
Температура и влажность играют большую роль в том, сколько озона производится с использованием традиционных методов генерации (таких как коронный разряд и ультрафиолетовый свет). Старые методы генерации будут производить менее 50% номинальной мощности, если они работают с влажным окружающим воздухом, в отличие от очень сухого воздуха. Новые генераторы, использующие электролитические методы, могут достигать более высокой чистоты и растворения за счет использования молекул воды в качестве источника производства озона.

Это наиболее распространенный тип генератора озона для большинства промышленных и личных целей. Хотя существуют вариации метода коронального разряда «горячей искры» для производства озона, включая генераторы озона медицинского и промышленного класса, эти устройства обычно работают с помощью трубки коронного разряда или озоновой пластины. [133] [134] Они, как правило, экономически эффективны и не требуют источника кислорода, кроме окружающего воздуха, для производства озона с концентрацией 3–6%. Колебания окружающего воздуха из-за погодных или других условий окружающей среды вызывают изменчивость производства озона. Однако они также производят оксиды азота в качестве побочного продукта. Использование осушителя воздуха может уменьшить или устранить образование азотной кислоты путем удаления водяного пара и увеличения производства озона. При комнатной температуре азотная кислота образует пар, который опасен при вдыхании. Симптомы могут включать боль в груди, одышку, головные боли и сухость в носу и горле, вызывающую ощущение жжения. Использование концентратора кислорода может дополнительно увеличить выработку озона и дополнительно снизить риск образования азотной кислоты за счет удаления не только водяного пара, но и основной массы азота.
Генераторы ультрафиолетового озона или вакуумно-ультрафиолетовые (ВУФ) генераторы озона используют источник света, который генерирует узкополосный ультрафиолетовый свет, подмножество того, что производится Солнцем. УФ-излучение Солнца поддерживает озоновый слой в стратосфере Земли. [135]
Генераторы ультрафиолетового озона используют окружающий воздух для производства озона, не используются системы подготовки воздуха (осушитель воздуха или концентратор кислорода), поэтому эти генераторы, как правило, менее дороги. Однако генераторы ультрафиолетового озона обычно производят озон с концентрацией около 0,5% или ниже, что ограничивает потенциальную скорость производства озона. Другим недостатком этого метода является то, что он требует, чтобы окружающий воздух (кислород) подвергался воздействию источника ультрафиолета в течение более длительного времени, и любой газ, который не подвергается воздействию источника ультрафиолета, не будет обработан. Это делает генераторы ультрафиолетового озона непрактичными для использования в ситуациях, связанных с быстро движущимися потоками воздуха или воды ( например, стерилизация воздуха в воздуховоде). Производство озона является одной из потенциальных опасностей бактерицидного ультрафиолетового облучения . Генераторы озона VUV используются в бассейнах и спа- салонах, где используется до миллионов галлонов воды. Генераторы озона VUV, в отличие от генераторов коронного разряда, не производят вредных побочных продуктов азота, а также в отличие от систем коронного разряда, генераторы озона VUV работают очень хорошо в условиях влажного воздуха. Обычно также нет необходимости в дорогостоящих механизмах отвода газов, и нет необходимости в осушителях воздуха или концентраторах кислорода, которые требуют дополнительных затрат и обслуживания.
В методе холодной плазмы чистый кислородный газ подвергается воздействию плазмы , созданной DBD . Двухатомный кислород расщепляется на отдельные атомы, которые затем рекомбинируют в триплеты, образуя озон. В отрасли принято ошибочно называть некоторые генераторы озона DBD генераторами коронного разряда CD. Обычно все озонаторы с твердыми плоскими металлическими электродами производят озон, используя метод разряда диэлектрического барьера. Машины холодной плазмы используют чистый кислород в качестве входного источника и производят максимальную концентрацию около 24% озона. Они производят гораздо большее количество озона за определенное время по сравнению с ультрафиолетовым производством, эффективность которого составляет около 2%. Разряды проявляются как нитевидный перенос электронов (микроразряды) в зазоре между двумя электродами. Чтобы равномерно распределить микроразряды, необходимо использовать диэлектрический изолятор для разделения металлических электродов и предотвращения дугообразования.
Электролитическая генерация озона (EOG) расщепляет молекулы воды на H 2 , O 2 и O 3 . В большинстве методов EOG водородный газ будет удален, оставив кислород и озон в качестве единственных продуктов реакции. Поэтому EOG может достичь более высокой растворимости в воде без других конкурирующих газов, обнаруженных в методе коронного разряда, таких как азотные газы, присутствующие в окружающем воздухе. Этот метод генерации может достигать концентраций 20–30 % и не зависит от качества воздуха, поскольку в качестве исходного материала используется вода. Электролитическое производство озона обычно неблагоприятно из-за высокого перенапряжения, необходимого для производства озона по сравнению с кислородом. Вот почему озон не производится во время типичного электролиза воды. Однако можно увеличить перенапряжение кислорода путем тщательного выбора катализатора таким образом, чтобы озон предпочтительно производился при электролизе. Катализаторами, обычно выбираемыми для этого подхода, являются диоксид свинца [136] или легированный бором алмаз. [137]
Соотношение озона и кислорода улучшается за счет увеличения плотности тока на аноде, охлаждения электролита вокруг анода до температуры, близкой к 0 °C, использования кислого электролита (например, разбавленной серной кислоты) вместо основного раствора и применения импульсного тока вместо постоянного тока. [138]
Озон нельзя хранить и транспортировать, как другие промышленные газы (потому что он быстро распадается на двухатомный кислород), и поэтому его необходимо производить на месте. Доступные генераторы озона различаются по расположению и конструкции высоковольтных электродов. При производительности более 20 кг в час в качестве заземляющего электрода может использоваться газо-водяной трубчатый теплообменник, собранный с трубчатыми высоковольтными электродами на газовой стороне. Режим типичного давления газа составляет около 2 бар (200 кПа ) абсолютного давления в кислороде и 3 бар (300 кПа) абсолютного давления в воздухе. Несколько мегаватт электроэнергии могут быть установлены на крупных объектах, применяемых в виде однофазного переменного тока с частотой от 50 до 8000 Гц и пиковыми напряжениями от 3000 до 20000 вольт. Приложенное напряжение обычно обратно пропорционально применяемой частоте.
Доминирующим параметром, влияющим на эффективность генерации озона, является температура газа, которая контролируется температурой охлаждающей воды и/или скоростью газа. Чем холоднее вода, тем лучше синтез озона. Чем ниже скорость газа, тем выше концентрация (но тем ниже чистый производимый озон). В типичных промышленных условиях почти 90% эффективной мощности рассеивается в виде тепла и должно быть удалено достаточным потоком охлаждающей воды.
Из-за высокой реакционной способности озона можно использовать только несколько материалов, таких как нержавеющая сталь (качество 316L), титан , алюминий (при отсутствии влаги), стекло , политетрафторэтилен или поливинилиденфторид . Витон можно использовать с ограничением постоянных механических сил и отсутствия влажности (ограничения влажности применяются в зависимости от формулы). Гипалон можно использовать с ограничением, что с ним не контактирует вода, за исключением нормальных атмосферных уровней. Охрупчивание или усадка являются распространенным видом разрушения эластомеров под воздействием озона. Растрескивание под действием озона является распространенным видом разрушения эластомерных уплотнений, таких как уплотнительные кольца .
Силиконовые каучуки обычно подходят для использования в качестве прокладок при концентрации озона ниже 1% по весу, например, в оборудовании для ускоренного старения образцов резины.
Озон может образовываться из O
2электрическими разрядами и воздействием электромагнитного излучения высокой энергии . Неподавленная дуга в электрических контактах, щетках двигателя или механических переключателях разрушает химические связи атмосферного кислорода, окружающего контакты [ O
2→ 2O]. Свободные радикалы кислорода внутри и вокруг дуги рекомбинируют, образуя озон [ O
3]. [139] Определенное электрооборудование генерирует значительные уровни озона. Это особенно касается устройств, использующих высокое напряжение , таких как ионные очистители воздуха , лазерные принтеры , копировальные аппараты , электрошокеры и дуговые сварочные аппараты . Электродвигатели, использующие щетки, могут генерировать озон из-за повторяющегося искрения внутри устройства. Большие двигатели, использующие щетки, такие как те, которые используются в лифтах или гидравлических насосах, будут генерировать больше озона, чем двигатели меньшего размера.
Озон аналогичным образом образуется в явлениях гроз Кататумбо на реке Кататумбо в Венесуэле , хотя нестабильность озона делает сомнительным, что он оказывает какое-либо влияние на озоносферу. [140] Это крупнейший в мире естественный генератор озона, что обусловливает призывы к его включению в список объектов Всемирного наследия ЮНЕСКО . [141]

В лаборатории озон можно получить электролизом с использованием 9-вольтовой батареи , стержневого графитового катода , платинового проволочного анода и 3- молярного электролита серной кислоты . [142] Происходящие в полуэлементе реакции следующие:
где E° представляет собой стандартный электродный потенциал .
В чистой реакции три эквивалента воды преобразуются в один эквивалент озона и три эквивалента водорода . Образование кислорода является конкурирующей реакцией.
Его также может генерировать дуга высокого напряжения . В своей простейшей форме, переменный ток высокого напряжения, такой как выход трансформатора неоновой вывески, подключается к двум металлическим стержням, концы которых расположены достаточно близко друг к другу, чтобы обеспечить дугу. Образующаяся дуга преобразует атмосферный кислород в озон.
Часто желательно удержать озон. Это можно сделать с помощью аппарата, состоящего из двух концентрических стеклянных трубок, запаянных вместе сверху, с газовыми портами сверху и снизу внешней трубки. Внутренний сердечник должен иметь отрезок металлической фольги, вставленный в него, соединенный с одной стороной источника питания. Другая сторона источника питания должна быть соединена с другим куском фольги, обернутым вокруг внешней трубки. Источник сухого O
2прикладывается к нижнему порту. Когда высокое напряжение прикладывается к выводам фольги, электричество разряжается между сухим дикислородом в середине и образует O
3и О
2который будет вытекать из верхнего порта. Это называется озонатор Сименса. Реакцию можно суммировать следующим образом: [28]
Наибольшее применение озон получает при приготовлении фармацевтических препаратов , синтетических смазочных материалов и многих других коммерчески полезных органических соединений , где он используется для разрыва связей углерод -углерод. [28] Его также можно использовать для отбеливания веществ и для уничтожения микроорганизмов в воздухе и водных источниках. [143] Многие муниципальные системы питьевой воды убивают бактерии озоном вместо более распространенного хлора . [144] Озон имеет очень высокий окислительный потенциал . [145] Озон не образует хлорорганических соединений и не остается в воде после обработки. Озон может образовывать предполагаемый канцероген бромат в исходной воде с высокой концентрацией бромида . Закон США о безопасной питьевой воде предписывает, чтобы эти системы вводили количество хлора для поддержания минимального уровня остаточного свободного хлора в трубах 0,2 мкмоль/моль на основе результатов регулярных испытаний. Там, где электроэнергия в изобилии, озон является экономически эффективным методом очистки воды, поскольку он производится по требованию и не требует транспортировки и хранения опасных химикатов. После разложения он не оставляет в питьевой воде ни вкуса, ни запаха.
Хотя низкие уровни озона рекламировались как некоторые дезинфицирующие средства в жилых домах, концентрация озона в сухом воздухе, необходимая для быстрого, существенного воздействия на патогены, находящиеся в воздухе, превышает безопасные уровни, рекомендованные Управлением по охране труда и промышленной гигиене США и Агентством по охране окружающей среды . Контроль влажности может значительно улучшить как убойную силу озона, так и скорость его распада обратно на кислород (большая влажность обеспечивает большую эффективность). Споровые формы большинства патогенов очень устойчивы к атмосферному озону в концентрациях, при которых у пациентов с астмой начинаются проблемы.
В 1908 году было введено искусственное озонирование Центральной линии лондонского метрополитена для дезинфекции воздуха. Процесс оказался стоящим, но был прекращен к 1956 году. Однако полезный эффект поддерживался озоном, созданным попутно из электрических разрядов двигателей поездов (см. выше: Попутное производство). [146]
Генераторы озона были предоставлены школам и университетам Уэльса на осенний семестр 2021 года для дезинфекции классных комнат после вспышек COVID-19 . [147]
В промышленности озон используется для:
Озон является реагентом во многих органических реакциях в лабораторных и промышленных условиях. Озонолиз — это расщепление алкена до карбонильных соединений .
Многие больницы по всему миру используют большие генераторы озона для дезинфекции операционных между операциями. Комнаты очищаются, а затем герметично запечатываются перед заполнением озоном, который эффективно убивает или нейтрализует все оставшиеся бактерии. [153]
Озон используется в качестве альтернативы хлору или диоксиду хлора при отбеливании древесной массы . [154] Его часто используют в сочетании с кислородом и перекисью водорода, чтобы исключить необходимость в хлорсодержащих соединениях при производстве высококачественной белой бумаги . [155]
Озон можно использовать для детоксикации цианидных отходов (например, от добычи золота и серебра ) путем окисления цианида до цианата и, в конечном итоге, до диоксида углерода . [156]
С момента изобретения плазменных реакторов с диэлектрическим барьерным разрядом (DBD) он использовался для обработки воды озоном. [157] Однако с более дешевыми альтернативными дезинфицирующими средствами, такими как хлор, такие применения дезактивации воды озоном DBD были ограничены высоким энергопотреблением и громоздким оборудованием. [158] [159] Несмотря на это, с исследованиями, выявляющими негативное воздействие обычных дезинфицирующих средств, таких как хлор, в отношении токсичных остатков и неэффективности в уничтожении определенных микроорганизмов, [160] дезактивация озоном на основе плазмы DBD представляет интерес в современных доступных технологиях. Хотя озонирование воды с высокой концентрацией бромида действительно приводит к образованию нежелательных бромированных побочных продуктов дезинфекции, если питьевая вода не производится путем опреснения, озонирование, как правило, можно применять без опасений относительно этих побочных продуктов. [159] [161] [162] [163] Преимущества озона включают высокий термодинамический окислительный потенциал, меньшую чувствительность к органическому материалу и лучшую переносимость изменений pH при сохранении способности убивать бактерии, грибки, вирусы, а также споры и цисты. [164] [165] [166] Хотя озон широко применялся в Европе на протяжении десятилетий, в США он редко используется для дезактивации из-за ограничений, связанных с высоким энергопотреблением, громоздкой установкой и клеймом, связанным с токсичностью озона. [158] [167] Учитывая это, недавние исследовательские усилия были направлены на изучение эффективных систем очистки воды озоном. [168] Исследователи изучили легкие и компактные маломощные поверхностные реакторы DBD, [169] [170] энергоэффективные объемные реакторы DBD [171] и маломощные микромасштабные реакторы DBD. [172] [173] Такие исследования могут помочь проложить путь к повторному принятию метода дезактивации воды озоном на основе плазмы DBD, особенно в США.
Уровни озона, безопасные для людей, неэффективны для уничтожения грибков и бактерий. [174] Некоторые потребительские дезинфицирующие и косметические средства выделяют озон в количествах, вредных для здоровья человека. [174]
Устройства, генерирующие высокие уровни озона, некоторые из которых используют ионизацию, используются для дезинфекции и дезодорирования нежилых зданий, комнат, воздуховодов, дровяных сараев, лодок и других транспортных средств.
Озонированная вода используется для стирки одежды и дезинфекции продуктов питания, питьевой воды и поверхностей в доме. По данным Управления по контролю за продуктами и лекарствами США (FDA), оно «вносит поправки в правила пищевых добавок , чтобы обеспечить безопасное использование озона в газообразной и водной фазах в качестве противомикробного агента для пищевых продуктов, включая мясо и птицу». Исследования в Калифорнийском политехническом университете показали, что уровни озона 0,3 мкмоль/моль, растворенные в отфильтрованной водопроводной воде, могут привести к сокращению более чем на 99,99% таких пищевых микроорганизмов, как сальмонелла, E. coli 0157:H7 и Campylobacter . Это количество в 20 000 раз превышает рекомендуемые ВОЗ пределы, указанные выше. [149] [175] Озон можно использовать для удаления остатков пестицидов с фруктов и овощей . [176] [177]
Озон используется в домах и джакузи для уничтожения бактерий в воде и для уменьшения количества хлора или брома, необходимого для их реактивации в свободное состояние. Поскольку озон не остается в воде достаточно долго, сам по себе озон неэффективен для предотвращения перекрестного заражения среди купающихся и должен использоваться в сочетании с галогенами . Газообразный озон, созданный ультрафиолетовым светом или коронным разрядом, впрыскивается в воду. [178]
Озон также широко используется для обработки воды в аквариумах и прудах для разведения рыбы. Его использование может минимизировать рост бактерий, контролировать паразитов, исключить передачу некоторых заболеваний и уменьшить или устранить «пожелтение» воды. Озон не должен контактировать с жаберными структурами рыб. Природная соленая вода (с формами жизни) обеспечивает достаточный «мгновенный спрос», чтобы контролируемые количества озона активировали ионы брома до бромноватистой кислоты , и озон полностью распадается за несколько секунд или минут. Если используется озон с кислородной подпиткой, вода будет содержать больше растворенного кислорода, а жаберные структуры рыб атрофируются, делая их зависимыми от воды, обогащенной кислородом.
Озонирование — процесс насыщения воды озоном — может использоваться в аквакультуре для облегчения органического распада. Озон также добавляется в рециркуляционные системы для снижения уровня нитрита [179] путем преобразования в нитрат . Если уровень нитрита в воде высок, нитриты также будут накапливаться в крови и тканях рыб, где они мешают переносу кислорода (вызывают окисление гем-группы гемоглобина из железа ( Fe2+
) в железо ( Fe3+
), что делает гемоглобин неспособным связывать O
2). [180] Несмотря на эти очевидные положительные эффекты, использование озона в системах рециркуляции связано со снижением уровня биодоступного йода в системах с соленой водой, что приводит к симптомам дефицита йода, таким как зоб и снижение роста личинок сенегальской камбалы ( Solea senegalensis ). [181]
Озонированная морская вода используется для поверхностной дезинфекции икры пикши и атлантического палтуса против нодавируса. Нодавирус является летальным и вертикально передающимся вирусом, который вызывает серьезную смертность у рыб. Икра пикши не должна обрабатываться высоким уровнем озона, так как обработанная таким образом икра не вылупляется и погибает через 3–4 дня. [182]
Применение озона к свежесрезанным ананасам и бананам показывает увеличение флавоноидов и общего содержания фенолов при экспозиции до 20 минут. Наблюдается снижение содержания аскорбиновой кислоты (одна из форм витамина С ), но положительный эффект на общее содержание фенолов и флавоноидов может преодолеть отрицательный эффект. [183] Помидоры при обработке озоном показывают увеличение β-каротина, лютеина и ликопина. [184] Однако применение озона к клубнике в предуборочный период показывает снижение содержания аскорбиновой кислоты. [185]
Озон облегчает извлечение некоторых тяжелых металлов из почвы с помощью ЭДТА . ЭДТА образует прочные водорастворимые координационные соединения с некоторыми тяжелыми металлами ( Pb , Zn ), что позволяет растворять их из загрязненной почвы. Если загрязненную почву предварительно обработать озоном, эффективность извлечения Pb , Am и Pu увеличивается на 11,0–28,9% [186] , 43,5% [187] и 50,7% [187] соответственно.
Опыление сельскохозяйственных культур является неотъемлемой частью экосистемы. Озон может оказывать пагубное воздействие на взаимодействие растений и опылителей. [188] Опылители переносят пыльцу с одного растения на другое. Это важный цикл внутри экосистемы. Изменение определенных атмосферных условий вокруг мест опыления или с помощью ксенобиотиков может вызвать неизвестные изменения в естественных циклах опылителей и цветковых растений. В исследовании, проведенном в Северо-Западной Европе, опылители сельскохозяйственных культур подвергались большему негативному воздействию, когда уровни озона были выше. [189]
Использование озона для лечения заболеваний не подкреплено высококачественными доказательствами и обычно считается альтернативной медициной . [190]
Сноски
Цитаты
Озон. Диамагнитная трехатомная молекула ...
{{cite web}}: CS1 maint: unfit URL (link)