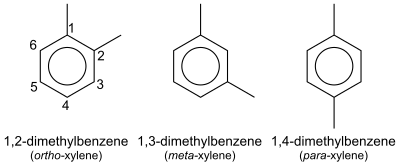
В органической химии ксилол или ксилол ( от греческого ξύλον (ксилон) «дерево»; [1] [2] название IUPAC : диметилбензол ) представляют собой любое из трех органических соединений с формулой (CH 3 ) 2 C 6 H 4 . Они образуются в результате замещения двух атомов водорода метильными группами в бензольном кольце; то, какие атомы водорода будут замещены, определяет, какой из трех структурных изомеров получится. Это бесцветная, легковоспламеняющаяся, слегка жирная жидкость, имеющая большое промышленное значение. [3]
Смесь называют одновременно ксилолом и, точнее, ксилолами. Смешанные ксилолы относятся к смеси ксилолов и этилбензола . Эти четыре соединения имеют идентичные эмпирические формулы C 8 H 10 . Обычно эти четыре соединения производятся вместе различными методами каталитического риформинга и пиролиза . [4]
Ксилолы являются важным нефтехимическим продуктом , производимым путем каталитического риформинга , а также карбонизации угля при производстве коксового топлива . Они также встречаются в сырой нефти в концентрациях около 0,5–1%, в зависимости от источника. Небольшие количества встречаются в бензине и авиационном топливе .
Ксилолы производятся в основном как часть ароматических соединений БТХ ( бензола , толуола и ксилолов), экстрагируемых из продукта каталитического риформинга, известного как риформинг .
Ежегодно производится несколько миллионов тонн. [3] В 2011 году глобальный консорциум начал строительство одного из крупнейших в мире заводов по производству ксилола в Сингапуре . [5]
Ксилол был впервые выделен и назван в 1850 году французским химиком Огюстом Кауром (1813–1891), поскольку он был обнаружен как составная часть древесной смолы . [6]
Ксилолы получают метилированием толуола и бензола . [3] [7] Производимый коммерческий или лабораторный ксилол обычно содержит около 40–65% м -ксилола и до 20% каждого из о -ксилола , п -ксилола и этилбензола . [8] [9] [10] Соотношение изомеров можно изменить в пользу высокоценного п -ксилола с помощью запатентованного процесса UOP- Isomar [11] или путем трансалкилирования ксилола самим собой или триметилбензолом. Эти превращения катализируются цеолитами . [3]
ZSM-5 используется для облегчения некоторых реакций изомеризации, ведущих к массовому производству современных пластмасс.
Физические свойства изомеров ксилола различаются незначительно. Температура плавления колеблется от -47,87 ° C (-54,17 ° F) ( м -ксилол) до 13,26 ° C (55,87 ° F) ( п -ксилол) - как обычно, температура плавления пара-изомера намного выше, поскольку он упаковывает больше легко в кристаллической структуре. Температура кипения каждого изомера составляет около 140 ° C (284 ° F). Плотность каждого изомера составляет около 0,87 г/мл (7,3 фунта/галлон США; 8,7 фунта/имп-галлон) и, следовательно, менее плотна, чем вода . Запах ксилола можно обнаружить при концентрациях от 0,08 до 3,7 частей на миллион (частей ксилола на миллион частей воздуха), а вкус ксилола можно ощутить в воде при концентрации от 0,53 до 1,8 частей на миллион. [9]
Ксилолы образуют азеотропы с водой и различными спиртами. Азеотроп с водой состоит на 60% из ксилолов и кипит при 94,5°С. [3] Как и многие алкилбензольные соединения, ксилолы образуют комплексы с различными галогенуглеродами . [12] Комплексы разных изомеров часто имеют резко отличающиеся друг от друга свойства. [13]
п -Ксилол является основным предшественником терефталевой кислоты и диметилтерефталата , мономеров, используемых в производстве пластиковых бутылок из полиэтилентерефталата (ПЭТ) и полиэфирной одежды. Таким образом потребляется 98% производимого п -ксилола и половина всех производимых ксилолов. [10] [14] о -ксилол является важным предшественником фталевого ангидрида . Спрос на изофталевую кислоту относительно невелик, поэтому м -ксилол ищут редко (а отсюда и полезность его превращения в о- и п -изомеры).
Ксилолы используются в качестве растворителя в полиграфической , резиновой и кожевенной промышленности. Это обычный компонент чернил, резины и клеев . [15] При разбавлении красок и лаков его можно заменить толуолом , если требуется более медленное высыхание, и поэтому он используется реставраторами предметов искусства при тестировании растворимости. [16] Точно так же это чистящее средство , например, для стали , кремниевых пластин и интегральных схем . В стоматологии ксилол можно использовать для растворения гуттаперчи — материала, используемого в эндодонтии (лечении корневых каналов). В нефтяной промышленности ксилол также является частым компонентом растворителей парафина, используемых, когда трубки забиваются парафином.
Ксилол используется в лаборатории для приготовления ванн с сухим льдом для охлаждения реакционных сосудов [17] и в качестве растворителя для удаления синтетического иммерсионного масла с объектива микроскопа в световой микроскопии . [18] В гистологии ксилол является наиболее широко используемым очищающим средством. [19] Ксилол используется для удаления парафина с высушенных предметных стекол перед окрашиванием. После окрашивания предметные стекла помещают в ксилол перед установкой покровного стекла.
В одном крупномасштабном применении пара-ксилол преобразуется в терефталевую кислоту . Основное применение ортоксилола — в качестве предшественника эфиров фталевой кислоты , используемых в качестве пластификатора . Мета-ксилол превращается в производные изофталевой кислоты , которые входят в состав алкидных смол . [3]
Обычно с ксилолами происходят реакции двух типов: с участием метильных групп и с участием связей C–H в кольце. Будучи бензильными и, следовательно, ослабленными, связи C–H метильных групп подвержены свободнорадикальным реакциям, включая галогенирование до соответствующих дихлоридов ксилола (бис(хлорметил)бензолов), в то время как монобромирование дает ксилилбромид , агент слезоточивого газа . . Окисление и аммоксидирование также воздействуют на метильные группы, образуя дикарбоновые кислоты и динитрилы. Электрофилы атакуют ароматическое кольцо, приводя к хлор- и нитроксиленам. [3]
Ксилол легковоспламеняем, но имеет умеренную острую токсичность: ЛД 50 колеблется от 200 до 5000 мг/кг для животных. Пероральная LD 50 для крыс составляет 4300 мг/кг. Основным механизмом детоксикации является окисление до метилбензойной кислоты и гидроксилирование до гидроксилена. [3]
Основным эффектом вдыхания паров ксилола является угнетение центральной нервной системы (ЦНС) с такими симптомами, как головная боль, головокружение, тошнота и рвота. При воздействии 100 ppm можно испытывать тошноту или головную боль. При воздействии от 200 до 500 частей на миллион симптомы могут включать чувство «кайфа», головокружение, слабость, раздражительность, рвоту и замедление реакции. [20] [21]
Побочные эффекты воздействия низких концентраций ксилола ( < 200 ppm ) обратимы и не вызывают необратимых повреждений. Длительное воздействие может привести к головным болям, раздражительности, депрессии, бессоннице, возбуждению, крайней усталости, тремору, потере слуха, нарушению концентрации и кратковременной потере памяти. [22] [ нужны разъяснения ] Состояние, называемое хронической энцефалопатией, вызванной растворителями , широко известное как «синдром органических растворителей», связано с воздействием ксилола. Имеется очень мало информации о том, как изолировать ксилол от воздействия других растворителей при изучении этих эффектов. [20]
Нарушения слуха также были связаны с воздействием ксилола, как согласно исследованиям на экспериментальных животных [23] [24] , так и клиническим исследованиям. [25] [26] [27]
Ксилол также раздражает кожу и лишает ее кожного сала, делая ее более проницаемой для других химикатов. Во избежание проблем с профессиональным здоровьем, вызванных воздействием ксилола, рекомендуется использовать непроницаемые перчатки и маски, а также, при необходимости, респираторы. [20]
Ксилолы метаболизируются до метилгиппуровых кислот . [28] [29] Присутствие метилгиппуровой кислоты можно использовать в качестве биомаркера для определения воздействия ксилола. [29] [30]