
Биосинтез белка (или синтез белка ) является основным биологическим процессом, происходящим внутри клеток , уравновешивающим потерю клеточных белков (через деградацию или экспорт ) посредством производства новых белков. Белки выполняют ряд критических функций как ферменты , структурные белки или гормоны . Синтез белка является очень похожим процессом как для прокариот , так и для эукариот, но есть некоторые явные различия. [1]
Синтез белка можно разделить на две фазы: транскрипцию и трансляцию . Во время транскрипции участок ДНК , кодирующий белок, известный как ген , преобразуется в молекулу-шаблон, называемую информационной РНК (мРНК). Это преобразование осуществляется ферментами, известными как РНК-полимеразы , в ядре клетки . [2] У эукариот эта мРНК изначально производится в преждевременной форме ( пре-мРНК ), которая подвергается посттранскрипционным модификациям для получения зрелой мРНК . Зрелая мРНК экспортируется из ядра клетки через ядерные поры в цитоплазму клетки для осуществления трансляции. Во время трансляции мРНК считывается рибосомами , которые используют последовательность нуклеотидов мРНК для определения последовательности аминокислот . Рибосомы катализируют образование ковалентных пептидных связей между закодированными аминокислотами для формирования полипептидной цепи . [ необходима цитата ]
После трансляции полипептидная цепь должна свернуться, чтобы сформировать функциональный белок; например, чтобы функционировать как фермент, полипептидная цепь должна правильно свернуться, чтобы образовать функциональный активный участок . Чтобы принять функциональную трехмерную форму, полипептидная цепь должна сначала образовать ряд более мелких базовых структур, называемых вторичными структурами . Затем полипептидная цепь в этих вторичных структурах сворачивается, образуя общую трехмерную третичную структуру . После правильного сворачивания белок может подвергаться дальнейшему созреванию посредством различных посттрансляционных модификаций , которые могут изменить способность белка функционировать, его расположение внутри клетки (например, цитоплазма или ядро) и его способность взаимодействовать с другими белками . [3]
Биосинтез белка играет ключевую роль в заболевании, поскольку изменения и ошибки в этом процессе, через базовые мутации ДНК или неправильное сворачивание белка , часто являются основными причинами заболевания. Мутации ДНК изменяют последующую последовательность мРНК, которая затем изменяет кодируемую мРНК последовательность аминокислот. Мутации могут привести к тому, что полипептидная цепь станет короче, генерируя стоп-последовательность , которая вызывает раннее прекращение трансляции. Альтернативно, мутация в последовательности мРНК изменяет конкретную аминокислоту, кодируемую в этом положении в полипептидной цепи. Это изменение аминокислоты может повлиять на способность белка функционировать или правильно сворачиваться. [4] Неправильно свернутые белки имеют тенденцию образовывать плотные белковые комки , которые часто участвуют в заболеваниях, особенно неврологических расстройствах , включая болезнь Альцгеймера и болезнь Паркинсона . [5]
Транскрипция происходит в ядре с использованием ДНК в качестве матрицы для получения мРНК . У эукариот эта молекула мРНК известна как пре-мРНК , поскольку она подвергается посттранскрипционным модификациям в ядре для получения зрелой молекулы мРНК. Однако у прокариот посттранскрипционные модификации не требуются, поэтому зрелая молекула мРНК немедленно производится путем транскрипции. [1]
Первоначально фермент, известный как геликаза, воздействует на молекулу ДНК. ДНК имеет антипараллельную , двойную спиральную структуру, состоящую из двух комплементарных полинуклеотидных нитей, удерживаемых вместе водородными связями между парами оснований. Хеликаза разрушает водородные связи, заставляя область ДНК, соответствующую гену, раскручиваться, разделяя две нити ДНК и обнажая ряд оснований. Несмотря на то, что ДНК является двухцепочечной молекулой, только одна из нитей действует как шаблон для синтеза пре-мРНК; эта нить известна как шаблонная нить. Другая нить ДНК (которая комплементарна шаблонной нити) известна как кодирующая нить. [6]
И ДНК, и РНК обладают внутренней направленностью , то есть у молекулы есть два различных конца. Это свойство направленности обусловлено асимметричными базовыми нуклеотидными субъединицами с фосфатной группой на одной стороне пентозного сахара и основанием на другой. Пять атомов углерода в пентозном сахаре пронумерованы от 1' (где ' означает штрих) до 5'. Таким образом, фосфодиэфирные связи, соединяющие нуклеотиды, образуются путем присоединения гидроксильной группы на 3'-углероде одного нуклеотида к фосфатной группе на 5'-углероде другого нуклеотида. Следовательно, кодирующая цепь ДНК проходит в направлении от 5' к 3', а комплементарная, матричная цепь ДНК проходит в противоположном направлении от 3' к 5'. [1]
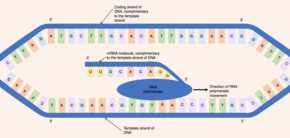
Фермент РНК-полимераза связывается с открытой нитью шаблона и считывает ген в направлении от 3' к 5'. Одновременно РНК-полимераза синтезирует одну нить пре-мРНК в направлении от 5' к 3', катализируя образование фосфодиэфирных связей между активированными нуклеотидами (свободными в ядре), которые способны к комплементарному спариванию оснований с нитью шаблона. За движущейся РНК-полимеразой две нити ДНК воссоединяются, поэтому одновременно экспонируются только 12 пар оснований ДНК. [6] РНК-полимераза строит молекулу пре-мРНК со скоростью 20 нуклеотидов в секунду, что позволяет производить тысячи молекул пре-мРНК из одного и того же гена за час. Несмотря на высокую скорость синтеза, фермент РНК-полимераза содержит свой собственный механизм корректуры. Механизмы корректуры позволяют РНК-полимеразе удалять неправильные нуклеотиды (которые не являются комплементарными матричной цепи ДНК) из растущей молекулы пре-мРНК посредством реакции вырезания. [1] Когда РНК-полимераза достигает определенной последовательности ДНК, которая завершает транскрипцию, РНК-полимераза отсоединяется, и синтез пре-мРНК завершается. [6]
Синтезированная молекула пре-мРНК комплементарна шаблонной цепи ДНК и имеет ту же нуклеотидную последовательность, что и кодирующая цепь ДНК. Однако в нуклеотидном составе молекул ДНК и мРНК есть одно принципиальное различие. ДНК состоит из оснований: гуанина , цитозина , аденина и тимина (G, C, A и T). РНК также состоит из четырех оснований: гуанина, цитозина, аденина и урацила . В молекулах РНК основание ДНК тимин заменено урацилом, который способен образовывать пары с аденином. Поэтому в молекуле пре-мРНК все комплементарные основания, которые были бы тимином в кодирующей цепи ДНК, заменены урацилом. [7]

После завершения транскрипции молекула пре-мРНК подвергается посттранскрипционным модификациям, в результате чего образуется зрелая молекула мРНК.
В посттранскрипционных модификациях выделяют 3 ключевых этапа: [ необходима ссылка ]
5'-кэп добавляется к 5'-концу молекулы пре-мРНК и состоит из гуанинового нуклеотида, модифицированного посредством метилирования . Целью 5'-кэпа является предотвращение разрушения зрелых молекул мРНК перед трансляцией, кэп также способствует связыванию рибосомы с мРНК для начала трансляции [8] и позволяет мРНК дифференцироваться от других РНК в клетке. [1] Напротив, 3'-поли(А)-хвост добавляется к 3'-концу молекулы мРНК и состоит из 100-200 адениновых оснований. [8] Эти различные модификации мРНК позволяют клетке обнаружить, что полное сообщение мРНК не повреждено, если присутствуют как 5'-кэп, так и 3'-хвост. [1]
Эта модифицированная молекула пре-мРНК затем подвергается процессу сплайсинга РНК. Гены состоят из серии интронов и экзонов , интроны представляют собой нуклеотидные последовательности, которые не кодируют белок, в то время как экзоны представляют собой нуклеотидные последовательности, которые непосредственно кодируют белок. Интроны и экзоны присутствуют как в базовой последовательности ДНК, так и в молекуле пре-мРНК, поэтому для получения зрелой молекулы мРНК, кодирующей белок, должен произойти сплайсинг. [6] Во время сплайсинга промежуточные интроны удаляются из молекулы пре-мРНК с помощью многобелкового комплекса, известного как сплайсосома (состоящего из более чем 150 белков и РНК). [9] Затем эта зрелая молекула мРНК экспортируется в цитоплазму через ядерные поры в оболочке ядра.

В процессе трансляции рибосомы синтезируют полипептидные цепи из молекул-шаблонов мРНК. У эукариот трансляция происходит в цитоплазме клетки, где рибосомы находятся либо свободно плавающими, либо прикрепленными к эндоплазматическому ретикулуму . У прокариот, у которых отсутствует ядро, процессы как транскрипции, так и трансляции происходят в цитоплазме. [10]
Рибосомы — это сложные молекулярные машины , состоящие из смеси белка и рибосомальной РНК , организованные в две субъединицы (большую и малую), которые окружают молекулу мРНК. Рибосома считывает молекулу мРНК в направлении 5'-3' и использует ее в качестве шаблона для определения порядка аминокислот в полипептидной цепи. [11] Для трансляции молекулы мРНК рибосома использует небольшие молекулы, известные как транспортные РНК (тРНК), для доставки правильных аминокислот в рибосому. Каждая тРНК состоит из 70-80 нуклеотидов и принимает характерную структуру клеверного листа из-за образования водородных связей между нуклеотидами внутри молекулы. Существует около 60 различных типов тРНК, каждая тРНК связывается с определенной последовательностью из трех нуклеотидов (известной как кодон ) внутри молекулы мРНК и доставляет определенную аминокислоту. [12]
Рибосома изначально прикрепляется к мРНК в стартовом кодоне (AUG) и начинает транслировать молекулу. Нуклеотидная последовательность мРНК считывается триплетами ; три соседних нуклеотида в молекуле мРНК соответствуют одному кодону. Каждая тРНК имеет открытую последовательность из трех нуклеотидов, известную как антикодон, которая комплементарна по последовательности определенному кодону, который может присутствовать в мРНК. Например, первый встреченный кодон — это стартовый кодон, состоящий из нуклеотидов AUG. Правильная тРНК с антикодоном (комплементарная последовательность из 3 нуклеотидов UAC) связывается с мРНК с помощью рибосомы. Эта тРНК доставляет правильную аминокислоту, соответствующую кодону мРНК, в случае стартового кодона это аминокислота метионин. Следующий кодон (соседний со стартовым кодоном) затем связывается правильной тРНК с комплементарным антикодоном, доставляя следующую аминокислоту в рибосому. Затем рибосома использует свою ферментативную активность пептидилтрансферазы для катализа образования ковалентной пептидной связи между двумя соседними аминокислотами. [6]
Затем рибосома перемещается вдоль молекулы мРНК к третьему кодону. Затем рибосома высвобождает первую молекулу тРНК, поскольку только две молекулы тРНК могут быть объединены одной рибосомой одновременно. Выбирается следующая комплементарная тРНК с правильным антикодоном, комплементарным третьему кодону, доставляя следующую аминокислоту в рибосому, которая ковалентно присоединяется к растущей полипептидной цепи. Этот процесс продолжается, когда рибосома перемещается вдоль молекулы мРНК, добавляя до 15 аминокислот в секунду к полипептидной цепи. За первой рибосомой до 50 дополнительных рибосом могут связываться с молекулой мРНК, образуя полисому , что позволяет осуществлять одновременный синтез нескольких идентичных полипептидных цепей. [6] Остановка растущей полипептидной цепи происходит, когда рибосома встречает стоп-кодон (UAA, UAG или UGA) в молекуле мРНК. Когда это происходит, ни одна тРНК не может ее распознать, и фактор высвобождения вызывает высвобождение полной полипептидной цепи из рибосомы. [12] Доктор Хар Гобинд Корана , ученый родом из Индии, расшифровал последовательности РНК примерно для 20 аминокислот. [ необходима цитата ] За свою работу он был удостоен Нобелевской премии в 1968 году вместе с двумя другими учеными.

После завершения синтеза полипептидной цепи полипептидная цепь сворачивается, принимая определенную структуру, которая позволяет белку выполнять свои функции. Основная форма структуры белка известна как первичная структура , которая представляет собой просто полипептидную цепь, т. е. последовательность ковалентно связанных аминокислот. Первичная структура белка кодируется геном. Поэтому любые изменения в последовательности гена могут изменить первичную структуру белка и все последующие уровни структуры белка, в конечном итоге изменяя общую структуру и функцию. [ необходима цитата ]
Первичная структура белка (полипептидная цепь) затем может складываться или сворачиваться, образуя вторичную структуру белка. Наиболее распространенные типы вторичной структуры известны как альфа-спираль или бета-слои , это небольшие структуры, образованные водородными связями, образующимися внутри полипептидной цепи. Затем эта вторичная структура сворачивается, образуя третичную структуру белка. Третичная структура — это общая трехмерная структура белка, которая состоит из различных вторичных структур, складывающихся вместе. В третичной структуре ключевые особенности белка, например активный центр, сворачиваются и формируются, позволяя белку функционировать. Наконец, некоторые белки могут принимать сложную четвертичную структуру . Большинство белков состоят из одной полипептидной цепи, однако некоторые белки состоят из нескольких полипептидных цепей (известных как субъединицы), которые сворачиваются и взаимодействуют, образуя четвертичную структуру. Следовательно, весь белок представляет собой многосубъединичный комплекс, состоящий из нескольких сложенных субъединиц полипептидной цепи, например гемоглобина . [13]
Существуют события, которые следуют за биосинтезом белка, такие как протеолиз [14] и сворачивание белка. Протеолиз относится к расщеплению белков протеазами и распаду белков на аминокислоты под действием ферментов.
Когда сворачивание белка в зрелое, функциональное 3D-состояние завершено, это не обязательно конец пути созревания белка. Свернутый белок все еще может подвергаться дальнейшей обработке посредством посттрансляционных модификаций. Существует более 200 известных типов посттрансляционных модификаций, эти модификации могут изменять активность белка, способность белка взаимодействовать с другими белками и то, где белок находится внутри клетки, например, в ядре клетки или цитоплазме. [15] Благодаря посттрансляционным модификациям разнообразие белков, кодируемых геномом, расширяется на 2–3 порядка . [16]
Существует четыре основных класса посттрансляционных модификаций: [3]

Расщепление белков — это необратимая посттрансляционная модификация, осуществляемая ферментами, известными как протеазы . Эти протеазы часто являются высокоспецифичными и вызывают гидролиз ограниченного числа пептидных связей в целевом белке. Полученный укороченный белок имеет измененную полипептидную цепь с различными аминокислотами в начале и конце цепи. Эта посттрансляционная модификация часто изменяет функцию белков, белок может быть инактивирован или активирован расщеплением и может проявлять новые биологические активности. [17]

После трансляции небольшие химические группы могут быть добавлены к аминокислотам в структуре зрелого белка. [18] Примерами процессов, которые добавляют химические группы к целевому белку, являются метилирование, ацетилирование и фосфорилирование .
Метилирование — это обратимое добавление метильной группы к аминокислоте, катализируемое ферментами метилтрансферазами . Метилирование происходит по крайней мере с 9 из 20 распространенных аминокислот, однако в основном это происходит с аминокислотами лизином и аргинином . Одним из примеров белка, который обычно метилируется, является гистон . Гистоны — это белки, обнаруженные в ядре клетки. ДНК плотно обмотана вокруг гистонов и удерживается на месте другими белками и взаимодействиями между отрицательными зарядами в ДНК и положительными зарядами на гистоне. Высокоспецифичный паттерн метилирования аминокислот на гистоновых белках используется для определения того, какие области ДНК плотно скручены и не могут транскрибироваться, а какие области слабо скручены и могут транскрибироваться. [19]
Гистоновая регуляция транскрипции ДНК также модифицируется ацетилированием. Ацетилирование — это обратимое ковалентное присоединение ацетильной группы к аминокислоте лизина ферментом ацетилтрансферазой . Ацетильная группа удаляется из донорной молекулы, известной как ацетилкофермент А, и переносится на целевой белок. [20] Гистоны подвергаются ацетилированию по остаткам лизина ферментами, известными как гистонацетилтрансфераза . Эффект ацетилирования заключается в ослаблении зарядовых взаимодействий между гистоном и ДНК, тем самым делая больше генов в ДНК доступными для транскрипции. [21]
Последняя, распространенная посттрансляционная химическая групповая модификация — фосфорилирование. Фосфорилирование — это обратимое ковалентное присоединение фосфатной группы к определенным аминокислотам ( серину , треонину и тирозину ) в белке. Фосфатная группа удаляется из донорной молекулы АТФ протеинкиназой и переносится на гидроксильную группу целевой аминокислоты, в результате чего в качестве побочного продукта образуется аденозиндифосфат . Этот процесс можно обратить вспять, и фосфатная группа удаляется ферментом протеинфосфатазой . Фосфорилирование может создать сайт связывания на фосфорилированном белке, что позволяет ему взаимодействовать с другими белками и генерировать большие многобелковые комплексы. В качестве альтернативы фосфорилирование может изменить уровень активности белка, изменяя способность белка связывать свой субстрат. [1]

Посттрансляционные модификации могут включать более сложные, большие молекулы в сложенную структуру белка. Одним из распространенных примеров этого является гликозилирование , добавление молекулы полисахарида, которое широко считается наиболее распространенной посттрансляционной модификацией. [16]
При гликозилировании молекула полисахарида (известная как гликан ) ковалентно добавляется к целевому белку ферментами гликозилтрансферазами и модифицируется гликозидазами в эндоплазматическом ретикулуме и аппарате Гольджи . Гликозилирование может играть решающую роль в определении окончательной, свернутой трехмерной структуры целевого белка. В некоторых случаях гликозилирование необходимо для правильного сворачивания. N-связанное гликозилирование способствует сворачиванию белка за счет увеличения растворимости и опосредует связывание белка с шаперонами белка . Шапероны — это белки, отвечающие за сворачивание и поддержание структуры других белков. [1]
В целом существует два типа гликозилирования: N-связанное гликозилирование и O-связанное гликозилирование . N-связанное гликозилирование начинается в эндоплазматическом ретикулуме с добавлением предшественника гликана. Предшественник гликана модифицируется в аппарате Гольджи для получения сложного гликана, ковалентно связанного с азотом в аминокислоте аспарагина . Напротив, O-связанное гликозилирование представляет собой последовательное ковалентное добавление отдельных сахаров к кислороду в аминокислотах серине и треонине в зрелой структуре белка. [1]

Многие белки, вырабатываемые внутри клетки, секретируются за ее пределы, чтобы функционировать как внеклеточные белки. Внеклеточные белки подвергаются воздействию самых разных условий. Для стабилизации трехмерной структуры белка ковалентные связи образуются либо внутри белка, либо между различными полипептидными цепями в четвертичной структуре. Наиболее распространенным типом является дисульфидная связь (также известная как дисульфидный мостик). Дисульфидная связь образуется между двумя аминокислотами цистеина с использованием их химических групп боковой цепи, содержащих атом серы, эти химические группы известны как тиоловые функциональные группы. Дисульфидные связи действуют для стабилизации уже существующей структуры белка. Дисульфидные связи образуются в реакции окисления между двумя тиоловыми группами и, следовательно, нуждаются в окислительной среде для реакции. В результате дисульфидные связи обычно образуются в окислительной среде эндоплазматического ретикулума, катализируемой ферментами, называемыми протеиндисульфидизомеразами. Дисульфидные связи редко образуются в цитоплазме, поскольку это восстановительная среда. [1]
Многие заболевания вызваны мутациями в генах из-за прямой связи между последовательностью нуклеотидов ДНК и последовательностью аминокислот кодируемого белка. Изменения в первичной структуре белка могут привести к неправильному сворачиванию белка или его неправильной работе. Мутации в пределах одного гена были идентифицированы как причина множества заболеваний, включая серповидноклеточную анемию , известную как моногенные нарушения.

Серповидноклеточная анемия — это группа заболеваний, вызванных мутацией в субъединице гемоглобина, белка, обнаруженного в эритроцитах, ответственного за транспортировку кислорода. Наиболее опасное из серповидноклеточных заболеваний известно как серповидноклеточная анемия. Серповидноклеточная анемия — это наиболее распространенное гомозиготное рецессивное заболевание одного гена , то есть пораженный человек должен нести мутацию в обеих копиях пораженного гена (по одной унаследованной от каждого родителя), чтобы испытать заболевание. Гемоглобин имеет сложную четвертичную структуру и состоит из четырех полипептидных субъединиц — двух субъединиц A и двух субъединиц B. [22] У пациентов с серповидноклеточной анемией есть миссенс-мутация или замена в гене, кодирующем полипептидную цепь субъединицы B гемоглобина. Миссенс-мутация означает, что нуклеотидная мутация изменяет общий триплет кодона таким образом, что с новым кодоном соединяется другая аминокислота. В случае серповидноклеточной анемии наиболее распространенной миссенс-мутацией является мутация одного нуклеотида с тимина на аденин в гене субъединицы гемоглобина B. [23] Это изменяет кодон 6 с кодирования аминокислоты глутаминовой кислоты на кодирование валина. [22]
Это изменение в первичной структуре полипептидной цепи субъединицы гемоглобина B изменяет функциональность комплекса из нескольких субъединиц гемоглобина в условиях низкого содержания кислорода. Когда эритроциты отдают кислород тканям организма, мутировавший белок гемоглобина начинает слипаться, образуя полутвердую структуру внутри эритроцита. Это искажает форму эритроцита, что приводит к характерной форме «серпа», и снижает гибкость клетки. Этот жесткий, искаженный эритроцит может накапливаться в кровеносных сосудах, создавая закупорку. Закупорка препятствует притоку крови к тканям и может привести к отмиранию тканей , что вызывает сильную боль у человека. [24]
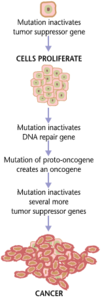
Раковые заболевания образуются в результате мутаций генов, а также неправильной трансляции белков. Помимо того, что раковые клетки ненормально пролиферируют, они подавляют экспрессию антиапоптотических или проапоптотических генов или белков. Большинство раковых клеток обнаруживают мутацию в сигнальном белке Ras, который функционирует как передатчик сигнала включения/выключения в клетках. В раковых клетках белок RAS становится постоянно активным, тем самым способствуя пролиферации клетки из-за отсутствия какой-либо регуляции. [25] Кроме того, большинство раковых клеток несут две мутантные копии гена-регулятора p53, который действует как привратник для поврежденных генов и инициирует апоптоз в злокачественных клетках. При его отсутствии клетка не может инициировать апоптоз или подавать сигнал другим клеткам уничтожить ее. [26]
По мере того, как опухолевые клетки размножаются, они либо остаются ограниченными одной областью и называются доброкачественными, либо становятся злокачественными клетками, которые мигрируют в другие области тела. Часто эти злокачественные клетки выделяют протеазы, которые разрушают внеклеточный матрикс тканей. Это затем позволяет раку войти в свою терминальную стадию, называемую метастазированием, на которой клетки попадают в кровоток или лимфатическую систему, чтобы переместиться в новую часть тела. [25]
{{cite book}}: CS1 maint: местоположение ( ссылка )