В биохимии флавинадениндинуклеотид ( ФАД ) является окислительно -восстановительным коферментом , связанным с различными белками , который участвует в нескольких ферментативных реакциях в метаболизме . Флавопротеин — это белок, содержащий флавиновую группу , которая может быть в форме ФАД или флавинмононуклеотида (ФМН). Известно много флавопротеинов: компоненты комплекса сукцинатдегидрогеназы, α-кетоглутаратдегидрогеназы и компонент комплекса пируватдегидрогеназы .
FAD может существовать в четырех окислительно-восстановительных состояниях, которые являются флавин-N(5)-оксидом , хиноном , семихиноном и гидрохиноном . [1] FAD преобразуется между этими состояниями, принимая или отдавая электроны. FAD, в своей полностью окисленной форме, или форме хинона , принимает два электрона и два протона, становясь FADH 2 (формой гидрохинона). Семихинон (FADH · ) может быть образован либо восстановлением FAD, либо окислением FADH 2 путем принятия или отдачи одного электрона и одного протона соответственно. Некоторые белки, однако, генерируют и поддерживают сверхокисленную форму кофактора флавина, флавин-N(5)-оксида. [2] [3]
Флавопротеины были впервые обнаружены в 1879 году путем разделения компонентов коровьего молока. Первоначально они были названы лактохромом из-за их молочного происхождения и желтого пигмента . [4] Научному сообществу потребовалось 50 лет, чтобы добиться существенного прогресса в идентификации молекул, ответственных за желтый пигмент. 1930-е годы положили начало исследованию коферментов с публикацией многих структур производных флавина и никотинамида и их обязательных ролей в окислительно-восстановительном катализе. Немецкие ученые Отто Варбург и Вальтер Кристиан открыли желтый белок, полученный из дрожжей, необходимый для клеточного дыхания, в 1932 году. Их коллега Хуго Теорелл разделил этот желтый фермент на апофермент и желтый пигмент и показал, что ни фермент, ни пигмент не способны окислять НАДН сами по себе, но их смешивание восстанавливает активность. В 1937 году Теорелл подтвердил, что пигмент представляет собой фосфатный эфир рибофлавина, флавинмононуклеотид ( ФМН), что стало первым прямым доказательством наличия кофакторов ферментов . [5] Затем Варбург и Кристиан в ходе аналогичных экспериментов в 1938 году обнаружили, что ФАД является кофактором оксидазы D-аминокислот . [6] Работа Варбурга по связыванию никотинамида с переносом гидрида и открытие флавинов проложили путь для многих ученых в 40-х и 50-х годах к открытию большого количества окислительно-восстановительной биохимии и связыванию их вместе в таких путях, как цикл лимонной кислоты и синтез АТФ .
Флавин адениндинуклеотид состоит из двух частей: адениннуклеотида ( аденозинмонофосфата ) и флавинмононуклеотида ( ФМН ), соединенных вместе через их фосфатные группы. Аденин связан с циклической рибозой на 1'- углероде, в то время как фосфат связан с рибозой на 5'- углероде, образуя адениннуклеотид. Рибофлавин образован связью углерод-азот (CN) между изоаллоксазином и рибитом . Затем фосфатная группа связывается с конечным углеродом рибозы, образуя ФМН. Поскольку связь между изоаллоксазином и рибитом не считается гликозидной связью , флавинмононуклеотид на самом деле не является нуклеотидом. [7] Это делает название динуклеотида вводящим в заблуждение; однако группа флавинмононуклеотида все еще очень близка к нуклеотиду по своей структуре и химическим свойствам.

FAD может быть восстановлен до FADH 2 путем добавления 2 H + и 2 e − . FADH 2 также может быть окислен путем потери 1 H + и 1 e − с образованием FADH. Форма FAD может быть воссоздана путем дальнейшей потери 1 H + и 1 e − . Образование FAD также может происходить путем восстановления и дегидратации флавин-N(5)-оксида. [8] В зависимости от степени окисления флавины принимают определенные цвета в водном растворе . флавин-N(5)-оксид (суперокисленный) имеет желто-оранжевый цвет, FAD (полностью окисленный) имеет желтый цвет, FADH (полувосстановленный) имеет синий или красный цвет в зависимости от pH , а полностью восстановленная форма бесцветна. [9] [10] Изменение формы может иметь большое влияние на другие химические свойства. Например, FAD, полностью окисленная форма, подвержена нуклеофильной атаке , полностью восстановленная форма, FADH 2, имеет высокую поляризуемость , в то время как полувосстановленная форма нестабильна в водном растворе. [11] FAD представляет собой ароматическую кольцевую систему, тогда как FADH 2 таковой не является. [12] Это означает, что FADH 2 имеет значительно более высокую энергию без стабилизации посредством резонанса , которую обеспечивает ароматическая структура. FADH 2 является молекулой, несущей энергию, поскольку после окисления она восстанавливает ароматичность и высвобождает энергию, представленную этой стабилизацией.
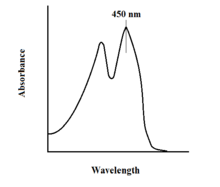
Спектроскопические свойства FAD и его вариантов позволяют осуществлять мониторинг реакции с помощью спектроскопии поглощения UV-VIS и флуоресценции . Каждая форма FAD имеет различные спектры поглощения, что позволяет легко наблюдать изменения в состоянии окисления. [11] Основной локальный максимум поглощения для FAD наблюдается при 450 нм с коэффициентом экстинкции 11 300 М −1 см −1 . [13] Флавины в целом обладают флуоресцентной активностью в несвязанном состоянии (белки, связанные с производными флавиновой нуклеиновой кислоты, называются флавопротеинами ). Это свойство можно использовать при изучении связывания белков, наблюдая потерю флуоресцентной активности при переводе в связанное состояние. [11] Окисленные флавины имеют высокую поглощательную способность около 450 нм и флуоресцируют при около 515-520 нм. [9]
В биологических системах FAD действует как акцептор H + и e − в своей полностью окисленной форме, акцептор или донор в форме FADH и донор в восстановленной форме FADH 2. На диаграмме ниже обобщены потенциальные изменения, которые он может претерпевать.
Наряду с тем, что показано выше, могут образовываться и потребляться другие реактивные формы FAD. Эти реакции включают перенос электронов и создание/разрыв химических связей . Через механизмы реакции FAD может вносить вклад в химическую активность в биологических системах. На следующих рисунках показаны общие формы некоторых действий, в которых может участвовать FAD.
Механизмы 1 и 2 представляют собой гидридное присоединение, в котором молекула приобретает то, что составляет один гидридный ион. Механизмы 3 и 4 образование радикалов и потеря гидрида. Радикальные виды содержат неспаренные электронные атомы и очень химически активны. Потеря гидрида является обратным процессом гидридного присоединения, рассмотренного ранее. Последние два механизма показывают нуклеофильное присоединение и реакцию с использованием углеродного радикала.
FAD играет важную роль в качестве кофактора фермента наряду с флавинмононуклеотидом , другой молекулой, происходящей от рибофлавина. [8] Бактерии, грибы и растения могут вырабатывать рибофлавин , но другие эукариоты , такие как люди, утратили способность вырабатывать его. [9] Поэтому люди должны получать рибофлавин, также известный как витамин B2, из пищевых источников. [14] Рибофлавин обычно попадает в тонкий кишечник, а затем транспортируется в клетки с помощью белков-переносчиков. [9] Рибофлавинкиназа (EC 2.7.1.26) добавляет фосфатную группу к рибофлавину для получения флавинмононуклеотида, а затем FADсинтетаза присоединяет адениннуклеотид ; оба этапа требуют АТФ . [9] Бактерии обычно имеют один бифункциональный фермент, но археи и эукариоты обычно используют два различных фермента. [9] Текущие исследования показывают, что в цитозоле и митохондриях существуют различные изоформы . [9] Кажется, что FAD синтезируется в обоих местах и потенциально транспортируется туда, где это необходимо. [11]
Флавопротеины используют уникальную и универсальную структуру флавиновых фрагментов для катализа сложных окислительно-восстановительных реакций. Поскольку флавины имеют несколько окислительно-восстановительных состояний, они могут участвовать в процессах, которые включают перенос одного или двух электронов, атомов водорода или ионов гидроксония . N5 и C4a полностью окисленного флавинового кольца также подвержены нуклеофильной атаке . [15] Это широкое разнообразие ионизации и модификации флавинового фрагмента можно отнести к системе изоаллоксазинового кольца и способности флавопротеинов резко нарушать кинетические параметры флавинов при связывании, включая флавинадениндинуклеотид (ФАД).
Количество генов, кодируемых флавин-зависимыми белками в геноме (флавопротеоме), зависит от вида и может варьироваться от 0,1% до 3,5%, при этом у людей имеется 90 генов, кодируемых флавопротеинами. [16] FAD является более сложной и распространенной формой флавина и, как сообщается, связывается с 75% всего флавопротеома [16] и 84% кодируемых человеком флавопротеинов. [17] Клеточные концентрации свободных или нековалентно связанных флавинов в различных культивируемых клеточных линиях млекопитающих были зарегистрированы для FAD (2,2-17,0 амоль/клетку) и FMN (0,46-3,4 амоль/клетку). [18]
FAD имеет более положительный восстановительный потенциал , чем NAD+ , и является очень сильным окислителем. Клетка использует это во многих энергетически сложных реакциях окисления, таких как дегидрирование связи CC в алкен . FAD-зависимые белки функционируют в большом количестве метаболических путей, включая транспорт электронов, репарацию ДНК, биосинтез нуклеотидов, бета-окисление жирных кислот, катаболизм аминокислот, а также синтез других кофакторов, таких как CoA , CoQ и гемовые группы. Одна хорошо известная реакция является частью цикла лимонной кислоты (также известного как цикл TCA или цикл Кребса); сукцинатдегидрогеназа (комплекс II в цепи переноса электронов ) требует ковалентно связанного FAD для катализа окисления сукцината в фумарат путем сопряжения его с восстановлением убихинона в убихинол . [11] Высокоэнергетические электроны от этого окисления временно сохраняются путем восстановления FAD до FADH 2 . Затем FADH 2 возвращается в FAD, отправляя два своих высокоэнергетических электрона через цепь переноса электронов; энергии в FADH 2 достаточно для получения 1,5 эквивалентов АТФ [19] путем окислительного фосфорилирования . Некоторые редокс-флавопротеины нековалентно связываются с FAD, например, ацетил-КоА-дегидрогеназы , которые участвуют в бета-окислении жирных кислот и катаболизме аминокислот, таких как лейцин ( изовалерил-КоА-дегидрогеназа ), изолейцин (короткоцепочечная ацил-КоА-дегидрогеназа), валин (изобутирил-КоА-дегидрогеназа) и лизин ( глутарил-КоА-дегидрогеназа ). [20] Дополнительными примерами FAD-зависимых ферментов, которые регулируют метаболизм, являются глицерол-3-фосфатдегидрогеназа (синтез триглицеридов) и ксантиноксидаза, участвующие в катаболизме пуриновых нуклеотидов. [21] Некаталитические функции, которые FAD может играть во флавопротеинах, включают структурные роли или участие в чувствительных к синему свету фоторецепторах , которые регулируют биологические часы и развитие, генерацию света у биолюминесцентных бактерий. [20]
Флавопротеины имеют либо молекулу FMN , либо FAD в качестве простетической группы, эта простетическая группа может быть прочно связана или ковалентно связана. Только около 5-10% флавопротеинов имеют ковалентно связанную FAD, но эти ферменты обладают более сильной окислительно-восстановительной способностью. [11] В некоторых случаях FAD может обеспечивать структурную поддержку для активных участков или обеспечивать стабилизацию промежуточных продуктов во время катализа. [20] На основании имеющихся структурных данных известные сайты связывания FAD можно разделить на более чем 200 типов. [22]
90 флавопротеинов закодированы в геноме человека; около 84% требуют FAD, и около 16% требуют FMN, в то время как 5 белков требуют присутствия обоих. [17] Флавопротеины в основном расположены в митохондриях из-за их окислительно-восстановительной способности. [17] Из всех флавопротеинов 90% выполняют окислительно-восстановительные реакции, а остальные 10% являются трансферазами , лиазами , изомеразами , лигазами . [16]
Моноаминоксидаза (МАО) является широко изученным флавоферментом из-за его биологической важности в катаболизме норадреналина , серотонина и дофамина . МАО окисляет первичные, вторичные и третичные амины, которые неферментативно гидролизуются из имина в альдегид или кетон . Несмотря на то, что этот класс ферментов был широко изучен, механизм его действия все еще обсуждается. Было предложено два механизма: радикальный механизм и нуклеофильный механизм. Радикальный механизм менее общепринят, поскольку не существует спектральных или электронных парамагнитных резонансных доказательств присутствия радикального промежуточного соединения. Нуклеофильный механизм более предпочтителен, поскольку он поддерживается исследованиями направленного мутагенеза , в которых мутировали два остатка тирозина, которые, как ожидалось, увеличивают нуклеофильность субстратов. [23]
Глюкозооксидаза (GOX) катализирует окисление β-D-глюкозы до D-глюконо-δ-лактона с одновременным восстановлением связанного с ферментом флавина. GOX существует в виде гомодимера, где каждая субъединица связывает одну молекулу FAD. Кристаллические структуры показывают, что FAD связывается в глубоком кармане фермента вблизи интерфейса димера. Исследования показали, что при замене FAD на 8-гидрокси-5-карба-5-деаза FAD стереохимия реакции определялась реакцией с ре -поверхностью флавина. Во время оборота наблюдаются нейтральные и анионные семихиноны, что указывает на радикальный механизм. [23]
Пренилцистеинлиаза (PCLase) катализирует расщепление пренилцистеина (модификации белка) с образованием изопреноидного альдегида и освобожденного остатка цистеина на целевом белке. FAD нековалентно связан с PCLase. Было проведено не так много механистических исследований, изучающих реакции флавина, но предлагаемый механизм показан ниже. Предполагается перенос гидрида от C1 пренильной части к FAD, что приводит к восстановлению флавина до FADH 2 . COformED — это карбокатион , стабилизированный соседним атомом серы. Затем FADH 2 реагирует с молекулярным кислородом, восстанавливая окисленный фермент. [23]
UDP-N-ацетиленолпирувилглюкозаминредуктаза (MurB) — это фермент, который катализирует НАДФН -зависимое восстановление энолпирувил-УДФ-N-ацетилглюкозамина (субстрата) до соответствующего D-лактильного соединения УДФ-N-ацетилмурамовой кислоты (продукта). MurB — это мономер, содержащий одну молекулу ФАД. Перед тем как субстрат может быть преобразован в продукт, НАДФН должен сначала восстановить ФАД. После того, как НАДФ + диссоциирует, субстрат может связываться, а восстановленный флавин может восстановить продукт. [23]
Глутатионредуктаза (GR) катализирует восстановление дисульфида глутатиона (GSSG) до глутатиона (GSH). GR требует FAD и NADPH для облегчения этой реакции; сначала гидрид должен быть перенесен из NADPH в FAD. Восстановленный флавин затем может действовать как нуклеофил для атаки дисульфида, это образует аддукт C4a-цистеина. Устранение этого аддукта приводит к образованию комплекса переноса заряда флавин-тиолят. [23]
Ферменты типа цитохрома P450 , катализирующие реакции монооксигеназы (гидроксилирования), зависят от переноса двух электронов от FAD к P450. У эукариот обнаружено два типа систем P450. Системы P450, расположенные в эндоплазматическом ретикулуме, зависят от редуктазы цитохрома P-450 (CPR), которая содержит как FAD, так и FMN . Два электрона на восстановленном FAD (FADH 2 ) переносятся по одному на FMN, а затем один электрон передается от FMN к гему P450. [24]
Системы P450, расположенные в митохондриях, зависят от двух белков переноса электронов: FAD, содержащего адренодоксинредуктазу (AR), и небольшой железо-серной группы, содержащей белок, называемый адренодоксином . FAD встроен в FAD-связывающий домен AR. [25] [26] FAD AR восстанавливается до FADH 2 путем переноса двух электронов от NADPH, который связывается в NADP-связывающем домене AR. Структура этого фермента высококонсервативна, чтобы поддерживать точное выравнивание донора электронов NADPH и акцептора FAD для эффективного переноса электронов. [26] Два электрона в восстановленном FAD переносятся по одному на адренодоксин, который, в свою очередь, отдает один электрон гемовой группе митохондриального P450. [27]
Структуры редуктазы микросомальной и редуктазы митохондриальной систем P450 совершенно различны и не показывают никакой гомологии. [24]
p -Гидроксибензоатгидроксилаза (PHBH) катализирует оксигенацию p -гидроксибензоата ( p OHB) до 3,4-дигидроксибензоата (3,4-diOHB); для этой реакции требуются FAD, NADPH и молекулярный кислород. NADPH сначала переносит гидридный эквивалент в FAD, создавая FADH − , а затем NADP + диссоциирует от фермента. Затем восстановленный PHBH реагирует с молекулярным кислородом, образуя флавин-C(4a)-гидропероксид. Гидропероксид флавина быстро гидроксилирует p OHB, а затем устраняет воду, чтобы регенерировать окисленный флавин. [23] Альтернативный механизм оксигенации, опосредованный флавином, включает использование флавин-N(5)-оксида , а не флавин-C(4a)-(гидро)пероксида. [2] [3]
Хоризматсинтаза (CS) катализирует последний шаг в шикиматном пути — образование хоризмата. Известны два класса CS, оба из которых требуют FMN , но разделены по потребности в NADPH в качестве восстанавливающего агента. Предложенный механизм для CS включает радикальные виды. Радикальные виды флавина не были обнаружены спектроскопически без использования аналога субстрата, что предполагает, что они являются короткоживущими. Однако при использовании фторированного субстрата был обнаружен нейтральный флавиновый семихинон. [23]
Глутаматсинтаза катализирует превращение 2-оксоглутарата в L-глутамат, при этом L-глутамин служит источником азота для реакции. Все синтезы глутамата являются железо-серными флавопротеинами, содержащими железо-серный кластер и ФМН. Три класса синтезов глутамата классифицируются на основе их последовательностей и биохимических свойств. Несмотря на то, что существует три класса этого фермента, считается, что все они работают по одному и тому же механизму, отличаясь только тем, что первым восстанавливает ФМН. Фермент производит две молекулы глутамата: одну путем гидролиза глутамина (образуя глутамат и аммиак), а вторую - аммиаком, полученным в результате первой реакции, атакующей 2-оксоглутарат, который восстанавливается ФМН до глутамата. [23]
Из-за важности флавопротеинов неудивительно, что приблизительно 60% человеческих флавопротеинов вызывают заболевания человека при мутации. [17] В некоторых случаях это происходит из-за сниженного сродства к FAD или FMN, и поэтому избыточное потребление рибофлавина может уменьшить симптомы заболевания, например, при множественном дефиците ацил-КоА-дегидрогеназы . [9] Кроме того, сам дефицит рибофлавина (и вызванный им недостаток FAD и FMN) может вызывать проблемы со здоровьем. [9] Например, у пациентов с БАС наблюдается снижение уровня синтеза FAD. [9] Оба эти пути могут приводить к различным симптомам, включая аномалии развития или желудочно-кишечные аномалии, неправильное расщепление жиров , анемию , неврологические проблемы, рак или болезни сердца , мигрень , ухудшение зрения и поражения кожи. [9] Поэтому фармацевтическая промышленность производит рибофлавин в качестве дополнения к рациону в определенных случаях. В 2008 году мировая потребность в рибофлавине составляла 6000 тонн в год, а производственная мощность — 10 000 тонн. [4] Этот рынок стоимостью от 150 до 500 миллионов долларов США предназначен не только для медицинских целей, но и используется в качестве добавки к корму для животных в сельскохозяйственной промышленности и в качестве пищевого красителя . [4]
Новый дизайн антибактериальных препаратов продолжает иметь важное значение в научных исследованиях, поскольку бактериальная устойчивость к обычным антибиотикам растет. Конкретный метаболический белок, который использует FAD ( комплекс II ), жизненно важен для бактериальной вирулентности, и поэтому нацеливание на синтез FAD или создание аналогов FAD может быть полезной областью исследования. [28] Ученые уже определили две структуры, которые FAD обычно принимает после связывания: либо расширенную, либо конформацию бабочки, в которой молекула по существу складывается пополам, что приводит к укладке адениновых и изоаллоксазиновых колец. [14] Имитаторы FAD, которые способны связываться аналогичным образом, но не допускают функцию белка, могут быть полезными механизмами ингибирования бактериальной инфекции. [14] Альтернативно, препараты, блокирующие синтез FAD, могут достичь той же цели; это особенно интригует, поскольку человеческий и бактериальный синтез FAD основаны на совершенно разных ферментах, а это означает, что препарат, созданный для нацеливания на бактериальную FAD-синтазу, вряд ли будет мешать ферментам человеческой FAD-синтазы. [29]
Оптогенетика позволяет контролировать биологические события неинвазивным способом. [30] В последние годы эта область продвинулась вперед с появлением ряда новых инструментов, включая те, которые запускают чувствительность к свету, такие как домены FAD, использующие синий свет (BLUF). BLUF кодируют последовательность из 100–140 аминокислот , которая была получена из фоторецепторов растений и бактерий. [30] Подобно другим фоторецепторам , свет вызывает структурные изменения в домене BLUF, что приводит к нарушению нисходящих взаимодействий. [30] Текущие исследования изучают белки с присоединенным доменом BLUF и то, как различные внешние факторы могут влиять на белки. [30]
В организме есть ряд молекул, которые обладают собственной флуоресценцией , включая триптофан, коллаген , FAD, NADH и порфирины . [31] Ученые воспользовались этим, используя их для мониторинга прогрессирования заболевания или эффективности лечения или для помощи в диагностике. Например, собственная флуоресценция FAD и NADH различается в нормальной ткани и оральном подслизистом фиброзе , что является ранним признаком инвазивного рака полости рта . [31] Поэтому врачи используют флуоресценцию для помощи в диагностике и мониторинге лечения в отличие от стандартной биопсии . [31]