Сперматозоид ( / s p ər ˌ m æ t ə ˈ z oʊ . ən , ˌ s p ɜːr m ə t ə - / ; [1] также пишется spermatozoön ; мн. ч .: сперматозоиды ; от древнегреческого σπέρμα ( spérma ) «семя» и ζῷον ( zôion ) «животное») — подвижная сперматозоидная клетка , вырабатываемая самцами животных посредством внутреннего оплодотворения. Сперматозоид — это подвижная форма гаплоидной клетки , которая является мужской гаметой , которая соединяется с яйцеклеткой , образуя зиготу . (Зигота — это отдельная клетка с полным набором хромосом , которая обычно развивается в эмбрион .)
Сперматозоиды вносят примерно половину ядерной генетической информации в диплоидное потомство (исключая, в большинстве случаев, митохондриальную ДНК ). У млекопитающих пол потомства определяется сперматозоидом: сперматозоид, несущий X-хромосому , приведет к женскому (XX) потомству, в то время как сперматозоид, несущий Y-хромосому, приведет к мужскому (XY) потомству. Сперматозоиды были впервые обнаружены в лаборатории Антони ван Левенгука в 1677 году. [2]
Человеческая сперматозоидная клетка является репродуктивной клеткой у мужчин и выживает только в теплой среде; как только она покидает тело мужчины, вероятность выживания сперматозоида снижается, и он может погибнуть, тем самым снижая общее качество спермы . Сперматозоиды бывают двух типов: «женские» и «мужские». Сперматозоиды, которые дают начало женскому (XX) потомству после оплодотворения, отличаются тем, что несут X-хромосому, в то время как сперматозоиды, которые дают начало мужскому (XY) потомству, несут Y-хромосому. [3]
Человеческая сперматозоид состоит из плоской головки в форме диска размером 5,1 мкм на 3,1 мкм и хвоста, известного как жгутик, длиной 50 мкм. [4] Жгутик движет сперматозоид (со скоростью около 1–3 мм/мин у людей), взбивая его в эллиптическом конусе. [5] Сперматозоиды имеют обонятельный механизм наведения и после достижения фаллопиевых труб должны пройти период капацитации перед проникновением в яйцеклетку. [6]
Головка: имеет компактное ядро, содержащее только хроматическую субстанцию, и окружена лишь тонким ободом цитоплазмы. Над ядром расположена колпачковая структура, называемая акросомой , образованная путем модификации тельца Гольджи, которая секретирует фермент спермлизин ( гиалуронидазу, коронопроникающий фермент, лизин зоны или акрозин ), необходимый для оплодотворения. Когда сперматозоид приближается к яйцеклетке, он подвергается акросомной реакции , в которой мембрана, окружающая акросому, сливается с плазматической мембраной головки сперматозоида, обнажая содержимое акросомы. [7]
Шейка: Это самая маленькая часть (.03 мкм), имеющая проксимальную центриоль, параллельную основанию ядра, и дистальную центриоль, перпендикулярную предыдущей. Проксимальная центриоль присутствует также в зрелом сперматозоиде; дистальная центриоль исчезает после сборки аксонемы. Проксимальная центриоль входит в яйцеклетку во время оплодотворения и начинает первое деление дробления яйцеклетки, в котором нет центриоли. Дистальная центриоль дает начало осевой нити, которая образует хвост и имеет расположение (9+2). Переходная мембрана, называемая манжеткой, лежит в средней части.
Средняя часть: имеет 10–14 спиралей митохондрий, окружающих осевую нить в цитоплазме. Она обеспечивает подвижность, и поэтому называется электростанцией сперматозоида. Она также имеет кольцевую центриоль (кольцо), которая образует диффузионный барьер между средней частью и основной частью и служит стабилизирующей структурой для жесткости хвоста. [8]
Хвост: Жгутик — самая длинная часть (50 мкм), имеющая осевую нить, окруженную цитоплазмой и плазматической мембраной, но на заднем конце осевая нить голая. Жгутик обеспечивает движение клетки.
Сперма имеет щелочную природу, и сперматозоиды не достигают полной подвижности (гиперподвижности), пока не попадут во влагалище , где щелочной pH нейтрализуется кислыми вагинальными жидкостями. Этот постепенный процесс занимает 20–30 минут. В течение этого периода фибриноген из семенных пузырьков образует сгусток, закрепляющий и защищающий сперматозоиды. Как только они становятся гиперподвижными, фибринолизин из предстательной железы растворяет сгусток, позволяя сперматозоидам оптимально продвигаться.
Сперматозоид характеризуется минимумом цитоплазмы и наиболее плотно упакованной ДНК, известной среди эукариот . По сравнению с митотическими хромосомами в соматических клетках , ДНК сперматозоида по крайней мере в шесть раз более конденсирована. [9]
Образец вносит вклад в виде ДНК / хроматина , центриоли и, возможно, также фактора активации ооцитов (OAF). [10] Он также может вносить вклад в виде отцовской информационной РНК (мРНК), также внося вклад в эмбриональное развитие. [10]
В сперматозоиде человека содержится не менее 7500 различных белков . [11]
Генетика спермы человека связана с эволюцией человека , согласно исследованию 2020 года. [12] [13] [14]
Повреждения ДНК, присутствующие в сперматозоидах в период после мейоза , но до оплодотворения , могут быть восстановлены в оплодотворенной яйцеклетке, но если их не восстановить, они могут иметь серьезные пагубные последствия для фертильности и развивающегося эмбриона. Человеческие сперматозоиды особенно уязвимы для атаки свободных радикалов и генерации окислительного повреждения ДНК. [15] [16] (см. например, 8-оксо-2'-дезоксигуанозин )
Воздействие на мужчин определенных факторов образа жизни, окружающей среды или профессиональных опасностей может увеличить риск анеуплоидии сперматозоидов. [17] В частности, риск анеуплоидии увеличивается при курении табака, [18] [19] и профессиональном воздействии бензола, [20] инсектицидов, [21] [22] и перфторированных соединений. [23] Повышенная анеуплоидия сперматозоидов часто происходит в связи с повышенным повреждением ДНК. Фрагментация ДНК и повышенная восприимчивость ДНК in situ к денатурации, признаки, сходные с теми, которые наблюдаются при апоптозе соматических клеток, характеризуют аномальные сперматозоиды в случаях мужского бесплодия . [24] [25]
Молекулы гликопротеина на поверхности эякулированных сперматозоидов распознаются всеми женскими иммунными системами человека и интерпретируются как сигнал о том, что клетка не должна быть отвергнута. В противном случае женская иммунная система могла бы атаковать сперму в репродуктивном тракте . Специфические гликопротеины, покрывающие сперматозоиды, также используются некоторыми раковыми и бактериальными клетками, некоторыми паразитическими червями и ВИЧ-инфицированными белыми кровяными клетками, тем самым избегая иммунного ответа со стороны организма-хозяина . [26]
Гематотестикулярный барьер , поддерживаемый плотными соединениями между клетками Сертоли семенных канальцев, препятствует сообщению между формирующимися сперматозоидами в яичках и кровеносными сосудами (и иммунными клетками, циркулирующими в них) в интерстициальном пространстве . Это не позволяет им вызывать иммунный ответ. Гематотестикулярный барьер также важен для предотвращения нарушения сперматогенеза токсичными веществами. [ необходима цитата ]

У большинства животных, размножающихся половым путем, оплодотворение осуществляется с помощью сперматозоидов.
Некоторые виды плодовых мушек производят самые большие известные сперматозоиды, встречающиеся в природе. [27] [28] Drosophila melanogaster производит сперму, которая может достигать 1,8 мм, [29] в то время как ее родственник Drosophila bifurca производит самые большие известные сперматозоиды, длина которых составляет более 58 мм. [27] У Drosophila melanogaster весь сперматозоид, включая хвост, включается в цитоплазму ооцита , однако у Drosophila bifurca только небольшая часть хвоста проникает в ооцит. [30]
Лесная мышь Apodemus sylvaticus обладает сперматозоидами с серповидной морфологией. Еще одной характеристикой, которая делает эти гаметоциты уникальными, является наличие апикального крючка на головке сперматозоида. Этот крючок используется для прикрепления к крючкам или жгутикам других сперматозоидов. Агрегация вызывается этими прикреплениями, и в результате образуются подвижные поезда. Эти поезда обеспечивают улучшенную подвижность в женских половых путях и являются средством, с помощью которого осуществляется оплодотворение. [31]
Постмейотическая фаза сперматогенеза мышей очень чувствительна к генотоксичным агентам окружающей среды, поскольку по мере того, как мужские половые клетки формируют зрелые сперматозоиды, они постепенно теряют способность восстанавливать повреждения ДНК. [32] Облучение самцов мышей во время позднего сперматогенеза может вызвать повреждение, которое сохраняется в течение как минимум 7 дней в оплодотворяющих сперматозоидах, а нарушение путей восстановления двухцепочечных разрывов материнской ДНК увеличивает хромосомные аберрации, происходящие от сперматозоидов. [33] Обработка самцов мышей мелфаланом , бифункциональным алкилирующим агентом, часто используемым в химиотерапии, вызывает повреждения ДНК во время мейоза, которые могут сохраняться в невосстановленном состоянии по мере того, как половые клетки проходят через компетентные по восстановлению ДНК фазы сперматогенного развития. [34] Такие невосстановленные повреждения ДНК в сперматозоидах после оплодотворения могут привести к появлению потомства с различными аномалиями.
Морские ежи, такие как Arbacia punctulata, являются идеальными организмами для использования в исследованиях спермы. Они выбрасывают в море большое количество спермы, что делает их хорошо подходящими в качестве модельных организмов для экспериментов. [35]
Сперматозоиды сумчатых обычно длиннее, чем у плацентарных млекопитающих . [36]
Гаметофиты мохообразных , папоротников и некоторых голосеменных производят подвижные сперматозоиды , в отличие от пыльцевых зерен, используемых большинством голосеменных и всеми покрытосеменными . Это делает половое размножение в отсутствие воды невозможным, поскольку вода является необходимой средой для встречи сперматозоидов и яйцеклеток. Сперматозоиды водорослей и низших растений часто многожгутиковые (см. изображение) и, таким образом, морфологически отличаются от сперматозоидов животных. [37]
Некоторые водоросли и грибы производят неподвижные сперматозоиды, называемые сперматиями. У высших растений и некоторых водорослей и грибов оплодотворение включает миграцию ядра сперматозоида через трубку оплодотворения (например, пыльцевую трубку у высших растений) для достижения яйцеклетки. [ необходима цитата ]
Сперматозоиды производятся в семенных канальцах яичек в процессе, называемом сперматогенезом . Круглые клетки, называемые сперматогониями, делятся и дифференцируются, в конечном итоге становясь сперматозоидами. Во время копуляции клоака или влагалище оплодотворяются , а затем сперматозоиды перемещаются посредством хемотаксиса к яйцеклетке внутри яйцевода .
В вспомогательных репродуктивных технологиях нормозооспермия относится к общему объему эякуляции >39 млн , >32% с прогрессивной подвижностью и >4% нормальной морфологии. Кроме того, нормальная эякуляция у людей должна иметь объем более 1,5 мл, являясь чрезмерным объемом 6 мл на эякуляцию ( гиперспермия ). Недостаточный объем называется гипоспермией . Эти проблемы связаны с несколькими осложнениями в производстве сперматозоидов, например:
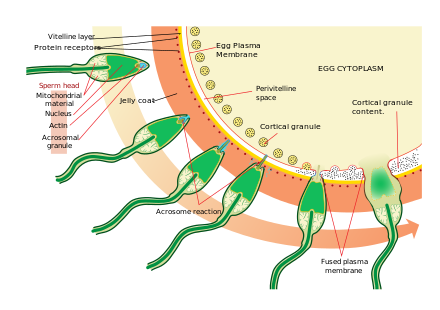
Приближение к яйцеклетке — довольно сложный, многоступенчатый процесс хемотаксиса, направляемый различными химическими веществами/стимулами на отдельных уровнях филогении. Одним из наиболее значимых, общих сигнальных признаков события является то, что прототип профессиональных рецепторов хемотаксиса, формилпептидный рецептор (60 000 рецепторов/клетку), а также активаторная способность его лиганда формил Met-Leu-Phe были продемонстрированы в поверхностной мембране даже в случае человеческих сперматозоидов. [38] Сперматозоиды млекопитающих становятся еще более активными, когда они приближаются к яйцеклетке в процессе, называемом активацией сперматозоидов . Было показано, что активация сперматозоидов вызывается кальциевыми ионофорами in vitro , прогестероном, выделяемым близлежащими клетками кумулюса , и связыванием с ZP3 zona pellucida . Кумулюсные клетки заключены в гелеобразное вещество, состоящее в основном из гиалуроновой кислоты , и развиваются в яичнике вместе с яйцеклеткой и поддерживают ее по мере ее роста.
Первоначальное изменение называется «гиперактивацией», что приводит к изменению подвижности сперматозоидов. Они плавают быстрее, а движения их хвоста становятся более сильными и беспорядочными.
Недавнее открытие связывает гиперактивацию с внезапным притоком ионов кальция в хвосты. Хлыстообразный хвост (жгутик) сперматозоида усеян ионными каналами, образованными белками, называемыми CatSper . Эти каналы являются селективными, пропуская только ионы кальция. Открытие каналов CatSper отвечает за приток кальция. Внезапное повышение уровня кальция заставляет жгутик образовывать более глубокие изгибы, сильнее продвигая сперматозоид через вязкую среду. Гиперактивность сперматозоидов необходима для преодоления двух физических барьеров, которые защищают яйцеклетку от оплодотворения.
Вторым процессом активации сперматозоидов является реакция акросомы . Она включает в себя высвобождение содержимого акросомы, которое рассеивается, и воздействие ферментов, прикрепленных к внутренней акросомальной мембране сперматозоида. Это происходит после того, как сперматозоид впервые встречается с яйцеклеткой. Этот механизм типа «замок и ключ» является видоспецифичным и предотвращает слияние сперматозоида и яйцеклетки разных видов. Есть некоторые доказательства того, что это связывание является тем, что запускает акросому для высвобождения ферментов, которые позволяют сперматозоиду слиться с яйцеклеткой.
ZP3, один из белков, входящих в состав zona pellucida, затем связывается с молекулой-партнером на сперматозоиде. Ферменты на внутренней акросомальной мембране переваривают zona pellucida. После того, как сперматозоид проникает в zona pellucida, часть клеточной мембраны сперматозоида сливается с мембраной яйцеклетки, и содержимое головки диффундирует в яйцеклетку.
После проникновения ооцит считается активированным . Он проходит вторичное мейотическое деление, и два гаплоидных ядра (отцовское и материнское) сливаются, образуя зиготу . Чтобы предотвратить полиспермию и свести к минимуму возможность образования триплоидной зиготы, несколько изменений в zona pellucida яйцеклетки делают ее непроницаемой вскоре после того, как первый сперматозоид проникает в яйцеклетку.
Сперматозоиды можно хранить в разбавителях, таких как разбавитель Illini Variable Temperature (IVT), который, как сообщается, способен сохранять высокую фертильность сперматозоидов в течение более семи дней. [ 39] Разбавитель IVT состоит из нескольких солей, сахаров и антибактериальных агентов и насыщен CO2 . [39]
Криоконсервация семени может использоваться для гораздо более длительного хранения. Для человеческих сперматозоидов самое длительное зарегистрированное успешное хранение с помощью этого метода составляет 21 год. [40]
Капацитация — это конечная фаза развития сперматозоидов, когда они приобретают способность оплодотворять ооцит. In vivo это происходит во время эякуляции, когда сперматозоиды покидают влагалище и попадают в верхний женский половой тракт. In vitro это происходит, когда сперматозоиды промываются и очищаются. Почти 30-40% бесплодия обусловлено мужским фактором, поэтому было создано несколько стратегий для восстановления функциональных сперматозоидов. Показатель MMP (миллион подвижных прогрессивных клеток на миллилитр) является синонимом капацитации и является очень полезным параметром для принятия решения, наряду со спермиограммой , о необходимом виде лечения. Он представляет собой соотношение между % прогрессивно подвижных сперматозоидов, полученных в капацитированном состоянии, и % прогрессивно подвижных сперматозоидов, полученных в эякуляте. Он основан на проценте восстановления. В зависимости от процента мы определим качество восстановления подвижных сперматозоидов: оптимальным считается количество сперматозоидов от 15 до 25 миллионов/мл, достаточным считается количество от 5 до 15 миллионов, а менее 5 миллионов считается неоптимальным или недостаточным. Относительно полученных нами значений, а также результатов спермиограммы будут отображены различные методики.
Например, если обнаружено более 1,0×106 прогрессивно подвижных сперматозоидов на миллилитр, будет рекомендовано половое сношение, а если это не поможет, следующим шагом станет внутриматочная инсеминация , а затем традиционное экстракорпоральное оплодотворение .
При концентрации менее 1,0×10 6 прогрессивно-подвижных сперматозоидов на миллилитр мы выполним интрацитоплазматическую инъекцию сперматозоида . В случае азооспермии (отсутствие сперматозоидов в эякуляте) мы проведем биопсию яичек, чтобы проверить, есть ли сперматозоиды в яичках или они не вырабатываются.