Структура жидкостей , стекол и других некристаллических твердых тел характеризуется отсутствием дальнего порядка , который определяет кристаллические материалы. Жидкости и аморфные твердые тела, однако, обладают богатым и разнообразным набором ближнего и среднего порядка, который возникает из-за химических связей и связанных с ними взаимодействий. Металлические стекла , например, обычно хорошо описываются плотной случайной упаковкой твердых сфер, тогда как ковалентные системы, такие как силикатные стекла , имеют редко упакованные, прочно связанные, тетраэдрические сетчатые структуры. Эти очень разные структуры приводят к материалам с очень разными физическими свойствами и применениями.
Изучение структуры жидкости и стекла направлено на получение информации об их поведении и физических свойствах, чтобы их можно было понять, предсказать и адаптировать для конкретных приложений. Поскольку структура и результирующее поведение жидкостей и стекол являются сложной многочастичной проблемой , исторически она была слишком вычислительно интенсивной для решения с использованием квантовой механики напрямую. Вместо этого чаще всего используются различные методы дифракции , ядерного магнитного резонанса (ЯМР), молекулярной динамики и моделирования Монте-Карло .

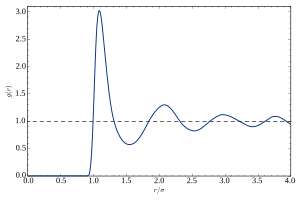
Функция парного распределения (или функция парной корреляции) материала описывает вероятность нахождения атома на расстоянии r от другого атома.
Типичный график зависимости g от r жидкости или стекла демонстрирует ряд ключевых особенностей:
Статический структурный фактор S (q) , который можно измерить с помощью дифракционных методов, связан с соответствующим ему g(r) преобразованием Фурье
где q — величина вектора переноса импульса, а ρ — числовая плотность материала. Подобно g(r) , модели S(q) жидкостей и стекол имеют ряд ключевых особенностей:
Отсутствие дальнего порядка в жидкостях и стеклах подтверждается отсутствием пиков Брэгга в рентгеновской и нейтронной дифракции . Для этих изотропных материалов дифракционная картина имеет круговую симметрию, а в радиальном направлении интенсивность дифракции имеет плавную осциллирующую форму. Эта дифрагированная интенсивность обычно анализируется для получения статического структурного фактора S (q) , где q задается как q =4πsin(θ)/λ, где 2θ — угол рассеяния (угол между падающим и рассеянным квантами), а λ — падающая длина волны зонда (фотона или нейтрона). Обычно дифракционные измерения выполняются при одном (монохроматическом) λ, а дифрагированная интенсивность измеряется в диапазоне углов 2θ, чтобы получить широкий диапазон q . В качестве альтернативы может использоваться диапазон λ, что позволяет проводить измерения интенсивности в фиксированном или узком диапазоне 2θ. В рентгеновской дифракции такие измерения обычно называются «энергетическими дисперсионными», тогда как в нейтронной дифракции это обычно называется «времяпролетными», что отражает различные используемые методы обнаружения. После получения модель S(q) может быть преобразована Фурье для получения соответствующей функции радиального распределения (или функции парной корреляции), обозначенной в этой статье как g(r) . Для изотропного материала соотношение между S(q) и соответствующей ей g(r) равно
G (r) , описывающий вероятность обнаружения атома на расстоянии r от другого атома, обеспечивает более интуитивное описание атомной структуры. Картина g(r), полученная из дифракционного измерения, представляет собой пространственное и тепловое среднее всех парных корреляций в материале, взвешенных по их когерентным сечениям с падающим пучком.
По определению, g(r) относится к среднему числу частиц, находящихся в заданном объеме оболочки, расположенной на расстоянии r от центра. Средняя плотность атомов на заданном радиальном расстоянии от другого атома определяется формулой:
где n ( r ) — среднее число атомов в оболочке шириной Δ r на расстоянии r . [1] G (r) для имитационной ячейки можно легко рассчитать, построив гистограмму разделения частиц с использованием следующего уравнения
где N a — число частиц a , | r ij | — величина разделения пары частиц i,j . Атомистическое моделирование также может использоваться в сочетании с функциями межатомного парного потенциала для расчета макроскопических термодинамических параметров, таких как внутренняя энергия, свободная энергия Гиббса, энтропия и энтальпия системы.
Изучая стекло, Захариасен начал замечать повторяющиеся свойства в стеклах. Он постулировал правила и закономерности, согласно которым, когда атомы следуют этим правилам, они, скорее всего, образуют стекла. Следующие правила составляют теорию Захариасена, применимую только к оксидным стеклам. [2]
Все эти правила обеспечивают необходимую степень гибкости для формирования стекла, а не кристалла.
Хотя эти правила применимы только к оксидным стеклам, они были первыми правилами, установившими идею непрерывной случайной сети для структуры стекла. Он также был первым, кто классифицировал структурные роли различных оксидов, некоторые из которых были основными стеклообразователями (SiO 2 , GeO 2 , P 2 O 5 ), а некоторые — модификаторами стекла (Na 2 O, CaO).
Этот критерий установил связь между прочностью химической связи и ее тенденцией к стеклообразованию. Когда материал закаливается для образования стекла, чем прочнее связи, тем легче стеклообразование. [3]
Дитцель рассматривал прямые кулоновские взаимодействия между атомами. Он классифицировал катионы, используя напряженность поля, где FS=z c /(r c +r a ) 2 , где z c — заряд катиона, а r c и r a — радиусы катиона и аниона соответственно. Катионы с высокой напряженностью поля будут иметь высокую энергию связи катион-кислород. [4]
Эти три критерия помогают установить три различных способа определения того, будут ли определенные молекулы оксидов образовывать стекла, а также вероятности этого.
Другие экспериментальные методы, часто используемые для изучения структуры стекол, включают ядерный магнитный резонанс , тонкую структуру рентгеновского поглощения и другие методы спектроскопии, включая спектроскопию Рамана . Экспериментальные измерения можно сочетать с методами компьютерного моделирования, такими как обратное Монте-Карло или моделирование молекулярной динамики , чтобы получить более полное и подробное описание атомной структуры.


Ранние теории, касающиеся структуры стекла, включали теорию кристаллитов, согласно которой стекло представляет собой совокупность кристаллитов (чрезвычайно мелких кристаллов). [6] Однако структурные определения стекловидных SiO 2 и GeO 2, проведенные Уорреном и его коллегами в 1930-х годах с использованием рентгеновской дифракции, показали, что структура стекла типична для аморфного твердого тела. [7] В 1932 году Захариасен представил теорию случайной сети стекла, в которой природа связей в стекле такая же, как и в кристалле, но где основные структурные единицы в стекле связаны случайным образом в отличие от периодического расположения в кристаллическом материале. [8] Несмотря на отсутствие дальнего порядка, структура стекла действительно демонстрирует высокую степень упорядоченности на коротких масштабах длины из-за ограничений химических связей в локальных атомных полиэдрах . [9] Например, тетраэдры SiO4 , которые образуют основные структурные единицы в кварцевом стекле, представляют собой высокую степень порядка, т.е. каждый атом кремния координируется 4 атомами кислорода, а длина связи ближайшего соседа Si-O демонстрирует лишь узкое распределение по всей структуре. [6] Тетраэдры в кремнии также образуют сеть кольцевых структур, что приводит к упорядочению на более промежуточных масштабах длины, вплоть до приблизительно 10 ангстрем .
Структура стекол отличается от структуры жидкостей чуть выше температуры стеклования T g , что выявляется с помощью рентгеновского дифракционного анализа [10] и высокоточных измерений нелинейных диэлектрических восприимчивостей третьего и пятого порядков. [11] Стекла, как правило, характеризуются более высокой степенью связности по сравнению с жидкостями. [12]
Альтернативные взгляды на структуру жидкостей и стекол включают модель интерстициальности [13] и модель струноподобного коррелированного движения. [14] Молекулярно-динамическое компьютерное моделирование показывает, что эти две модели тесно связаны [15]

Компоненты оксидного стекла можно классифицировать как сеткообразователи, промежуточные соединения или сетевые модификаторы. [16] Традиционные сеткообразователи (например, кремний, бор, германий) образуют высокосшитую сетку химических связей. Промежуточные соединения (например, титан, алюминий, цирконий, бериллий, магний, цинк) могут вести себя как сеткообразователи или сетевые модификаторы, в зависимости от состава стекла. [17] Модификаторы (кальций, свинец, литий, натрий, калий) изменяют структуру сети; они обычно присутствуют в виде ионов, компенсируемых близлежащими немостиковыми атомами кислорода, связанными одной ковалентной связью с сеткой стекла и удерживающими один отрицательный заряд для компенсации положительного иона поблизости. [18] Некоторые элементы могут играть несколько ролей; например, свинец может действовать как сеткообразователь (Pb4 + заменяет Si4 + ), так и как модификатор. [19] Присутствие немостиковых кислородов снижает относительное количество прочных связей в материале и нарушает сетку, уменьшая вязкость расплава и понижая температуру плавления. [17]
Ионы щелочных металлов малы и подвижны; их присутствие в стекле обеспечивает определенную степень электропроводности . Их подвижность снижает химическую стойкость стекла, допуская выщелачивание водой и способствуя коррозии. Щелочноземельные ионы с их двумя положительными зарядами и необходимостью двух не мостиковых ионов кислорода для компенсации их заряда сами по себе гораздо менее подвижны и препятствуют диффузии других ионов, особенно щелочных. Наиболее распространенные коммерческие типы стекла содержат как щелочные, так и щелочноземельные ионы (обычно натрий и кальций) для более легкой обработки и удовлетворения коррозионной стойкости. [20] Коррозионная стойкость стекла может быть повышена путем дещелирования , удаления щелочных ионов с поверхности стекла [21] путем реакции с соединениями серы или фтора. [22] Присутствие ионов щелочных металлов также оказывает пагубное влияние на тангенс угла потерь стекла [23] и на его электрическое сопротивление ; [24] Стекло, изготавливаемое для электроники (герметики, электронные трубки, лампы...), должно это учитывать.
Кремний (химическое соединение SiO 2 ) имеет ряд различных кристаллических форм: кварц, тридимит, кристобалит и другие (включая полиморфы высокого давления стишовит и коэсит ). Почти все они включают тетраэдрические блоки SiO 4 , связанные вместе общими вершинами в различных расположениях. Длины связей Si-O различаются между различными кристаллическими формами. Например, в α-кварце длина связи составляет 161 пм, тогда как в α-тридимите она варьируется от 154 до 171 пм. Угол связи Si–O–Si также варьируется от 140° в α-тридимите до 144° в α-кварце и 180° в β-тридимите.
В аморфном кремнеземе ( плавленом кварце ) тетраэдры SiO 4 образуют сеть, которая не демонстрирует никакого дальнего порядка. Однако сами тетраэдры представляют собой высокую степень локального упорядочения, т. е. каждый атом кремния координируется 4 атомами кислорода, а длина связи ближайшего соседа Si-O демонстрирует лишь узкое распределение по всей структуре. [6] Если рассматривать атомную сеть кремнезема как механическую ферму, эта структура является изостатической, в том смысле, что число ограничений, действующих между атомами, равно числу степеней свободы последних. Согласно теории жесткости , это позволяет этому материалу демонстрировать большую способность к формованию. [25] Несмотря на отсутствие упорядочения в расширенных масштабах длины, тетраэдры также образуют сеть кольцевых структур, которые приводят к упорядочению в промежуточных масштабах длины (примерно до 10 ангстрем или около того). [6] Под воздействием высокого давления (приблизительно 40 ГПа) кварцевое стекло претерпевает непрерывный полиаморфный фазовый переход в октаэдрическую форму, т.е. атомы Si оказываются окруженными 6 атомами кислорода вместо четырех в тетраэдрическом стекле при давлении окружающей среды. [26]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )