

Вторичная структура белка — это локальная пространственная конформация полипептидного остова , исключая боковые цепи. [1] Два наиболее распространенных вторичных структурных элемента — это альфа-спирали и бета-слои , хотя бета-повороты и омега-петли также встречаются. Элементы вторичной структуры обычно спонтанно образуются как промежуточные продукты до того, как белок свернется в свою трехмерную третичную структуру .
Вторичная структура формально определяется рисунком водородных связей между атомами водорода аминогруппы и атомами кислорода карбоксила в пептидном остове . Вторичная структура может быть альтернативно определена на основе регулярного рисунка двугранных углов остова в определенной области графика Рамачандрана независимо от того, имеет ли он правильные водородные связи.
Концепция вторичной структуры была впервые введена Каем Ульриком Линдерстрём-Лангом в Стэнфорде в 1952 году. [2] [3] Другие типы биополимеров , такие как нуклеиновые кислоты, также обладают характерными вторичными структурами .
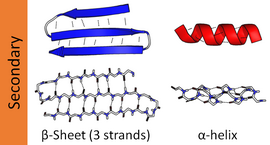

Наиболее распространенными вторичными структурами являются альфа-спирали и бета-слои . Другие спирали, такие как спираль 3 10 и π-спираль , как подсчитано, имеют энергетически выгодные модели водородных связей, но редко наблюдаются в природных белках, за исключением концов α-спиралей из-за неблагоприятной упаковки остова в центре спирали. Другие протяженные структуры, такие как полипролиновая спираль и альфа-слои, редки в белках в нативном состоянии, но часто предполагаются как важные промежуточные продукты сворачивания белка . Плотные повороты и свободные, гибкие петли связывают более «регулярные» элементы вторичной структуры. Случайная спираль не является истинной вторичной структурой, но представляет собой класс конформаций, которые указывают на отсутствие регулярной вторичной структуры.
Аминокислоты различаются по своей способности образовывать различные элементы вторичной структуры. Пролин и глицин иногда называют «разрушителями спиралей», потому что они нарушают регулярность конформации α-спиральной основы; однако оба обладают необычными конформационными способностями и обычно встречаются в поворотах . Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин , аланин , лейцин , глутамат и лизин («MALEK» в однобуквенных кодах аминокислот ); напротив, большие ароматические остатки ( триптофан , тирозин и фенилаланин ) и C β -разветвленные аминокислоты ( изолейцин , валин и треонин ) предпочитают принимать конформации β-цепи . Однако эти предпочтения недостаточно сильны, чтобы создать надежный метод прогнозирования вторичной структуры только по последовательности.
Низкочастотные коллективные колебания, как полагают, чувствительны к локальной жесткости внутри белков, показывая, что бета-структуры в целом более жесткие, чем альфа или неупорядоченные белки. [6] [7] Измерения нейтронного рассеяния напрямую связали спектральную особенность на частоте ~1 ТГц с коллективными движениями вторичной структуры бета-бочонкового белка GFP. [8]
Модели водородных связей во вторичных структурах могут быть существенно искажены, что затрудняет автоматическое определение вторичной структуры. Существует несколько методов формального определения вторичной структуры белка (например, DSSP , [9] DEFINE, [10] STRIDE , [11] ScrewFit, [12] SST [13] ).

Словарь вторичной структуры белка, сокращенно DSSP, обычно используется для описания вторичной структуры белка с помощью однобуквенных кодов. Вторичная структура определяется на основе моделей водородных связей, как было первоначально предложено Полингом и др. в 1951 году (до того, как какая-либо структура белка была экспериментально определена). Существует восемь типов вторичной структуры, которые определяет DSSP:
«Катушка» часто кодируется как « » (пробел), C (катушка) или «–» (тире). Спирали (G, H и I) и конформации листов должны иметь разумную длину. Это означает, что 2 соседних остатка в первичной структуре должны образовывать одинаковую схему водородных связей. Если схема водородных связей спирали или листа слишком короткая, они обозначаются как T или B соответственно. Существуют и другие категории назначения вторичной структуры белка (резкие повороты, петли Омега и т. д.), но они используются реже.
Вторичная структура определяется водородной связью , поэтому точное определение водородной связи имеет решающее значение. Стандартное определение водородной связи для вторичной структуры — это DSSP , которая является чисто электростатической моделью. Она присваивает заряды ± q 1 ≈ 0,42 e карбонильному углероду и кислороду соответственно, и заряды ± q 2 ≈ 0,20 e амидному водороду и азоту соответственно. Электростатическая энергия равна
Согласно DSSP, водородная связь существует тогда и только тогда, когда E меньше −0,5 ккал/моль (−2,1 кДж/моль). Хотя формула DSSP является относительно грубым приближением физической энергии водородной связи, она обычно принимается как инструмент для определения вторичной структуры.
SST — это байесовский метод назначения вторичной структуры данным координат белка с использованием информационного критерия Шеннона для вывода минимальной длины сообщения ( MML ). SST рассматривает любое назначение вторичной структуры как потенциальную гипотезу, которая пытается объяснить ( сжать ) заданные данные координат белка. Основная идея заключается в том, что лучшее назначение вторичной структуры — это то, которое может объяснить ( сжать ) координаты заданных координат белка наиболее экономичным способом, тем самым связывая вывод вторичной структуры со сжатием данных без потерь . SST точно разграничивает любую цепь белка на области, связанные со следующими типами назначения: [14]
SST обнаруживает π и 3 10 спиральные колпачки для стандартных α -спиралей и автоматически собирает различные удлиненные нити в последовательные β-складчатые листы. Он обеспечивает читаемый вывод рассеченных вторичных структурных элементов и соответствующий загружаемый скрипт PyMol для визуализации назначенных вторичных структурных элементов по отдельности.
Грубое содержание вторичной структуры биополимера (например, «этот белок на 40% состоит из α-спирали и на 20% из β-слоя ») можно оценить спектроскопически . [15] Для белков распространенным методом является дальний ультрафиолетовый (дальний УФ, 170–250 нм) круговой дихроизм . Выраженный двойной минимум при 208 и 222 нм указывает на α-спиральную структуру, тогда как одиночный минимум при 204 нм или 217 нм отражает структуру случайной спирали или β-слоя соответственно. Менее распространенным методом является инфракрасная спектроскопия , которая обнаруживает различия в колебаниях связей амидных групп из-за водородных связей. Наконец, содержание вторичной структуры можно точно оценить с помощью химических сдвигов изначально не назначенного спектра ЯМР . [16]
Предсказание третичной структуры белка только по его аминокислотной последовательности является очень сложной задачей (см. прогнозирование структуры белка ), но использование более простых определений вторичной структуры является более поддающимся решению.
Ранние методы предсказания вторичной структуры ограничивались предсказанием трех преобладающих состояний: спирали, листа или случайной спирали. Эти методы основывались на склонностях отдельных аминокислот к образованию спирали или листа, иногда в сочетании с правилами оценки свободной энергии формирования элементов вторичной структуры. Первыми широко используемыми методами предсказания вторичной структуры белка из аминокислотной последовательности были метод Чжоу-Фасмана [17] [18] [19] и метод GOR . [20] Хотя такие методы заявляли о достижении ~60% точности в предсказании того, какое из трех состояний (спираль/лист/спираль) принимает остаток, слепые вычислительные оценки позже показали, что фактическая точность была намного ниже. [21]
Значительное увеличение точности (почти до ~80%) было достигнуто за счет использования множественного выравнивания последовательностей ; знание полного распределения аминокислот, которые встречаются в позиции (и в ее окрестностях, обычно ~7 остатков с каждой стороны) на протяжении всей эволюции, дает гораздо лучшую картину структурных тенденций вблизи этой позиции. [22] [23] Для иллюстрации, данный белок может иметь глицин в данной позиции, что само по себе может предполагать случайную спираль там. Однако множественное выравнивание последовательностей может показать, что благоприятствующие спирали аминокислоты встречаются в этой позиции (и близлежащих позициях) в 95% гомологичных белков, охватывающих почти миллиард лет эволюции. Более того, исследуя среднюю гидрофобность в этой и близлежащих позициях, то же самое выравнивание может также предполагать модель доступности остатка растворителя, соответствующую α-спирали. Взятые вместе, эти факторы предполагают, что глицин исходного белка принимает α-спиральную структуру, а не случайную спираль. Для объединения всех доступных данных с целью формирования 3-х позиционного прогноза используются несколько типов методов, включая нейронные сети , скрытые марковские модели и машины опорных векторов . Современные методы прогнозирования также предоставляют оценку достоверности для своих прогнозов в каждой позиции.
Методы предсказания вторичной структуры были оценены с помощью экспериментов по критической оценке предсказания структуры белка (CASP) и постоянно проверялись, например, с помощью EVA (тест) . На основе этих тестов наиболее точными методами оказались Psipred , SAM, [24] PORTER, [25] PROF, [26] и SABLE. [27] Главной областью для улучшения, по-видимому, является предсказание β-цепей; остатки, уверенно предсказанные как β-цепь, вероятно, таковыми и являются, но методы склонны упускать некоторые сегменты β-цепи (ложноотрицательные результаты). Вероятно, существует верхний предел точности предсказания в ~90% в целом из-за особенностей стандартного метода ( DSSP ) для назначения классов вторичной структуры (спираль/цепь/клубок) структурам PDB, с которыми сравниваются предсказания. [28]
Точное предсказание вторичной структуры является ключевым элементом в предсказании третичной структуры во всех случаях, кроме самых простых ( моделирование гомологии ). Например, уверенно предсказанный шаблон из шести элементов вторичной структуры βαββαβ является сигнатурой ферредоксиновой складки. [29]
Как вторичные структуры белков, так и нуклеиновых кислот могут быть использованы для помощи в выравнивании множественных последовательностей . Эти выравнивания могут быть сделаны более точными за счет включения информации о вторичной структуре в дополнение к простой информации о последовательности. Иногда это менее полезно в РНК, поскольку спаривание оснований гораздо более консервативно, чем последовательность. Отдаленные связи между белками, первичные структуры которых не поддаются выравниванию, иногда можно обнаружить с помощью вторичной структуры. [22]
Было показано, что α-спирали более стабильны, устойчивы к мутациям и поддаются конструированию, чем β-цепи в природных белках [30] , поэтому проектирование функциональных полностью α-белков, вероятно, будет проще, чем проектирование белков как со спиралями, так и с цепями; это было недавно подтверждено экспериментально. [31]
Он уже ввел понятия первичной, вторичной и третичной структуры белков в третьей лекции Лейн (Линдерстром-Ланг, 1952)
Поскольку определение складки должно включать только основные вторичные структурные элементы, которые присутствуют в большинстве гомологов, мы определяем тиоредоксин-подобную складку как двухслойный α/β-сэндвич с рисунком вторичной структуры βαβββα.