Химическая связь — это объединение атомов или ионов для образования молекул , кристаллов и других структур. Связь может быть результатом электростатической силы между противоположно заряженными ионами, как в ионных связях , или посредством совместного использования электронов, как в ковалентных связях , или некоторой комбинации этих эффектов. Химические связи описываются как имеющие различную прочность: существуют «сильные связи» или «первичные связи», такие как ковалентные , ионные и металлические связи, и «слабые связи» или «вторичные связи», такие как диполь-дипольные взаимодействия , сила дисперсии Лондона и водородные связи .
Поскольку противоположные электрические заряды притягиваются, отрицательно заряженные электроны, окружающие ядро, и положительно заряженные протоны внутри ядра притягиваются друг к другу. Электроны, общие для двух ядер , будут притягиваться к обоим ядрам. «Конструктивная квантово-механическая интерференция волновой функции » [1] стабилизирует спаренные ядра (см. Теории химической связи). Связанные ядра поддерживают оптимальное расстояние (расстояние связи), уравновешивая притягивающие и отталкивающие эффекты, количественно объясняемые квантовой теорией . [2] [3]
Атомы в молекулах , кристаллах , металлах и других формах материи удерживаются вместе химическими связями, которые определяют структуру и свойства материи.
Все связи могут быть описаны квантовой теорией , но на практике упрощенные правила и другие теории позволяют химикам предсказывать прочность, направленность и полярность связей. [4] Правило октета и теория VSEPR являются примерами. Более сложными теориями являются теория валентных связей , которая включает орбитальную гибридизацию [5] и резонанс [6] и молекулярная орбитальная теория [7] , которая включает линейную комбинацию атомных орбиталей и теорию поля лигандов . Электростатика используется для описания полярностей связей и их влияния на химические вещества.
Химическая связь — это притяжение между атомами. Это притяжение можно рассматривать как результат различного поведения внешних или валентных электронов атомов. Эти поведения плавно переходят друг в друга при различных обстоятельствах, так что между ними невозможно провести четкую границу. Однако остается полезным и общепринятым различать различные типы связи, которые приводят к различным свойствам конденсированного вещества .
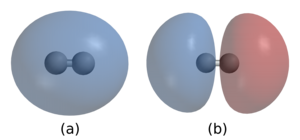
В простейшем представлении о ковалентной связи один или несколько электронов (часто пара электронов) втягиваются в пространство между двумя атомными ядрами. Энергия высвобождается при образовании связи. [8] Это происходит не в результате уменьшения потенциальной энергии, поскольку притяжение двух электронов к двум протонам компенсируется отталкиванием электрон-электрон и протон-протон. Вместо этого высвобождение энергии (и, следовательно, стабильность связи) возникает из-за уменьшения кинетической энергии из-за того, что электроны находятся на более пространственно распределенной (т. е. с большей длиной волны де Бройля ) орбитали по сравнению с тем, когда каждый электрон ограничен ближе к своему соответствующему ядру. [9] Эти связи существуют между двумя конкретными идентифицируемыми атомами и имеют направление в пространстве, что позволяет изображать их как отдельные соединительные линии между атомами на рисунках или моделировать как палки между сферами в моделях.
В полярной ковалентной связи один или несколько электронов неравномерно распределены между двумя ядрами. Ковалентные связи часто приводят к образованию небольших скоплений более связанных атомов, называемых молекулами , которые в твердых телах и жидкостях связаны с другими молекулами силами, которые часто намного слабее ковалентных связей, удерживающих молекулы вместе внутри. Такие слабые межмолекулярные связи придают органическим молекулярным веществам, таким как воски и масла, их мягкий объемный характер и их низкие температуры плавления (в жидкостях молекулы должны прекратить большинство структурированных или ориентированных контактов друг с другом). Однако, когда ковалентные связи связывают длинные цепи атомов в больших молекулах (как в полимерах, таких как нейлон ), или когда ковалентные связи распространяются в сетях через твердые тела, которые не состоят из дискретных молекул (таких как алмаз или кварц или силикатные минералы во многих типах горных пород), то структуры, которые получаются, могут быть как прочными, так и жесткими, по крайней мере, в направлении, правильно ориентированном сетками ковалентных связей. [10] Кроме того, температуры плавления таких ковалентных полимеров и сетей значительно увеличиваются.
В упрощенном представлении об ионной связи связывающий электрон вообще не делится, а переносится. В этом типе связи внешняя атомная орбиталь одного атома имеет вакансию, которая позволяет добавить один или несколько электронов. Эти вновь добавленные электроны потенциально занимают более низкое энергетическое состояние (фактически ближе к большему ядерному заряду), чем они испытывают в другом атоме. Таким образом, одно ядро предлагает более прочно связанное положение для электрона, чем другое ядро, в результате чего один атом может передать электрон другому. Этот перенос заставляет один атом принимать чистый положительный заряд, а другой — чистый отрицательный заряд. Затем связь возникает из-за электростатического притяжения между положительно и отрицательно заряженными ионами . Ионные связи можно рассматривать как крайние примеры поляризации в ковалентных связях. Часто такие связи не имеют определенной ориентации в пространстве, поскольку они возникают из-за равного электростатического притяжения каждого иона ко всем окружающим их ионам. Ионные связи прочны (и поэтому ионные вещества требуют высоких температур для плавления), но также хрупки, поскольку силы между ионами имеют короткий радиус действия и не могут легко перекрывать трещины и изломы. Этот тип связи обусловливает физические характеристики кристаллов классических минеральных солей, таких как поваренная соль.
Менее часто упоминаемый тип связи — металлическая связь . В этом типе связи каждый атом в металле отдает один или несколько электронов «морю» электронов, которые находятся между многими атомами металла. В этом море каждый электрон свободен (в силу своей волновой природы ) быть связанным с большим количеством атомов одновременно. Связь возникает из-за того, что атомы металла становятся несколько положительно заряженными из-за потери своих электронов, в то время как электроны остаются притянутыми ко многим атомам, не являясь частью какого-либо данного атома. Металлическую связь можно рассматривать как крайний пример делокализации электронов по большой системе ковалентных связей, в которой участвует каждый атом. Этот тип связи часто очень прочен (что приводит к прочности металлов на разрыв). Однако металлическая связь более коллективна по своей природе, чем другие типы, и поэтому она позволяет кристаллам металлов легче деформироваться, поскольку они состоят из атомов, притянутых друг к другу, но не каким-либо определенным образом. Это приводит к пластичности металлов. Облако электронов в металлических связях обуславливает характерную для металлов хорошую электро- и теплопроводность, а также их блестящий блеск , отражающий большинство частот белого света.

Ранние размышления о природе химической связи , начиная с XII века, предполагали, что определенные типы химических видов были соединены типом химического сродства . В 1704 году сэр Исаак Ньютон изложил свою знаменитую теорию атомной связи в «Запросе 31» своей Оптики , согласно которой атомы прикрепляются друг к другу некоторой « силой ». В частности, признав различные популярные теории, бывшие в моде в то время, о том, как атомы были обоснованы для присоединения друг к другу, т. е. «зацепленные атомы», «склеенные вместе покоем» или «скрепленные вместе сговорчивыми движениями», Ньютон заявляет, что он скорее сделал бы вывод из их сцепления, что «частицы притягиваются друг к другу некоторой силой , которая при непосредственном контакте чрезвычайно сильна, на малых расстояниях выполняет химические операции и достигает недалеко от частиц с каким-либо ощутимым эффектом».
В 1819 году, вслед за изобретением вольтова столба , Йенс Якоб Берцелиус разработал теорию химического соединения, подчеркивающую электроотрицательные и электроположительные свойства соединяющихся атомов. К середине 19 века Эдвард Франкланд , Ф. А. Кекуле , А. С. Купер, Александр Бутлеров и Герман Кольбе , основываясь на теории радикалов , разработали теорию валентности , первоначально называемую «соединительной силой», в которой соединения соединялись благодаря притяжению положительных и отрицательных полюсов. В 1904 году Ричард Абегг предложил свое правило , согласно которому разница между максимальной и минимальной валентностями элемента часто равна восьми. На этом этапе валентность все еще была эмпирическим числом, основанным только на химических свойствах.
Однако природа атома стала яснее с открытием Эрнестом Резерфордом в 1911 году атомного ядра , окруженного электронами, в котором он цитировал Нагаока отверг модель Томсона на том основании, что противоположные заряды непроницаемы. В 1904 году Нагаока предложил альтернативную планетарную модель атома , в которой положительно заряженный центр окружен несколькими вращающимися электронами, на манер Сатурна и его колец. [11]
Модель Нагаоки сделала два прогноза:
Резерфорд упоминает модель Нагаоки в своей статье 1911 года, в которой предлагается атомное ядро . [12]
На Сольвеевской конференции 1911 года, обсуждая вопрос о том, что может регулировать различия в энергии между атомами, Макс Планк заявил: «Посредниками могут быть электроны». [13] Эти ядерные модели предполагали, что электроны определяют химическое поведение.
Затем последовала модель ядерного атома с электронными орбитами Нильса Бора 1913 года. В 1916 году химик Гилберт Н. Льюис разработал концепцию связей электронной пары , в которой два атома могут совместно использовать от одного до шести электронов, образуя таким образом одноэлектронную связь , одинарную связь , двойную связь или тройную связь ; по собственным словам Льюиса, «электрон может образовывать часть оболочки двух разных атомов и нельзя сказать, что он принадлежит исключительно одному из них». [14]
Также в 1916 году Вальтер Коссель выдвинул теорию, похожую на теорию Льюиса, только его модель предполагала полную передачу электронов между атомами и, таким образом, была моделью ионной связи . И Льюис, и Коссель структурировали свои модели связи на основе правила Абегга (1904).
Нильс Бор также предложил модель химической связи в 1913 году. Согласно его модели для двухатомной молекулы , электроны атомов молекулы образуют вращающееся кольцо, плоскость которого перпендикулярна оси молекулы и равноудалена от атомных ядер. Динамическое равновесие молекулярной системы достигается за счет баланса сил между силами притяжения ядер к плоскости кольца электронов и силами взаимного отталкивания ядер. Модель химической связи Бора учитывала кулоновское отталкивание – электроны в кольце находятся на максимальном расстоянии друг от друга. [15] [16]
В 1927 году датский физик Ойвинд Буррау вывел первое математически полное квантовое описание простой химической связи, то есть связи, образованной одним электроном в молекулярном ионе водорода H 2 + . [17] Эта работа показала, что квантовый подход к химическим связям может быть фундаментально и количественно правильным, но используемые математические методы не могут быть распространены на молекулы, содержащие более одного электрона. Более практичный, хотя и менее количественный, подход был предложен в том же году Вальтером Гайтлером и Фрицем Лондоном . Метод Гайтлера–Лондона составляет основу того, что сейчас называется теорией валентных связей . [18] В 1929 году приближение метода линейной комбинации атомных орбиталей (ММО) было введено сэром Джоном Леннардом-Джонсом , который также предложил методы вывода электронных структур молекул F 2 ( фтор ) и O 2 ( кислород ) из основных квантовых принципов. Эта теория молекулярных орбиталей представляла ковалентную связь как орбиталь, образованную путем объединения квантово-механических атомных орбиталей Шредингера , которые были выдвинуты для электронов в отдельных атомах. Уравнения для связывания электронов в многоэлектронных атомах не могли быть решены с математическим совершенством (т. е. аналитически ), но приближения для них все еще давали много хороших качественных предсказаний и результатов. Большинство количественных расчетов в современной квантовой химии используют либо теорию валентных связей, либо теорию молекулярных орбиталей в качестве отправной точки, хотя третий подход, теория функционала плотности , становится все более популярным в последние годы.
В 1933 году HH James и AS Coolidge провели расчет молекулы дигидрогена, который, в отличие от всех предыдущих расчетов, которые использовали функции только расстояния электрона от атомного ядра, использовал функции, которые также явно добавляли расстояние между двумя электронами. [19] С 13 регулируемыми параметрами они получили результат, очень близкий к экспериментальному результату для энергии диссоциации. Более поздние расширения использовали до 54 параметров и дали превосходное согласие с экспериментами. Этот расчет убедил научное сообщество, что квантовая теория может дать согласие с экспериментом. Однако этот подход не имеет ни одной из физических картин теорий валентной связи и молекулярных орбиталей и его трудно распространить на более крупные молекулы.
Поскольку атомы и молекулы трехмерны, трудно использовать единый метод для обозначения орбиталей и связей. В молекулярных формулах химические связи (связывающие орбитали) между атомами обозначаются по-разному в зависимости от типа обсуждения. Иногда некоторые детали игнорируются. Например, в органической химии иногда рассматривается только функциональная группа молекулы. Таким образом, молекулярная формула этанола может быть записана в конформационной форме, трехмерной форме, полной двумерной форме (указывая каждую связь без трехмерных направлений), сжатой двумерной форме (CH 3 –CH 2 –OH), путем отделения функциональной группы от другой части молекулы (C 2 H 5 OH) или ее атомными составляющими (C 2 H 6 O), в зависимости от того, что обсуждается. Иногда даже обозначаются несвязывающие электроны валентной оболочки (с двумерными приблизительными направлениями), например, для элементарного углерода . ' C ' . Некоторые химики также могут отмечать соответствующие орбитали, например, гипотетический анион этилена −4 ( \ / C=C / \ −4 ), указывающий на возможность образования связи.
Сильные химические связи — это внутримолекулярные силы, которые удерживают атомы вместе в молекулах . Сильная химическая связь образуется в результате передачи или обмена электронами между атомными центрами и основана на электростатическом притяжении между протонами в ядрах и электронами на орбиталях.
Типы прочной связи различаются из-за разницы в электроотрицательности составляющих элементов. Электроотрицательность — это тенденция атома данного химического элемента притягивать общие электроны при образовании химической связи, где чем выше связанная электроотрицательность, тем больше он притягивает электронов. Электроотрицательность служит простым способом количественной оценки энергии связи , которая характеризует связь по непрерывной шкале от ковалентной до ионной связи . Большая разница в электроотрицательности приводит к более полярному (ионному) характеру связи.
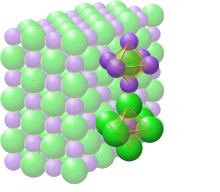
Ионная связь — это тип электростатического взаимодействия между атомами, имеющими большую разницу электроотрицательности. Не существует точного значения, которое отличает ионную связь от ковалентной, но разница электроотрицательности более 1,7, скорее всего, будет ионной, а разница менее 1,7, скорее всего, будет ковалентной. [21] Ионная связь приводит к разделению положительных и отрицательных ионов . Ионные заряды обычно находятся в диапазоне от −3 е до +3 е . Ионная связь обычно встречается в солях металлов , таких как хлорид натрия (поваренная соль). Типичной особенностью ионных связей является то, что виды образуют ионные кристаллы, в которых ни один ион не связан специально с каким-либо одним другим ионом в определенной направленной связи. Вместо этого каждый вид иона окружен ионами противоположного заряда, и расстояние между ним и каждым из противоположно заряженных ионов рядом с ним одинаково для всех окружающих атомов того же типа. Таким образом, больше невозможно связать ион с каким-либо другим определенным отдельным ионизированным атомом рядом с ним. Это ситуация, отличная от той, что наблюдается в ковалентных кристаллах, где ковалентные связи между определенными атомами все еще различимы по более коротким расстояниям между ними, что измеряется с помощью таких методов, как рентгеновская дифракция .
Ионные кристаллы могут содержать смесь ковалентных и ионных видов, как, например, соли сложных кислот, таких как цианид натрия , NaCN. Рентгеновская дифракция показывает, что в NaCN, например, связи между катионами натрия (Na + ) и анионами цианида (CN − ) являются ионными , без ионов натрия , связанных с каким-либо конкретным цианидом . Однако связи между атомами углерода (C) и азота (N) в цианиде являются ковалентными , так что каждый углерод прочно связан только с одним азотом, к которому он физически гораздо ближе, чем к другим углеродам или азотам в кристалле цианида натрия.
Когда такие кристаллы расплавляются в жидкости, ионные связи разрываются первыми, поскольку они ненаправленные и позволяют заряженным видам свободно перемещаться. Аналогично, когда такие соли растворяются в воде, ионные связи обычно разрываются при взаимодействии с водой, но ковалентные связи продолжают сохраняться. Например, в растворе ионы цианида, все еще связанные вместе как отдельные ионы CN − , движутся независимо через раствор, как и ионы натрия, как Na + . В воде заряженные ионы раздвигаются, поскольку каждый из них сильнее притягивается к нескольким молекулам воды, чем друг к другу. Притяжение между ионами и молекулами воды в таких растворах обусловлено слабой химической связью диполь-дипольного типа. В расплавленных ионных соединениях ионы продолжают притягиваться друг к другу, но не каким-либо упорядоченным или кристаллическим образом.
Ковалентная связь — это распространенный тип связи, в котором два или более атомов делят валентные электроны более или менее поровну. Самый простой и распространенный тип — это одинарная связь , в которой два атома делят два электрона. Другие типы включают двойную связь , тройную связь , одно- и трехэлектронные связи , трехцентровую двухэлектронную связь и трехцентровую четырехэлектронную связь .
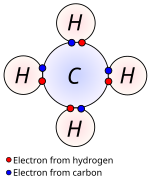
В неполярных ковалентных связях разница электроотрицательностей между связанными атомами невелика, обычно от 0 до 0,3. Связи в большинстве органических соединений описываются как ковалентные. На рисунке показан метан (CH 4 ), в котором каждый водород образует ковалентную связь с углеродом. См. сигма-связи и пи-связи для описания LCAO таких связей. [22]
Молекулы, образованные в основном неполярными ковалентными связями, часто не смешиваются с водой или другими полярными растворителями , но гораздо лучше растворяются в неполярных растворителях, таких как гексан .
Полярная ковалентная связь — это ковалентная связь со значительным ионным характером . Это означает, что два общих электрона находятся ближе к одному из атомов, чем к другому, создавая дисбаланс заряда. Такие связи возникают между двумя атомами с умеренно разной электроотрицательностью и приводят к диполь-дипольным взаимодействиям . Разница электроотрицательности между двумя атомами в этих связях составляет от 0,3 до 1,7.
Одинарная связь между двумя атомами соответствует общему использованию одной пары электронов. Атом водорода (H) имеет один валентный электрон. Затем два атома водорода могут образовать молекулу, удерживаемую вместе общей парой электронов. Теперь каждый атом H имеет электронную конфигурацию благородного газа гелия (He). Пара общих электронов образует одинарную ковалентную связь. Электронная плотность этих двух связывающих электронов в области между двумя атомами увеличивается с плотности двух невзаимодействующих атомов H.

Двойная связь имеет две общие пары электронов, одну в сигма-связи и одну в пи-связи с электронной плотностью, сосредоточенной на двух противоположных сторонах межъядерной оси. Тройная связь состоит из трех общих электронных пар, образующих одну сигма- и две пи-связи. Примером является азот. Четверные и более высокие связи очень редки и встречаются только между определенными атомами переходных металлов .

Координатная ковалентная связь — это ковалентная связь, в которой два общих связывающих электрона принадлежат одному и тому же атому, участвующему в связи. Например, трифторид бора (BF 3 ) и аммиак (NH 3 ) образуют аддукт или координационный комплекс F 3 B←NH 3 со связью B–N, в которой неподеленная пара электронов на N делится с пустой атомной орбиталью на B. BF 3 с пустой орбиталью описывается как акцептор электронной пары или кислота Льюиса , в то время как NH 3 с неподеленной парой, которая может быть общей, описывается как донор электронной пары или основание Льюиса . Электроны делятся примерно поровну между атомами в отличие от ионной связи. Такая связь показана стрелкой, указывающей на кислоту Льюиса. (На рисунке сплошные линии — это связи в плоскости диаграммы, клиновидные связи указывают на наблюдателя, а пунктирные связи — от наблюдателя.)
Комплексы переходных металлов обычно связаны координационными ковалентными связями. Например, ион Ag + реагирует как кислота Льюиса с двумя молекулами основания Льюиса NH 3 с образованием комплексного иона Ag(NH 3 ) 2 + , который имеет две координационные ковалентные связи Ag←N.
В металлической связи связывающие электроны делокализованы по решетке атомов. Напротив, в ионных соединениях расположение связывающих электронов и их заряды статичны. Свободное движение или делокализация связывающих электронов приводит к классическим металлическим свойствам, таким как блеск (поверхностная светоотражательная способность ), электро- и теплопроводность , пластичность и высокая прочность на разрыв .
Существует несколько типов слабых связей, которые могут быть образованы между двумя или более молекулами, которые не связаны ковалентно. Межмолекулярные силы заставляют молекулы притягиваться или отталкиваться друг от друга. Часто эти силы влияют на физические характеристики (например, температуру плавления ) вещества.
Силы Ван-дер-Ваальса являются взаимодействиями между молекулами с закрытыми оболочками . Они включают в себя как кулоновские взаимодействия между частичными зарядами в полярных молекулах, так и отталкивания Паули между закрытыми электронными оболочками. [23] : 696
Силы Киезома — это силы между постоянными диполями двух полярных молекул. [23] : 701 Силы дисперсии Лондона — это силы между индуцированными диполями разных молекул. [23] : 703 Также может быть взаимодействие между постоянным диполем в одной молекуле и индуцированным диполем в другой молекуле. [23] : 702
Водородные связи вида A--H•••B возникают, когда A и B являются двумя высоко электроотрицательными атомами (обычно N, O или F), так что A образует высокополярную ковалентную связь с H, так что H имеет частичный положительный заряд, а B имеет неподеленную пару электронов, которая притягивается к этому частично положительному заряду и образует водородную связь. [23] : 702 Водородные связи ответственны за высокие температуры кипения воды и аммиака по сравнению с их более тяжелыми аналогами. В некоторых случаях похожая галогенная связь может быть образована атомом галогена, расположенным между двумя электроотрицательными атомами в разных молекулах.
На коротких расстояниях силы отталкивания между атомами также становятся важными. [23] : 705-6
В (нереальном) пределе «чистой» ионной связи электроны идеально локализованы на одном из двух атомов в связи. Такие связи могут быть поняты классической физикой . Сила между атомами зависит от изотропных континуальных электростатических потенциалов. Величина силы находится в простой пропорции к произведению двух ионных зарядов согласно закону Кулона . [ требуется цитата ]
Ковалентные связи лучше понимаются с помощью теории валентных связей (ВС) или теории молекулярных орбиталей (МО) . Свойства вовлеченных атомов можно понять с помощью таких понятий, как степень окисления , формальный заряд и электроотрицательность . Электронная плотность внутри связи не назначается отдельным атомам, а вместо этого делокализована между атомами. В теории валентных связей связь концептуализируется как построенная из электронных пар, которые локализованы и совместно используются двумя атомами посредством перекрытия атомных орбиталей. Концепции гибридизации орбиталей и резонанса дополняют это базовое понятие связи электронной пары. В теории молекулярных орбиталей связь рассматривается как делокализованная и распределенная по орбиталям, которые простираются по всей молекуле и адаптированы к ее свойствам симметрии, как правило, путем рассмотрения линейных комбинаций атомных орбиталей (ЛКАО). Теория валентных связей более химически интуитивно понятна, поскольку она пространственно локализована, что позволяет сосредоточить внимание на частях молекулы, претерпевающих химические изменения. Напротив, молекулярные орбитали более «естественны» с точки зрения квантовой механики, при этом орбитальные энергии физически значимы и напрямую связаны с экспериментальными энергиями ионизации из фотоэлектронной спектроскопии . Следовательно, теория валентных связей и теория молекулярных орбиталей часто рассматриваются как конкурирующие, но взаимодополняющие структуры, которые предлагают различные взгляды на химические системы. Как подходы к теории электронной структуры, методы МО и ВС могут давать приближения к любому желаемому уровню точности, по крайней мере, в принципе. Однако на более низких уровнях приближения различаются, и один подход может лучше подходить для вычислений, включающих конкретную систему или свойство, чем другой. [ необходима цитата ]
В отличие от сферически симметричных кулоновских сил в чистых ионных связях, ковалентные связи, как правило, направлены и анизотропны . Они часто классифицируются на основе их симметрии относительно молекулярной плоскости как сигма-связи и пи-связи . В общем случае атомы образуют связи, которые являются промежуточными между ионными и ковалентными, в зависимости от относительной электроотрицательности вовлеченных атомов. Связи этого типа известны как полярные ковалентные связи . [24]
Полярная ковалентная связь существует, когда атомы с разной электроотрицательностью делят электроны в ковалентной связи.