Тиазол ( / ˈ θ aɪ . ə z oʊ l / ), или 1,3-тиазол , представляет собой 5-членное гетероциклическое соединение , содержащее как серу, так и азот. Термин «тиазол» также относится к большому семейству производных. Сам тиазол представляет собой бледно-желтую жидкость с запахом, похожим на запах пиридина , и молекулярной формулой C 3 H 3 NS. [2] Тиазольное кольцо известно как компонент витамина тиамина ( B 1 ).
Тиазолы являются членами азолов , гетероциклов, которые включают имидазолы и оксазолы . Тиазол также может считаться функциональной группой , когда он является частью более крупной молекулы.
Будучи плоскими, тиазолы характеризуются значительной делокализацией пи-электронов и имеют некоторую степень ароматичности , большую, чем соответствующие оксазолы . Эта ароматичность подтверждается химическим сдвигом 1 H ЯМР протонов кольца, которые поглощают между 7,27 и 8,77 ppm, что указывает на сильный диамагнитный кольцевой ток . Рассчитанная плотность пи-электронов отмечает C5 как основной сайт для электрофильного замещения, а C2-H как восприимчивый к депротонированию.
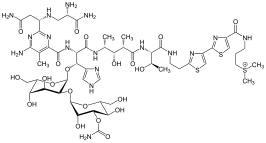
Тиазолы встречаются в различных специализированных продуктах, часто в сплаве с производными бензола, так называемыми бензотиазолами. Помимо витамина B1 , тиазольное кольцо встречается в эпотилоне . Другими важными производными тиазола являются бензотиазолы , например, химическое вещество светлячков люциферин . В то время как тиазолы широко представлены в биомолекулах , оксазолы — нет. Он встречается в природных пептидах и используется при разработке пептидомиметиков (т. е. молекул, которые имитируют функцию и структуру пептидов). [3]
Коммерчески значимые тиазолы включают в себя в основном красители и фунгициды . Тифлузамид, трициклазол и тиабендазол продаются для борьбы с различными сельскохозяйственными вредителями. Другим широко используемым производным тиазола является нестероидный противовоспалительный препарат Мелоксикам . Следующие антрохиноновые красители содержат бензотиазольные субъединицы: Algol Yellow 8 (CAS# [6451-12-3]), Algol Yellow GC (CAS# [129-09-9]), Indanthren Rubine B (CAS# [6371-49-9]), Indanthren Blue CLG (CAS# [6371-50-2] и Indanthren Blue CLB (CAS# [6492-78-0]). Эти тиазольные красители используются для окрашивания хлопка .
Существуют различные лабораторные методы органического синтеза тиазолов. Наиболее известным является синтез тиазола Ганча, который представляет собой реакцию между галокетонами и тиоамидами . Например, 2,4-диметилтиазол синтезируется из тиоацетамида и хлорацетона . [4] В синтезе Кука-Хейлброна тиазолы возникают путем конденсации α-аминонитрила с сероуглеродом . Тиазолы могут быть получены путем ацилирования 2-аминотиолатов, часто доступных по реакции Герца .
Тиазолы обычно образуются в результате реакций цистеина , который обеспечивает остов NCCS кольца. Однако тиамин не соответствует этой схеме. Несколько путей биосинтеза ведут к кольцу тиазола, необходимому для образования тиамина. [5] Сера тиазола образуется из цистеина. У анаэробных бактерий группа CN образуется из дегидроглицина.
При pK a 2,5 для сопряженной кислоты тиазолы гораздо менее основные, чем имидазол (pK a = 7). [6]
Депротонирование сильными основаниями происходит в положении C2-H. Отрицательный заряд в этой позиции стабилизируется как илид . Основания Хаузера и литийорганические соединения реагируют в этом месте, заменяя протон. 2-Литиотиазолы также образуются путем обмена металл-галоген из 2-бромтиазола. [7]
Электрофильное ароматическое замещение в положении C5, но требует активирующих групп , таких как метильная группа, как показано в реакции бромирования :
Окисление на азоте дает ароматический тиазол N -оксид ; существует много окислителей, таких как mCPBA ; новым является гипофтористая кислота, полученная из фтора и воды в ацетонитриле ; часть окисления происходит на сере, что приводит к неароматическому сульфоксиду / сульфону : [8] Тиазол N -оксиды полезны в катализируемых палладием реакциях арилирования CH, где N -оксид способен надежно сдвигать реакционную способность в пользу 2-положения и позволяет проводить эти реакции в гораздо более мягких условиях. [9]
Алкилирование тиазолов по азоту образует катион тиазолия . Соли тиазолия являются катализаторами в реакции Штеттера и конденсации бензоина . Депротонирование солей N -алкилтиазолия дает свободные карбены [11] и комплексы карбенов с переходными металлами .
Алагебриум — препарат на основе тиазолия.
{{cite journal}}: Цитировать журнал требует |journal=( помощь )