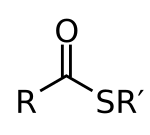
В органической химии тиоэфиры представляют собой сероорганические соединения с молекулярной структурой R−C(=O)−S−R' . Они аналогичны карбоксилатным эфирам ( R−C(=O)−O−R' ), в которых сера в тиоэфире заменяет кислород в карбоксилатном эфире, на что указывает префикс тио- . Они являются продуктом этерификации карбоновой кислоты ( R−C(=O)−O−H ) с тиолом ( R'−S−H ). В биохимии наиболее известные тиоэфиры являются производными кофермента А , например, ацетил-КоА . [1] R и R' представляют органильные группы или H в случае R.
Один из путей получения тиоэфиров включает реакцию хлорангидрида с солью щелочного металла тиола: [1]
Другой распространенный путь подразумевает замещение галогенидов щелочной металлической солью тиокарбоновой кислоты . Например, тиоацетатные эфиры обычно получают путем алкилирования тиоацетата калия : [1]
Аналогичное алкилирование ацетатной соли практикуется редко. Алкилирование можно провести с использованием оснований Манниха и тиокарбоновой кислоты:
Тиоэфиры можно получить путем конденсации тиолов и карбоновых кислот в присутствии дегидратирующих агентов : [2] [3]
Типичным дегидратирующим агентом является DCC . [4] Также сообщалось о попытках улучшить устойчивость синтеза тиоэфира с использованием более безопасного связующего реагента T3P и более экологичного растворителя циклопентанона . [5] Кислотные ангидриды и некоторые лактоны также дают тиоэфиры при обработке тиолами в присутствии основания.
Тиоэфиры можно легко получить из спиртов с помощью реакции Мицунобу , используя тиоуксусную кислоту . [6]
Они также возникают в результате карбонилирования алкинов и алкенов в присутствии тиолов. [7]
Тиоэфиры гидролизуются до тиолов и карбоновой кислоты:
Карбонильный центр в тиоэфирах более реакционноспособен по отношению к амину, чем к кислородным нуклеофилам, что приводит к образованию амидов :
Эта реакция используется в нативном химическом лигировании , протоколе синтеза пептидов . [8]
В родственной реакции тиоэфиры могут быть преобразованы в сложные эфиры. [9] Тиоацетатные эфиры также могут быть расщеплены метантиолом в присутствии стехиометрического основания, как показано в получении пент-4-ин-1-тиола: [10]
Уникальной реакцией для тиоэфиров является реакция Фукуямы , в которой тиоэфир соединяется с цинкорганическим галогенидом с помощью палладиевого катализатора с образованием кетона.


Тиоэфиры являются обычными промежуточными продуктами во многих биосинтетических реакциях, включая образование и деградацию жирных кислот и мевалоната , предшественника стероидов. Примерами являются малонил-КоА , ацетоацетил-КоА , пропионил-КоА , циннамоил-КоА и тиоэфиры ацилпереносящего белка (ACP). Ацетогенез происходит через образование ацетил-КоА . Биосинтез лигнина , который составляет большую часть биомассы суши Земли, происходит через тиоэфирное производное кофейной кислоты . [11] Эти тиоэфиры возникают аналогично тем, которые получают синтетическим путем, с той разницей, что дегидратирующим агентом является АТФ. Кроме того, тиоэфиры играют важную роль в маркировке белков убиквитином , который маркирует белок для деградации.
Окисление атома серы в тиоэфирах ( тиолактонах ) постулируется в биоактивации антитромботических пролекарств тиклопидина , клопидогреля и прасугреля . [12] [13]
Как утверждается в «Тиоэфирном мире», тиоэфиры являются возможными предшественниками жизни. [14] Как объясняет Кристиан де Дюв :
Показательно, что тиоэфиры являются обязательными промежуточными продуктами в нескольких ключевых процессах, в которых АТФ либо используется, либо регенерируется. Тиоэфиры участвуют в синтезе всех эфиров , включая те, которые содержатся в сложных липидах . Они также участвуют в синтезе ряда других клеточных компонентов, включая пептиды , жирные кислоты , стерины , терпены , порфирины и другие. Кроме того, тиоэфиры образуются как ключевые промежуточные продукты в нескольких особенно древних процессах, которые приводят к сборке АТФ. В обоих этих случаях тиоэфир ближе, чем АТФ, к процессу, который использует или вырабатывает энергию. Другими словами, тиоэфиры могли фактически играть роль АТФ в «тиоэфирном мире», изначально лишенном АТФ. В конечном итоге, [эти] тиоэфиры могли бы служить для введения АТФ благодаря своей способности поддерживать образование связей между фосфатными группами .
Однако из-за высокого изменения свободной энергии гидролиза тиоэфиров и, соответственно, их низких констант равновесия маловероятно, что эти соединения могли бы накопиться абиотически в какой-либо значительной степени, особенно в условиях гидротермальных источников. [15]


Тионоэфиры изомерны тиоэфирам. В тионоэфире сера заменяет карбонильный кислород в эфире. Метилтионобензоат — это C 6 H 5 C(S)OCH 3 . Такие соединения обычно получают реакцией тиоацилхлорида со спиртом. [16]
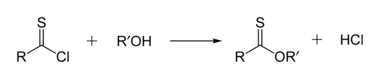
Их также можно получить реакцией реагента Лоуссона со сложными эфирами или обработкой солей Пиннера сероводородом .
Различные тионоэфиры могут быть получены путем переэтерификации существующего метилтионоэфира со спиртом в условиях катализа основанием. [17]

Ксантогенаты [18] и тиоамиды [19] могут быть преобразованы в тионоэфиры в условиях кросс-сочетания, катализируемого металлами.