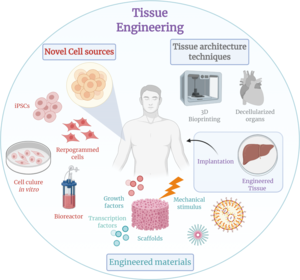
Тканевая инженерия — это дисциплина биомедицинской инженерии , которая использует комбинацию клеток , инженерии , методов материалов и подходящих биохимических и физико-химических факторов для восстановления, поддержания, улучшения или замены различных типов биологических тканей. Тканевая инженерия часто включает использование клеток, помещенных на тканевые каркасы, для формирования новой жизнеспособной ткани в медицинских целях, но не ограничивается приложениями, включающими клетки и тканевые каркасы. Хотя когда-то она была отнесена к подобласти биоматериалов , увеличившись в масштабах и важности, ее можно рассматривать как самостоятельную область. [1]
Хотя большинство определений тканевой инженерии охватывают широкий спектр приложений, на практике этот термин тесно связан с приложениями, которые восстанавливают или заменяют части или целые ткани (например, органы , кости , хрящи , [2] кровеносные сосуды , мочевой пузырь , кожу , мышцы и т. д.). Часто ткани, участвующие в этом, требуют определенных механических и структурных свойств для надлежащего функционирования. Этот термин также применялся к попыткам выполнить определенные биохимические функции с использованием клеток в искусственно созданной системе поддержки (например, искусственная поджелудочная железа или биоискусственная печень ). Термин регенеративная медицина часто используется как синоним тканевой инженерии, хотя те, кто занимается регенеративной медициной, больше внимания уделяют использованию стволовых клеток или клеток-предшественников для производства тканей.

Обычно применяемое определение тканевой инженерии, как указано Лангером [3] и Ваканти, [4] - это " междисциплинарная область, которая применяет принципы инженерии и наук о жизни к разработке биологических заменителей, которые восстанавливают, поддерживают или улучшают функцию [биологической ткани] или целого органа". [5] Кроме того, Лангер и Ваканти также утверждают, что существует три основных типа тканевой инженерии: клетки, индуцирующие ткани вещества и подход клетки + матрица (часто называемый каркасом). Тканевая инженерия также была определена как "понимание принципов роста ткани и применение этого для создания функциональной замещающей ткани для клинического использования". [6] В дальнейшем описании говорится, что "основное предположение тканевой инженерии заключается в том, что использование естественной биологии системы позволит добиться большего успеха в разработке терапевтических стратегий, направленных на замену, восстановление, поддержание или улучшение функции ткани". [6]
Разработки в междисциплинарной области тканевой инженерии дали новый набор заменяющих тканей частей и стратегий внедрения. Научные достижения в области биоматериалов , стволовых клеток, факторов роста и дифференциации и биомиметических сред создали уникальные возможности для изготовления или улучшения существующих тканей в лабораторных условиях из комбинаций сконструированных внеклеточных матриц («каркасов»), клеток и биологически активных молекул. Среди основных проблем, с которыми сейчас сталкивается тканевая инженерия, — необходимость более сложной функциональности, биомеханической стабильности и васкуляризации в выращенных в лабораторных условиях тканях, предназначенных для трансплантации. [7]
Историческое происхождение термина неясно, поскольку определение слова изменилось за последние несколько десятилетий. Термин впервые появился в публикации 1984 года, в которой описывалась организация мембраны, подобной эндотелию, на поверхности давно имплантированного синтетического глазного протеза. [8]
Первое современное использование термина, как оно признано сегодня, было в 1985 году исследователем, физиологом и биоинженером Юань-Чэн Фунгом из Инженерного исследовательского центра. Он предложил объединить термины ткань (в отношении фундаментальных отношений между клетками и органами) и инженерия (в отношении области модификации указанных тканей). Термин был официально принят в 1987 году. [8]
Элементарное понимание внутренней работы человеческих тканей может датироваться более ранним временем, чем можно было бы ожидать. Еще в эпоху неолита швы использовались для закрытия ран и содействия заживлению. Позже такие общества, как Древний Египет, разработали более совершенные материалы для зашивания ран, такие как льняные швы. Около 2500 г. до н. э. в Древней Индии были разработаны методы пересадки кожи путем срезания кожи с ягодицы и пришивания ее к ранам в ухе, носу или губах. Древние египтяне часто пересаживали кожу с трупов живым людям и даже пытались использовать мед в качестве антибиотика и жир в качестве защитного барьера для предотвращения инфекции. В 1-м и 2-м веках нашей эры галло-римляне разработали имплантаты из кованого железа, а зубные имплантаты можно было найти у древних майя.
Хотя эти древние общества разработали методы, которые намного опередили свое время, им все еще не хватало механистического понимания того, как тело реагирует на эти процедуры. Этот механистический подход появился вместе с развитием эмпирического метода науки, пионером которого был Рене Декарт. Сэр Исаак Ньютон начал описывать тело как «физиохимическую машину» и утверждал, что болезнь — это поломка в машине.
В 17 веке Роберт Гук открыл клетку, а письмо Бенедикта де Спинозы выдвинуло идею гомеостаза между динамическими процессами в организме. Эксперименты с гидрой, проведенные Авраамом Трембли в 18 веке, начали углубляться в регенеративные возможности клеток. В 19 веке лучшее понимание того, как различные металлы реагируют с телом, привело к разработке лучших швов и переходу к винтовым и пластинчатым имплантатам в фиксации костей. Кроме того, в середине 1800-х годов впервые была выдвинута гипотеза о том, что взаимодействие клеток и окружающей среды и пролиферация клеток имеют жизненно важное значение для регенерации тканей.
С течением времени и развитием технологий возникает постоянная необходимость в изменении подхода исследователей к своим исследованиям. Тканевая инженерия продолжала развиваться на протяжении столетий. Вначале люди использовали образцы непосредственно от человеческих или животных трупов. Теперь у тканевых инженеров есть возможность переделывать многие ткани в организме с помощью современных технологий, таких как микропроизводство и трехмерная биопечать в сочетании с собственными тканевыми клетками/стволовыми клетками. Эти достижения позволили исследователям создавать новые ткани гораздо более эффективным способом. Например, эти технологии позволяют добиться большей персонализации, что обеспечивает лучшую биосовместимость, снижение иммунного ответа, клеточную интеграцию и долговечность. Нет сомнений, что эти технологии будут продолжать развиваться, поскольку мы продолжали наблюдать развитие микропроизводства и биопечати в течение последнего десятилетия.
В 1960 году Вихтерле и Лим первыми опубликовали эксперименты с гидрогелями для биомедицинских целей, используя их в конструкции контактных линз. Работа в этой области развивалась медленно в течение следующих двух десятилетий, но позже нашла поддержку, когда гидрогели были повторно использованы для доставки лекарств. В 1984 году Чарльз Халл разработал биопечать, превратив струйный принтер Hewlett-Packard в устройство, способное размещать клетки в 2D. Трехмерная (3D) печать — это тип аддитивного производства, который с тех пор нашел различные применения в медицинской инженерии благодаря своей высокой точности и эффективности. С разработкой биологом Джеймсом Томпсоном первых линий стволовых клеток человека в 1998 году, за которой последовала трансплантация первых внутренних органов, выращенных в лабораторных условиях, в 1999 году и созданием первого биопринтера в 2003 году Университетом Миссури, когда они печатали сфероиды без необходимости использования каркасов, трехмерная биопечать стала более традиционно использоваться в медицинской области, чем когда-либо прежде. До сих пор ученым удалось напечатать мини-органоиды и органы на чипах , которые дали практическое представление о функциях человеческого тела. Фармацевтические компании используют эти модели для тестирования лекарств, прежде чем перейти к исследованиям на животных. Однако полностью функциональный и структурно похожий орган пока не был напечатан. Сообщается, что группа из Университета Юты напечатала уши и успешно пересадила их детям, рожденным с дефектами, из-за которых их уши были частично развиты.
Сегодня гидрогели считаются предпочтительным выбором биочернил для 3D-биопечати, поскольку они имитируют естественный ECM клеток, а также обладают сильными механическими свойствами, способными поддерживать 3D-структуры. Кроме того, гидрогели в сочетании с 3D-биопечатью позволяют исследователям производить различные каркасы, которые могут быть использованы для формирования новых тканей или органов. 3D-печатные ткани по-прежнему сталкиваются со многими проблемами, такими как добавление сосудистой сети. Между тем, 3D-печатные части тканей определенно улучшат наше понимание человеческого тела, тем самым ускоряя как фундаментальные, так и клинические исследования.
.jpg/440px-Earproject_-_2x3_(6127848729).jpg)
Согласно определению Лангера и Ваканти [5] , примеры тканевой инженерии попадают в одну или несколько из трех категорий: «только клетки», «клетки и каркас» или «факторы, индуцирующие ткань».
Клетки являются одним из основных компонентов успеха подходов тканевой инженерии. Тканевая инженерия использует клетки в качестве стратегий для создания/замены новой ткани. Примерами являются фибробласты, используемые для восстановления или обновления кожи, [23] хондроциты, используемые для восстановления хряща (продукт, одобренный MACI–FDA), и гепатоциты, используемые в системах поддержки печени.
Клетки могут использоваться отдельно или с поддерживающими матрицами для приложений тканевой инженерии. Адекватная среда для стимулирования роста клеток, дифференциации и интеграции с существующей тканью является критическим фактором для клеточных строительных блоков. [24] Манипуляции с любым из этих клеточных процессов создают альтернативные пути для развития новой ткани (например, перепрограммирование клеток — соматические клетки, васкуляризация).
Методы выделения клеток зависят от источника клеток. Центрифугирование и аферез — это методы, используемые для извлечения клеток из биологических жидкостей (например, крови). В то время как процессы пищеварения, обычно использующие ферменты для удаления внеклеточного матрикса (ECM), требуются до центрифугирования или методов афереза для извлечения клеток из тканей/органов. Трипсин и коллагеназа — наиболее распространенные ферменты, используемые для переваривания тканей. В то время как трипсин зависит от температуры, коллагеназа менее чувствительна к изменениям температуры.
Первичные клетки — это те, которые напрямую изолированы от ткани хозяина. Эти клетки обеспечивают ex-vivo модель поведения клеток без каких-либо генетических, эпигенетических или эволюционных изменений; что делает их более близкими к репликации условий in-vivo, чем клетки, полученные другими методами. [25] Однако это ограничение также может затруднить их изучение. Это зрелые клетки, часто окончательно дифференцированные, что означает, что для многих типов клеток пролиферация затруднена или невозможна. Кроме того, микросреды, в которых существуют эти клетки, являются высокоспециализированными, что часто затрудняет репликацию этих условий. [26]
Вторичные клетки Часть клеток из первичной культуры перемещается в новый репозиторий/сосуд для продолжения культивирования. Среда из первичной культуры удаляется, клетки, которые желательно перенести, получаются и затем культивируются в новом сосуде со свежей средой роста. [ необходима цитата ] Вторичная клеточная культура полезна для того, чтобы гарантировать, что у клеток есть и пространство, и питательные вещества, которые им требуются для роста. Вторичные культуры наиболее часто используются в любом сценарии, в котором желательно большее количество клеток, чем может быть найдено в первичной культуре. Вторичные клетки разделяют ограничения первичных клеток (см. выше), но имеют дополнительный риск заражения при переносе в новый сосуд.
Аутологичные: Донор и реципиент клеток — один и тот же человек. Клетки собирают, культивируют или хранят, а затем повторно вводят хозяину. В результате повторного введения собственных клеток хозяина антигенный ответ не возникает. Иммунная система организма распознает эти повторно имплантированные клетки как свои собственные и не нацеливает их на атаку. Зависимость аутологичных клеток от здоровья клеток хозяина и заболеваемости донорского участка может быть сдерживающим фактором для их использования. Мезенхимальные стволовые клетки, полученные из жировой ткани и костного мозга, обычно являются аутологичными по своей природе и могут использоваться множеством способов: от помощи в восстановлении скелетной ткани до пополнения бета-клеток у пациентов с диабетом. [27] [28] [29] [30]
Аллогенный: клетки получают из тела донора того же вида, что и реципиент. Хотя существуют некоторые этические ограничения на использование человеческих клеток для исследований in vitro (например, развитие химерной ткани человеческого мозга [31] ), использование дермальных фибробластов из крайней плоти человека демонстрирует иммунологически безопасный и, следовательно, жизнеспособный выбор для аллогенной тканевой инженерии кожи.
Ксеногенные: Эти клетки получены из изолированных клеток альтернативных видов реципиента. Известным примером использования ксеногенных тканей является создание сердечно-сосудистых имплантатов с помощью клеток животных. Химерное человеко-животное фермерство поднимает этические вопросы относительно возможности улучшения сознания путем имплантации человеческих органов животным. [32]
Сингенные или изогенные: эти клетки описывают те, которые происходят из идентичного генетического кода. Это дает иммунологическое преимущество, аналогичное аутологичным клеточным линиям (см. выше). [33] Аутологичные клетки можно считать сингенными, но классификация также распространяется на неаутологичные клетки, такие как клетки от идентичного близнеца, от генетически идентичных (клонированных) исследовательских моделей или индуцированных стволовых клеток (iSC) [34] по отношению к донору.
Стволовые клетки — это недифференцированные клетки, способные делиться в культуре и давать начало различным формам специализированных клеток. Стволовые клетки делятся на «взрослые» и «эмбриональные» стволовые клетки в зависимости от их источника. Хотя все еще ведутся большие этические дебаты, связанные с использованием эмбриональных стволовых клеток, считается, что другой альтернативный источник — индуцированные плюрипотентные стволовые клетки — может быть полезен для восстановления больных или поврежденных тканей или может использоваться для выращивания новых органов.
Тотипотентные клетки — это стволовые клетки, которые могут делиться на другие стволовые клетки или дифференцироваться в любой тип клеток организма, включая внеэмбриональные ткани.
Плюрипотентные клетки — это стволовые клетки, которые могут дифференцироваться в любой тип клеток организма, за исключением внеэмбриональных тканей. Индуцированные плюрипотентные стволовые клетки (ИПСК) — это подкласс плюрипотентных стволовых клеток, напоминающих эмбриональные стволовые клетки (ЭСК), которые были получены из взрослых дифференцированных клеток. ИПСК создаются путем изменения экспрессии транскрипционных факторов во взрослых клетках до тех пор, пока они не станут похожи на эмбриональные стволовые клетки.
Мультипотентные стволовые клетки могут дифференцироваться в любую клетку в пределах того же класса, например, крови или кости . Распространенным примером мультипотентных клеток являются мезенхимальные стволовые клетки (МСК).
Скаффолды — это материалы, которые были разработаны для того, чтобы вызывать желаемые клеточные взаимодействия, способствующие формированию новых функциональных тканей в медицинских целях. Клетки часто «засеиваются» в эти структуры, способные поддерживать трехмерное формирование тканей. Скаффолды имитируют внеклеточный матрикс нативной ткани, воспроизводя среду in vivo и позволяя клеткам влиять на их собственное микроокружение. Они обычно служат по крайней мере одной из следующих целей: позволяют клеткам прикрепляться и мигрировать, доставляют и удерживают клетки и биохимические факторы, обеспечивают диффузию жизненно важных питательных веществ клеток и экспрессируемых продуктов, а также оказывают определенные механические и биологические воздействия для изменения поведения клеточной фазы.
В 2009 году междисциплинарная группа под руководством торакального хирурга Торстена Уоллеса успешно имплантировала пациенту, ожидающему реконструкцию трахеи, первый биоискусственный трансплантат, обеспечивающий врожденную сосудистую сеть для посттрансплантационного питания трансплантата. [35]

Для достижения цели реконструкции тканей каркасы должны соответствовать некоторым особым требованиям. Высокая пористость и достаточный размер пор необходимы для облегчения засевания клеток и диффузии по всей структуре как клеток, так и питательных веществ. Биоразлагаемость часто является существенным фактором, поскольку каркасы должны предпочтительно поглощаться окружающими тканями без необходимости хирургического удаления. Скорость, с которой происходит деградация, должна максимально совпадать со скоростью формирования ткани: это означает, что пока клетки создают свою собственную естественную матричную структуру вокруг себя, каркас способен обеспечить структурную целостность внутри организма и в конечном итоге он разрушится, оставив новообразованную ткань, которая возьмет на себя механическую нагрузку. Инъекционность также важна для клинического использования. Недавние исследования в области печати органов показывают, насколько важен хороший контроль трехмерной среды для обеспечения воспроизводимости экспериментов и получения лучших результатов.
Выбор материала является важным аспектом производства каркаса. Используемые материалы могут быть натуральными или синтетическими, а также биоразлагаемыми или небиоразлагаемыми. Кроме того, они должны быть биосовместимыми, то есть не оказывать неблагоприятного воздействия на клетки. [37] Например, силикон — это синтетический, небиоразлагаемый материал, обычно используемый в качестве материала для доставки лекарств, [38] [39], в то время как желатин — это биоразлагаемый, натуральный материал, обычно используемый в каркасах для клеточных культур [40] [41] [42]
Материал, необходимый для каждого применения, отличается и зависит от желаемых механических свойств материала. Например, для тканевой инженерии дефектов длинных костей потребуется жесткий каркас с прочностью на сжатие, аналогичной прочности кортикальной кости (100-150 МПа), что намного выше по сравнению с каркасом для регенерации кожи. [43] [44]
Существует несколько универсальных синтетических материалов, используемых для множества различных применений в качестве каркасов. Одним из таких часто используемых материалов является полимолочная кислота (PLA), синтетический полимер. PLA – полимолочная кислота. Это полиэфир, который разлагается в организме человека с образованием молочной кислоты , природного химического вещества, которое легко выводится из организма. Аналогичными материалами являются полигликолевая кислота (PGA) и поликапролактон (PCL): их механизм разложения похож на механизм разложения PLA, но PCL разлагается медленнее, а PGA разлагается быстрее. [ необходима цитата ] PLA обычно сочетают с PGA для создания полимолочной-со-гликолевой кислоты (PLGA). Это особенно полезно, поскольку разложение PLGA можно настроить, изменив весовые проценты PLA и PGA: больше PLA – медленнее разложение, больше PGA – быстрее разложение. Эта настраиваемость, наряду с его биосовместимостью, делает его чрезвычайно полезным материалом для создания каркасов. [45]
Скаффолды также могут быть построены из природных материалов: в частности, были изучены различные производные внеклеточного матрикса для оценки их способности поддерживать рост клеток. Материалы на основе белков, такие как коллаген или фибрин , и полисахаридные материалы, такие как хитозан [46] или гликозаминогликаны (ГАГ), оказались подходящими с точки зрения совместимости с клетками. Среди ГАГ гиалуроновая кислота , возможно, в сочетании со сшивающими агентами (например, глутаральдегидом , водорастворимым карбодиимидом и т. д.), является одним из возможных вариантов в качестве материала для скаффолдов. Благодаря ковалентному присоединению тиоловых групп к этим полимерам они могут сшиваться посредством образования дисульфидных связей. [47] Использование тиолированных полимеров ( тиомеров ) в качестве материала для каркасов для тканевой инженерии было впервые представлено на 4-м Центральноевропейском симпозиуме по фармацевтическим технологиям в Вене в 2001 году. [48] Поскольку тиомеры биосовместимы, проявляют свойства клеточной имитации и эффективно поддерживают пролиферацию и дифференциацию различных типов клеток, они широко используются в качестве каркасов для тканевой инженерии. [49] [50] [51] Кроме того, было показано, что тиомеры, такие как тиолированная гиалуроновая кислота [52] и тиолированный хитозан [53], проявляют свойства заживления ран и являются предметом многочисленных клинических испытаний . [54] Кроме того, фрагмент белка внеклеточного матрикса, такой как пептид RGD , может быть связан с небиоактивным материалом для содействия прикреплению клеток. [55] Другой формой каркаса является децеллюляризованная ткань. Это процесс, в котором химические вещества используются для извлечения клеток из тканей, оставляя только внеклеточный матрикс. Это имеет преимущество полностью сформированного матрикса, специфичного для желаемого типа ткани. Однако децеллюляризованный каркас может представлять иммунные проблемы с будущими введенными клетками.


В литературе описан ряд различных методов подготовки пористых структур для использования в качестве каркасов для тканевой инженерии. Каждый из этих методов имеет свои преимущества, но ни один из них не свободен от недостатков.
Молекулярная самосборка является одним из немногих методов создания биоматериалов со свойствами, аналогичными по масштабу и химии свойствам естественного внеклеточного матрикса (ВКМ) in vivo , что является важным шагом на пути к тканевой инженерии сложных тканей. [56] Более того, эти гидрогелевые каркасы продемонстрировали превосходство в токсикологии и биосовместимости in vivo по сравнению с традиционными макрокаркасами и материалами животного происхождения.
Эти методы включают все подходы, которые были успешно использованы для приготовления нетканых сеток из различных полимеров . В частности, нетканые полигликолидные структуры были протестированы для применения в тканевой инженерии: такие волокнистые структуры оказались полезными для выращивания различных типов клеток. Основные недостатки связаны с трудностями в получении высокой пористости и регулярного размера пор.
Литье растворителем и выщелачивание частиц (SCPL) позволяет изготавливать структуры с регулярной пористостью, но ограниченной толщиной. Сначала полимер растворяют в подходящем органическом растворителе (например, полимолочную кислоту можно растворить в дихлорметане ), затем раствор заливают в форму, заполненную частицами порогена. Таким порогеном может быть неорганическая соль, такая как хлорид натрия , кристаллы сахарозы , желатиновые сферы или парафиновые сферы. Размер частиц порогена будет влиять на размер пор каркаса, в то время как соотношение полимера и порогена напрямую коррелирует с величиной пористости конечной структуры. После заливки полимерного раствора растворителю дают полностью испариться, затем композитную структуру в форме погружают в ванну с жидкостью, подходящей для растворения порогена: вода в случае хлорида натрия, сахарозы и желатина или алифатический растворитель, такой как гексан, для использования с парафином. После полного растворения порогена получается пористая структура. Помимо небольшого диапазона толщины, который можно получить, еще один недостаток SCPL заключается в использовании органических растворителей, которые необходимо полностью удалить, чтобы избежать любого возможного повреждения клеток, посеянных на каркасе.
Чтобы преодолеть необходимость использования органических растворителей и твердых порогенов, была разработана технология, использующая газ в качестве порогена. Сначала дискообразные структуры, изготовленные из желаемого полимера, готовятся посредством компрессионного формования с использованием нагретой формы. Затем диски помещаются в камеру, где они подвергаются воздействию высокого давления CO2 в течение нескольких дней. Давление внутри камеры постепенно восстанавливается до атмосферного уровня. Во время этой процедуры поры образуются молекулами углекислого газа , которые покидают полимер, в результате чего образуется губчатая структура. Основные проблемы, возникающие в результате такой технологии, вызваны избыточным теплом, используемым во время компрессионного формования (что запрещает включение любого термолабильного материала в полимерную матрицу), и тем фактом, что поры не образуют взаимосвязанную структуру.
Этот метод не требует использования твердого порогена, такого как SCPL. Сначала синтетический полимер растворяют в подходящем растворителе (например, полимолочной кислоте в дихлорметане), затем к полимерному раствору добавляют воду, и две жидкости смешивают для получения эмульсии . Перед тем, как две фазы смогут разделить, эмульсию отливают в форму и быстро замораживают путем погружения в жидкий азот . Замороженную эмульсию затем подвергают сублимационной сушке для удаления диспергированной воды и растворителя, в результате чего получается затвердевшая пористая полимерная структура. Хотя эмульгирование и сублимационная сушка позволяют производить подготовку быстрее по сравнению с SCPL (поскольку она не требует трудоемкого этапа выщелачивания), она все равно требует использования растворителей. Более того, размер пор относительно невелик, а пористость часто неравномерна. Сублимационная сушка сама по себе также является широко используемой технологией для изготовления каркасов. В частности, его используют для приготовления коллагеновых губок: коллаген растворяют в кислых растворах уксусной или соляной кислоты , отливают в форму, замораживают жидким азотом, а затем лиофилизируют .
Подобно предыдущей методике, процедура разделения фаз TIPS требует использования растворителя с низкой температурой плавления, который легко сублимируется. Например, диоксан может быть использован для растворения полимолочной кислоты, затем разделение фаз вызывается добавлением небольшого количества воды: образуются богатая полимером и бедная полимером фаза. После охлаждения ниже температуры плавления растворителя и нескольких дней вакуумной сушки для сублимации растворителя получается пористый каркас. Разделение фаз жидкость-жидкость имеет те же недостатки, что и эмульгирование/сублимационная сушка. [57]
Электропрядение — это очень универсальная технология, которая может использоваться для производства непрерывных волокон диаметром от нескольких микрон до нескольких нанометров. В типичной установке электропрядения желаемый материал каркаса растворяется в растворителе и помещается в шприц. Этот раствор подается через иглу, а высокое напряжение подается на кончик и на проводящую поверхность сбора. Накопление электростатических сил внутри раствора заставляет его выбрасывать тонкий волокнистый поток к противоположно заряженной или заземленной поверхности сбора. Во время этого процесса растворитель испаряется, оставляя твердые волокна, оставляя высокопористую сеть. Эта технология хорошо настраивается с изменением растворителя, напряжения, рабочего расстояния (расстояния от иглы до поверхности сбора), скорости потока раствора, концентрации растворенного вещества и поверхности сбора. Это позволяет точно контролировать морфологию волокна.
Однако на коммерческом уровне, из-за соображений масштабируемости, одновременно задействовано 40 или иногда 96 игл. Узкими местами в таких установках являются: 1) Поддержание вышеупомянутых переменных одинаково для всех игл и 2) формирование «бусин» в отдельных волокнах, которые мы, как инженеры, хотим иметь одинаковый диаметр. Изменяя переменные, такие как расстояние до коллектора, величина приложенного напряжения или скорость потока раствора, исследователи могут кардинально изменить общую архитектуру скаффолда.
Исторически исследования электропряденых волокнистых каркасов восходят, по крайней мере, к концу 1980-х годов, когда Саймон показал, что электропрядение может быть использовано для производства нано- и субмикронных волокнистых каркасов из полимерных растворов, специально предназначенных для использования в качестве субстратов для клеток и тканей in vitro . Это раннее использование электропряденых решеток для культивирования клеток и тканевой инженерии показало, что различные типы клеток будут прилипать к поликарбонатным волокнам и размножаться на них. Было отмечено, что в отличие от уплощенной морфологии, обычно наблюдаемой в 2D-культуре, клетки, выращенные на электропряденых волокнах, демонстрируют более округлую 3-мерную морфологию, обычно наблюдаемую в тканях in vivo . [58]
Поскольку большинство из вышеперечисленных методов ограничены, когда дело доходит до контроля пористости и размера пор, в тканевую инженерию были введены компьютерные методы проектирования и производства . Во-первых, трехмерная структура проектируется с использованием программного обеспечения CAD. Пористость может быть настроена с использованием алгоритмов в программном обеспечении. [59] Затем каркас реализуется с помощью струйной печати полимерных порошков или посредством моделирования наплавленного осаждения полимерного расплава. [60]
Исследование 2011 года, проведенное Эль-Аюби и соавторами, изучало «технику трехмерного черчения для производства ( биосовместимых и биоразлагаемых ) макропористых каркасов из поли-L-лактида с двумя различными размерами пор» посредством изготовления твердых свободных форм (SSF) с использованием автоматизированного проектирования (CAD) для изучения терапевтической замены суставного хряща как «альтернативы традиционному восстановлению тканей». [61] Исследование показало, что чем меньше размер пор в сочетании с механическим напряжением в биореакторе (для создания условий, подобных условиям in vivo), тем выше жизнеспособность клеток в потенциальной терапевтической функциональности за счет сокращения времени восстановления и повышения эффективности трансплантации. [61]
В исследовании 2012 года [62] Кох и др. сосредоточились на том, можно ли использовать лазерную биопечать (LaBP) для создания многоклеточных 3D-моделей в естественной матрице, и функционируют ли сгенерированные конструкции и формируют ли они ткань. LaBP организует небольшие объемы живых клеточных суспензий в заданные модели с высоким разрешением. [62] Исследование было успешным, исследователи предвидят, что «сгенерированные конструкции тканей могут быть использованы для тестирования in vivo путем имплантации их в модели животных » (14). На момент этого исследования была синтезирована только человеческая кожная ткань, хотя исследователи прогнозируют, что «интегрируя дополнительные типы клеток (например, меланоциты , клетки Шванна , клетки волосяных фолликулов) в напечатанную клеточную конструкцию, можно будет проанализировать поведение этих клеток в 3D- микросреде in vitro , аналогичной их естественной», что полезно для исследований в области открытия лекарств и токсикологии . [62]
Густафссон и др. [63] продемонстрировали свободно стоящие биоактивные мембраны размером в см, но толщиной всего 250 нм, которые были сформированы путем самосборки паучьего шелка на границе водного раствора. Мембраны уникальным образом сочетают в себе толщину в наномасштабе, биоразлагаемость, сверхвысокую деформацию и прочность, проницаемость для белков и способствуют быстрому прикреплению и пролиферации клеток. Они продемонстрировали выращивание когерентного слоя кератиноцитов. Эти наномембраны паучьего шелка также использовались для создания статической in vitro модели кровеносного сосуда. [64]
Регенерация тканей in situ определяется как имплантация биоматериалов (отдельно или в сочетании с клетками и/или биомолекулами) в дефект ткани с использованием окружающей микросреды организма в качестве естественного биореактора. [65] Этот подход нашел применение в регенерации костей, [66] позволяя формировать конструкции, засеянные клетками, непосредственно в операционной. [67]
Постоянная проблема в области тканевой инженерии — ограничения по массе транспорта. Сконструированные ткани обычно не имеют изначального кровоснабжения, что затрудняет получение имплантированными клетками достаточного количества кислорода и питательных веществ для выживания или правильного функционирования.
Методы самосборки, как было показано, являются перспективными методами для тканевой инженерии. Методы самосборки имеют преимущество, позволяя тканям развивать свой собственный внеклеточный матрикс, в результате чего ткань лучше воспроизводит биохимические и биомеханические свойства нативной ткани. Самосборка сконструированного суставного хряща была представлена Джерри Ху и Кириакосом А. Атанасиу в 2006 году [68] , и применение этого процесса привело к тому, что сконструированный хрящ приблизился по прочности к нативной ткани. [69] Самосборка является основной технологией, позволяющей заставить клетки, выращенные в лаборатории, собираться в трехмерные формы. Чтобы разбить ткани на клетки, исследователям сначала необходимо растворить внеклеточный матрикс, который обычно связывает их вместе. После того, как клетки изолированы, они должны образовать сложные структуры, из которых состоят наши естественные ткани.
Поверхность воздух-жидкость, созданная волнами Фарадея, исследуется как шаблон для сборки биологических объектов для восходящей тканевой инженерии. Этот жидкостный шаблон может быть динамически переконфигурирован за несколько секунд, а сборка на шаблоне может быть достигнута масштабируемым и параллельным образом. Сборка микромасштабных гидрогелей, клеток, микроносителей с нейронами, клеточных сфероидов в различные симметричные и периодические структуры была продемонстрирована с хорошей жизнеспособностью клеток. Формирование трехмерной нейронной сети было достигнуто после 14-дневного культивирования ткани. [70]
Возможно, можно печатать органы или, возможно, целые организмы, используя аддитивные технологии производства . Недавний инновационный метод строительства использует струйный механизм для печати точных слоев клеток в матрице термообратимого геля. Эндотелиальные клетки, клетки, которые выстилают кровеносные сосуды, были напечатаны в наборе сложенных колец. При инкубации они слились в трубку. [60] [71] Эта технология была названа «биопечатью» в этой области, поскольку она включает печать биологических компонентов в структуре, напоминающей орган фокусировки.
Область трехмерных и высокоточных моделей биологических систем является пионером многочисленных проектов и технологий, включая быстрый метод создания тканей и даже целых органов, включающий 3D-принтер, который может биопечатать каркас и клетки слой за слоем в рабочий образец ткани или орган. Устройство представлено в докладе TED доктором Энтони Атала, доктором медицины, директором Института регенеративной медицины Уэйк Форест , и профессором WH Boyce и заведующим кафедрой урологии в Университете Уэйк Форест, в котором почка печатается на сцене во время семинара, а затем представляется публике. [72] [73] [74] Ожидается, что эта технология позволит в будущем производить печень для трансплантации, а также теоретически для токсикологических и других биологических исследований.
В 2015 году многофотонная обработка (MPP) была использована для экспериментов in vivo путем создания искусственных хрящевых конструкций. Гистологическое исследование ex vivo показало, что определенная геометрия пор и предварительное выращивание хондроцитов (Cho) перед имплантацией значительно улучшают производительность созданных трехмерных каркасов. Достигнутая биосовместимость была сопоставима с коммерчески доступными коллагеновыми мембранами. Успешный результат этого исследования подтверждает идею о том, что гибридные органические-неорганические микроструктурированные каркасы с гексагональными порами в сочетании с посевом Cho могут быть успешно реализованы для инженерии хрящевой ткани. [75]
В последнее время тканевая инженерия продвинулась вперед с акцентом на васкуляризацию. Используя аддитивное производство на основе двухфотонной полимеризации, синтетические трехмерные сети микрососудов создаются из трубчатых гидрогелевых структур. Эти сети могут перфузировать ткани размером в несколько кубических миллиметров, обеспечивая долгосрочную жизнеспособность и рост клеток in vitro. Это нововведение знаменует собой значительный шаг вперед в тканевой инженерии, облегчая разработку сложных моделей человеческих тканей. [76]
В 2013 году с использованием 3-D каркаса Матригеля в различных конфигурациях были получены существенные панкреатические органоиды in vitro. Кластеры небольшого количества клеток размножались до 40 000 клеток в течение одной недели. Кластеры трансформируются в клетки, которые производят либо пищеварительные ферменты , либо гормоны, такие как инсулин , самоорганизуясь в разветвленные панкреатические органоиды, которые напоминают поджелудочную железу. [77]
Клетки чувствительны к окружающей среде, такой как жесткость геля и контакт с другими клетками. Отдельные клетки не процветают; для последующего развития органоида требовалось минимум четыре соседних клетки. Изменения состава среды производили либо полые сферы, в основном состоящие из предшественников поджелудочной железы, либо сложные органоиды, которые спонтанно подвергаются морфогенезу и дифференциации поджелудочной железы. Поддержание и расширение предшественников поджелудочной железы требуют активной сигнализации Notch и FGF , повторяя взаимодействия сигнальных ниш in vivo. [77]
Органоиды рассматривались как потенциально предлагающие мини-органы для тестирования лекарств и для запасных клеток, продуцирующих инсулин. [77]
Помимо 3D-каркасов Matrigel были разработаны и другие системы коллагенового геля. Каркасы из коллагена/гиалуроновой кислоты использовались для моделирования молочной железы in vitro при совместном культивировании эпителиальных и адипоцитарных клеток. Набор HyStem — это еще одна 3D-платформа, содержащая компоненты ECM и гиалуроновую кислоту, которая использовалась для исследований рака. Кроме того, компоненты гидрогеля можно химически модифицировать для содействия сшиванию и улучшения их механических свойств.
Во многих случаях создание функциональных тканей и биологических структур in vitro требует обширного культивирования для содействия выживанию, росту и стимулированию функциональности. В целом, основные потребности клеток должны поддерживаться в культуре, включая кислород , pH , влажность , температуру , питательные вещества и поддержание осмотического давления .
Культуры, созданные на основе тканевой инженерии, также представляют дополнительные проблемы в поддержании условий культивирования. В стандартной клеточной культуре диффузия часто является единственным средством транспортировки питательных веществ и метаболитов. Однако по мере того, как культура становится больше и сложнее, как в случае с созданными органами и целыми тканями, для поддержания культуры должны использоваться другие механизмы, такие как создание капиллярных сетей внутри ткани.

Другая проблема с культурой тканей заключается во введении соответствующих факторов или стимулов, необходимых для индукции функциональности. Во многих случаях простого поддержания культуры недостаточно. Иногда требуются факторы роста , гормоны , специфические метаболиты или питательные вещества, химические и физические стимулы. Например, некоторые клетки реагируют на изменения напряжения кислорода в рамках своего нормального развития, такие как хондроциты , которые должны адаптироваться к условиям низкого содержания кислорода или гипоксии во время развития скелета. Другие, такие как эндотелиальные клетки, реагируют на сдвиговое напряжение от потока жидкости, которое встречается в кровеносных сосудах . Механические стимулы, такие как импульсы давления, по-видимому, полезны для всех видов сердечно-сосудистой ткани, такой как сердечные клапаны, кровеносные сосуды или перикард.
В тканевой инженерии биореактор — это устройство, которое пытается имитировать физиологическую среду для стимулирования роста клеток или тканей in vitro. Физиологическая среда может состоять из множества различных параметров, таких как температура, давление, концентрация кислорода или углекислого газа или осмоляльность жидкой среды, и она может распространяться на все виды биологических, химических или механических стимулов. Поэтому существуют системы, которые могут включать приложение сил, таких как электромагнитные силы, механическое давление или давление жидкости к ткани. Эти системы могут быть двух- или трехмерными установками. Биореакторы могут использоваться как в академических, так и в промышленных приложениях. Также в продаже имеются биореакторы общего и специального назначения, которые могут обеспечивать статическую химическую стимуляцию или комбинацию химической и механической стимуляции.
Пролиферация и дифференциация клеток в значительной степени зависят от механических [78] и биохимических [79] сигналов в окружающей внеклеточной матриксной среде. Биореакторы обычно разрабатываются для воспроизведения определенной физиологической среды выращиваемой ткани (например, изгиб и сдвиг жидкости для роста сердечной ткани). [80] Это может позволить специализированным клеточным линиям процветать в культурах, воспроизводящих их родную среду, но также делает биореакторы привлекательными инструментами для культивирования стволовых клеток . Успешный биореактор на основе стволовых клеток эффективен для расширения стволовых клеток с однородными свойствами и/или для стимулирования контролируемой, воспроизводимой дифференциации в выбранные типы зрелых клеток. [81]
Существует множество биореакторов , разработанных для 3D-клеточных культур. Существуют небольшие пластиковые цилиндрические камеры, а также стеклянные камеры с регулируемой внутренней влажностью и влажностью, специально разработанные для выращивания клеток в трех измерениях. [82] Биореактор использует биоактивные синтетические материалы, такие как полиэтилентерефталатные мембраны, чтобы окружить сфероидальные клетки в среде, которая поддерживает высокий уровень питательных веществ. [83] [84] Их легко открывать и закрывать, так что клеточные сфероиды можно извлекать для тестирования, при этом камера способна поддерживать 100% влажность на всем протяжении. [85] Эта влажность важна для достижения максимального роста и функционирования клеток. Камера биореактора является частью более крупного устройства, которое вращается, чтобы обеспечить равномерный рост клеток в каждом направлении в трех измерениях. [85]
QuinXell Technologies, которая сейчас находится под управлением Quintech Life Sciences из Сингапура, разработала биореактор, известный как TisXell Biaxial Bioreactor, который специально разработан для целей тканевой инженерии. Это первый биореактор в мире, имеющий сферическую стеклянную камеру с двухосным вращением; в частности, для имитации вращения плода в утробе матери; что обеспечивает благоприятную среду для роста тканей. [86]
Несколько форм механической стимуляции также были объединены в один биореактор. Используя анализ экспрессии генов, одно академическое исследование обнаружило, что применение комбинации циклической деформации и ультразвуковой стимуляции к клеткам преостеобластов в биореакторе ускорило созревание и дифференциацию матрицы. [87] Технология этого комбинированного стимулирующего биореактора может быть использована для более быстрого и эффективного выращивания костных клеток в будущих клинических терапиях стволовыми клетками. [88]
Компания MC2 Biotek также разработала биореактор, известный как ProtoTissue [82] , который использует газообмен для поддержания высокого уровня кислорода в камере клетки; это усовершенствование предыдущих биореакторов, поскольку более высокий уровень кислорода помогает клетке расти и осуществлять нормальное клеточное дыхание . [89]
Активные направления исследований биореакторов включают увеличение масштабов производства и совершенствование физиологической среды, оба из которых могут повысить эффективность и действенность биореакторов в исследованиях или клиническом использовании. Биореакторы в настоящее время используются для изучения, среди прочего, терапии на уровне клеток и тканей, реакции клеток и тканей на определенные изменения физиологической среды, а также развития заболеваний и травм.
В 2013 году группа из Токийского университета разработала волокна, нагруженные клетками, длиной до метра и размером порядка 100 мкм . [90] Эти волокна были созданы с использованием микрофлюидного устройства , которое формирует двойной коаксиальный ламинарный поток. Каждый «слой» микрофлюидного устройства (клетки, посеянные в ECM , гидрогелевая оболочка и, наконец, раствор хлорида кальция). Посеянные клетки культивируются в гидрогелевой оболочке в течение нескольких дней, а затем оболочка удаляется с жизнеспособными клеточными волокнами. Различные типы клеток были вставлены в ядро ECM, включая миоциты , эндотелиальные клетки , волокна нервных клеток и волокна эпителиальных клеток . Затем эта группа показала, что эти волокна можно сплетать вместе для изготовления тканей или органов по механизму, похожему на текстильное ткачество . Волокнистые морфологии выгодны тем, что они представляют собой альтернативу традиционной конструкции каркаса, и многие органы (например, мышцы) состоят из волокнистых клеток.
Искусственный орган — это сконструированное устройство, которое может быть внетелесным или имплантированным для поддержки поврежденных или отказавших систем органов. [91] Биоискусственные органы обычно создаются с целью восстановления критических биологических функций, например, при замене больных сердец и легких, или для обеспечения радикального улучшения качества жизни, например, при использовании искусственной кожи у жертв ожогов. [91] Хотя некоторые примеры биоискусственных органов все еще находятся на стадии исследований из-за ограничений, связанных с созданием функциональных органов, другие в настоящее время используются в клинических условиях экспериментально и в коммерческих целях. [92]
Аппараты экстракорпоральной мембранной оксигенации (ЭКМО), также известные как аппараты для сердца и легких, являются адаптацией методов сердечно-легочного шунтирования , которые обеспечивают поддержку сердца и легких. [93] Он используется в основном для поддержки легких в течение длительного, но все же временного периода времени (1–30 дней) и позволяет восстановиться после обратимых заболеваний. [93] Роберт Бартлетт известен как отец ЭКМО и провел первое лечение новорожденного с использованием аппарата ЭКМО в 1975 году. [94]
Кожа
Кожа, созданная методом тканевой инженерии, — это тип биоискусственного органа, который часто используется для лечения ожогов, язв диабетической стопы или других крупных ран, которые не могут хорошо заживать сами по себе. Искусственная кожа может быть изготовлена из аутотрансплантатов, аллотрансплантатов и ксенотрансплантатов. Аутотрансплантатная кожа берется из собственной кожи пациента, что позволяет дерме быстрее заживать, а донорский участок можно повторно забирать несколько раз. Кожа для аллотрансплантата часто берется из кожи трупа и в основном используется для лечения жертв ожогов. Наконец, ксенотрансплантатная кожа берется от животных и обеспечивает временную структуру заживления для кожи. Она помогает в регенерации дермы, но не может стать частью кожи хозяина. [23] Кожа, созданная методом тканевой инженерии, теперь доступна в коммерческих продуктах. Integra, изначально использовавшаяся только для лечения ожогов, состоит из коллагеновой матрицы и хондроитинсульфата, которые можно использовать в качестве замены кожи. Хондроитинсульфат функционирует как компонент протеогликанов, который помогает формировать внеклеточный матрикс. [95] Integra может быть повторно заселена и реваскуляризирована, сохраняя при этом свою дермальную коллагеновую архитектуру, что делает ее биоискусственным органом . [96] Dermagraft, еще один коммерческий продукт для кожи, созданный с помощью тканевой инженерии, состоит из живых фибробластов. Эти фибробласты размножаются и производят факторы роста, коллаген и белки ECM, которые помогают формировать грануляционную ткань. [97]
Поскольку число пациентов, ожидающих пересадки сердца, постоянно растет с течением времени, а число пациентов в списке ожидания превышает доступность органов, [98] искусственные органы, используемые в качестве заместительной терапии при терминальной сердечной недостаточности, помогли бы облегчить эту трудность. Искусственные сердца обычно используются для промежуточного этапа трансплантации сердца или могут применяться в качестве заместительной терапии при терминальной сердечной недостаточности. [99] Полное искусственное сердце (TAH), впервые представленное доктором Владимиром П. Демиховым в 1937 году, [100] стало идеальной альтернативой. С тех пор оно было разработано и усовершенствовано как механический насос, который обеспечивает долгосрочную поддержку кровообращения и заменяет больные или поврежденные желудочки сердца, которые не могут должным образом перекачивать кровь, восстанавливая, таким образом, легочный и системный кровоток. [101] Некоторые из современных TAH включают AbioCor, одобренное FDA устройство, которое состоит из двух искусственных желудочков и их клапанов и не требует подкожных соединений, и показано пациентам с бивентрикулярной сердечной недостаточностью. В 2010 году SynCardia выпустила портативный драйвер Freedom, который позволяет пациентам иметь портативное устройство, не привязываясь к больнице. [102]
Хотя пересадка почек возможна, почечную недостаточность чаще лечат с помощью искусственной почки. [103] Первые искусственные почки и большинство из тех, которые используются в настоящее время, являются экстракорпоральными, например, с помощью гемодиализа, который фильтрует кровь напрямую, или перитонеального диализа, который фильтрует через жидкость в брюшной полости. [103] [104] Для того чтобы способствовать биологическим функциям почки, таким как выработка метаболических факторов или гормонов, некоторые искусственные почки включают почечные клетки. [103] [104] Был достигнут прогресс в том, чтобы сделать эти устройства меньше и более транспортабельными или даже имплантируемыми. Одна проблема, с которой еще предстоит столкнуться в этих меньших устройствах, — это противодействие ограниченному объему и, следовательно, ограниченным возможностям фильтрации. [103]
Биокаффолды также были введены для обеспечения каркаса, на котором может быть восстановлена нормальная ткань почек. Эти каркасы включают естественные каркасы (например, децеллюляризованные почки, [105] коллагеновый гидрогель, [106] [107] или фиброин шелка [108] ), синтетические каркасы (например, поли[молочная-со-гликолевая кислота] [109] [110] или другие полимеры) или комбинацию двух или более природных и синтетических каркасов. Эти каркасы могут быть имплантированы в организм либо без обработки клеток, либо после периода посева стволовых клеток и инкубации. Исследования in vitro и in vivo проводятся для сравнения и оптимизации типа каркаса и для оценки того, способствует ли посев клеток перед имплантацией жизнеспособности, регенерации и эффективной функции почек. Недавний систематический обзор и метаанализ сравнили результаты опубликованных исследований на животных и выявили, что улучшенные результаты сообщаются при использовании гибридных (смешанных) каркасов и посева клеток; [111] Однако метаанализ этих результатов не согласуется с оценкой описательных результатов обзора. Поэтому целесообразны дальнейшие исследования с участием более крупных животных и новых каркасов, а также более прозрачное воспроизведение предыдущих исследований.
Биомиметика — это область, которая направлена на создание материалов и систем, которые копируют те, что присутствуют в природе. [112] В контексте тканевой инженерии это распространенный подход, используемый инженерами для создания материалов для этих приложений, которые сопоставимы с нативными тканями с точки зрения их структуры, свойств и биосовместимости. Свойства материалов во многом зависят от физических, структурных и химических характеристик этого материала. Впоследствии биомиметический подход к проектированию систем станет значимым в интеграции материалов, и будет необходимо достаточное понимание биологических процессов и взаимодействий. Репликация биологических систем и процессов также может использоваться при синтезе биоинспирированных материалов для достижения условий, которые производят желаемый биологический материал. Поэтому, если синтезируется материал, имеющий те же характеристики биологических тканей как структурно, так и химически, то в идеале синтезированный материал будет иметь схожие свойства. Эта техника имеет обширную историю, берущую начало от идеи использования природных явлений в качестве дизайнерского вдохновения для решений человеческих проблем. Многие современные достижения в области технологий были вдохновлены природой и природными системами, включая самолеты, автомобили, архитектуру и даже промышленные системы. Достижения в области нанотехнологий инициировали применение этой техники к микро- и наномасштабным проблемам, включая тканевую инженерию. Эта техника использовалась для разработки синтетических костных тканей, сосудистых технологий, материалов для каркасов и методов интеграции, а также функционализированных наночастиц. [112]
В 2018 году ученые из Университета Брандейса сообщили о своем исследовании мягкого материала, встроенного в химические сети, которые могут имитировать плавное и скоординированное поведение нервной ткани. Это исследование финансировалось Исследовательской лабораторией армии США . [113] Исследователи представили экспериментальную систему нейронных сетей, теоретически смоделированную как системы реакции-диффузии . Внутри сетей находился массив узорчатых реакторов, каждый из которых выполнял реакцию Белоусова-Жаботинского (БЖ). Эти реакторы могли функционировать в масштабах нанолитров. [114]
Исследователи утверждают, что вдохновением для их проекта послужило движение ленточного угря . Движения угря контролируются электрическими импульсами, определяемыми классом нейронных сетей, называемых центральными генераторами паттернов . Центральные генераторы паттернов функционируют в автономной нервной системе, контролируя такие функции организма, как дыхание, движение и перистальтика . [115]
Качества реактора, которые были спроектированы, включали топологию сети, граничные условия , начальные условия, объем реактора, силу связи и синаптическая полярность реактора (будь то его поведение ингибирующим или возбуждающим). [115] Была спроектирована система эмульсии BZ с твердым эластомером полидиметилсилоксаном (PDMS). Как свето-, так и бромпроницаемый PDMS были представлены как жизнеспособные методы создания кардиостимулятора для нейронных сетей. [114]
Историю рынка тканевой инженерии можно разделить на три основные части: время до краха рынка биотехнологий в начале 2000-х, крах и время после него.
Самый ранний прогресс в исследованиях тканевой инженерии был достигнут в США. Это связано с менее строгими правилами в отношении исследований стволовых клеток и более доступным финансированием, чем в других странах. Это приводит к созданию академических стартапов, многие из которых пришли из Гарварда или MIT . Примерами являются BioHybrid Technologies, основатель которой Билл Чик поступил в Гарвардскую медицинскую школу и сосредоточился на создании искусственной поджелудочной железы. Другим примером может служить Organogenesis Inc., основатель которой поступил в MIT и работал над продуктами для инженерии кожи. Другими компаниями, связанными с MIT, являются TEI Biosciences, Therics и Guilford Pharmaceuticals. [8] Возобновление интереса к биотехнологиям в 1980-х годах привело к тому, что многие частные инвесторы вкладывали средства в эти новые технологии, хотя бизнес-модели этих ранних стартапов часто были не очень ясны и не представляли пути к долгосрочной прибыльности. [116] Государственные спонсоры были более сдержанны в своем финансировании, поскольку тканевая инженерия считалась высокорискованной инвестицией. [8]
В Великобритании рынок начал развиваться медленнее, хотя правила исследования стволовых клеток также не были строгими. Это в основном связано с тем, что больше инвесторов были менее склонны вкладывать средства в эти новые технологии, которые считались высокорискованными инвестициями. [116] Еще одной проблемой, с которой столкнулись британские компании, было заставить NHS платить за их продукцию. Это особенно связано с тем, что NHS проводит анализ экономической эффективности всех поддерживаемых продуктов. Новые технологии часто не преуспевают в этом отношении. [116]
В Японии ситуация с регулированием была совершенно иной. Во-первых, выращивание клеток разрешалось только в больничных условиях, а во-вторых, ученым, работающим в государственных университетах, не разрешалось работать вне рамок трудовой деятельности до 1998 года. Более того, японским властям требовалось больше времени на одобрение новых лекарств и методов лечения, чем их американским и европейским коллегам. [116]
По этим причинам в первые дни японского рынка основное внимание уделялось получению продуктов, которые уже были одобрены в других местах в Японии, и их продаже. В отличие от рынка США, ранними игроками в Японии были в основном крупные фирмы или дочерние компании таких крупных фирм, как J-TEC, Menicon и Terumo, а не небольшие стартапы. [116] После изменений в регулировании в 2014 году, которые позволили выращивать клетки вне больничных условий, скорость исследований в Японии возросла, и японские компании также начали разрабатывать собственные продукты. [116]
Вскоре после большого бума начали появляться первые проблемы. Возникали проблемы с одобрением продуктов FDA , а если они одобрялись, часто возникали трудности с тем, чтобы заставить страховщиков платить за продукты и чтобы их приняли поставщики медицинских услуг. [116] [117]
Например, у компании Organogenesis возникли проблемы с маркетингом ее продукции и интеграцией ее продукции в систему здравоохранения. Это частично связано со сложностями обращения с живыми клетками и возросшими трудностями, с которыми сталкиваются врачи при использовании этих продуктов по сравнению с традиционными методами. [116]
Другим примером может служить продукт Advanced Tissue Sciences Dermagraft skin, который не смог создать достаточно высокого спроса без возмещений от страховщиков. Причинами этого были ценник в $4000 и то обстоятельство, что Advanced Tissue Sciences также боролись за то, чтобы их продукт был известен врачам. [116]
Приведенные выше примеры демонстрируют, как компании боролись за получение прибыли. Это, в свою очередь, привело к тому, что инвесторы потеряли терпение и прекратили дальнейшее финансирование. В результате несколько компаний по тканевой инженерии, такие как Organogenesis и Advanced Tissue Sciences, подали заявление о банкротстве в начале 2000-х годов. В то время они были единственными, у кого на рынке были коммерческие продукты для кожи. [117]
Технологии обанкротившихся или борющихся компаний часто покупались другими компаниями, которые продолжали разработку в рамках более консервативных бизнес-моделей. [117] Примерами компаний, которые продали свою продукцию после сворачивания, были Curis [117] и Intercytex [116] .
Многие компании отказались от своих долгосрочных целей по разработке полностью функциональных органов в пользу продуктов и технологий, которые могли бы принести прибыль в краткосрочной перспективе. [116] Примерами такого рода продуктов являются продукты в косметической и испытательной промышленности.
В других случаях, как в случае с Advanced Tissue Sciences, основатели создавали новые компании. [116]
В 2010-х годах нормативная база также начала способствовать более быстрому выходу на рынок, особенно в США, поскольку FDA создало новые центры и пути, специально нацеленные на продукты, получаемые из живых клеток, такие как Центр оценки и исследования биологических препаратов . [116]
Первые продукты тканевой инженерии начали приносить коммерческую прибыль в 2010-х годах. [117]
В Европе регулирование в настоящее время разделено на три области регулирования: медицинские устройства , лекарственные средства и биологические препараты . Продукты тканевой инженерии часто имеют гибридную природу, поскольку они часто состоят из клеток и поддерживающей структуры. В то время как некоторые продукты могут быть одобрены как лекарственные средства, другим необходимо получить одобрение как медицинским устройствам. [118] Дерксен объясняет в своей диссертации, что исследователи тканевой инженерии иногда сталкиваются с регулированием, которое не соответствует характеристикам тканевой инженерии. [119]
В Европе были замечены новые режимы регулирования, которые решают эти проблемы. [120] Объяснение трудностей в поиске консенсуса в области регулирования в этом вопросе дано в исследовании, проведенном в Великобритании. [118] Авторы связывают эти проблемы с тесной связью и пересечением с другими технологиями, такими как ксенотрансплантация . Поэтому регулирующие органы не могут заниматься ею отдельно. [118] Регулирование еще больше осложняется этическими противоречиями, связанными с этой и смежными областями исследований (например, противоречия по поводу стволовых клеток , этика трансплантации органов ). Тот же опрос, что упомянут выше [118], показывает на примере аутологичной трансплантации хряща, что конкретная технология может считаться «чистой» или «загрязненной» одним и тем же социальным субъектом.
Два регулирующих движения наиболее актуальны для тканевой инженерии в Европейском Союзе . Это Директива 2004/23/EC о стандартах качества и безопасности для получения и обработки человеческих тканей [121] , которая была принята Европейским парламентом в 2004 году, и предлагаемый регламент Human Tissue-Engineered Products. Последний был разработан под эгидой Европейской комиссии DG Enterprise и представлен в Брюсселе в 2004 году. [122]