Прогрессирующая оссифицирующая фибродисплазия ( / ˌ f aɪ b r oʊ d ɪ ˈ s p l eɪ ʒ ( i ) ə ɒ ˈ s ɪ f ɪ k æ n z p r ə ˈ ɡ r ɛ s ɪ v ə / ; [1] сокр. ФОП ), также называемая болезнью Мюнхмейера или ранее миозитом оссифицирующим прогрессивным , является чрезвычайно редким заболеванием соединительной ткани , при котором волокнистая соединительная ткань, такая как мышцы , сухожилия и связки, превращается в костную ткань ( окостенение ). Это единственное известное заболевание, при котором одна система органов превращается в другую. [2] Это тяжелое, инвалидизирующее заболевание, не поддающееся лечению.
FOP вызывается мутацией гена ACVR1 . Мутация влияет на механизм восстановления организма, заставляя фиброзную ткань , включая мышцы , сухожилия и связки, окостенеть либо спонтанно, либо при повреждении в результате травмы. Во многих случаях, в противном случае, незначительные травмы могут привести к тому, что суставы станут постоянно сращенными, поскольку образуются новые кости, заменяющие поврежденную мышечную ткань. Это новое костное образование (известное как «гетеротопическое окостенение») в конечном итоге образует вторичный скелет и постепенно ограничивает способность пациента двигаться. Кость, образованная в результате этого процесса, идентична «нормальной» кости, просто в неправильных местах. Косвенные доказательства свидетельствуют о том, что заболевание может вызывать деградацию суставов отдельно от характерного для него роста костей. [3]
Хирургическое удаление лишнего костного нароста, как было показано, заставляет организм «ремонтировать» пораженную область дополнительной костью. Хотя скорость роста костей может различаться в зависимости от пациента, в конечном итоге это состояние делает больных обездвиженными, поскольку новая кость заменяет мускулатуру и срастается с существующим скелетом. Это принесло ФОП прозвище « болезнь каменного человека ». [4]
По неизвестным причинам дети, рожденные с ФОП, часто имеют неправильно сформированные большие пальцы ног , иногда отсутствует сустав или, в других случаях, просто проявляется заметная опухоль на малом суставе. [5] Первое «вспышка», которая приводит к образованию кости ФОП, обычно происходит до 10 лет. [5] Рост костей обычно прогрессирует от верхней части тела вниз, так же, как кости растут у плодов. У ребенка с ФОП обычно развиваются дополнительные кости, начиная с шеи, затем в плечах, руках, области груди и, наконец, в ступнях. [6]
В частности, окостенение обычно сначала наблюдается в дорсальной, аксиальной, краниальной и проксимальной областях тела. Позже заболевание прогрессирует в вентральной, аппендикулярной, каудальной и дистальной областях. [5] Однако это не обязательно происходит в этом порядке из-за обострений, вызванных травмой. Часто опухолевидные уплотнения, характерные для обострения заболевания, появляются внезапно.
Рост костей, происходящий во время обострений, может привести к потере подвижности пораженных суставов, включая, если затронута челюсть/нижняя челюсть, невозможность полностью открыть рот, что ограничивает речь и прием пищи. Конкретное проявление обострения этого состояния в суставах стопы/голеностопного сустава может привести к ограниченной возможности поставить ногу на землю. [ необходима цитата ] Рост костей также может привести к иммобилизации бедра или колена, что влияет на способность человека ходить. Дополнительное образование костей вокруг грудной клетки ограничивает расширение легких и диафрагмы, вызывая респираторные осложнения. [5]
Поскольку это расстройство встречается невероятно редко, встречаясь только у 1 из 2 миллионов человек, его можно ошибочно диагностировать как рак или фиброз . Это может привести к тому, что врачи назначат биопсию , что может усугубить рост кости ФОП. [7] Наличие деформированных пальцев ног или больших пальцев рук у тех, кто родился с ФОП, помогает отличить это расстройство от других проблем со скелетом. [8]
При правильном медицинском лечении медиана выживаемости составляет 40 лет. Однако задержка диагностики, травмы и инфекции могут снизить продолжительность жизни. [9]
FOP вызывается аутосомно- доминантным аллелем на хромосоме 2q23-24. [10] Аллель имеет вариабельную экспрессивность , но полную пенетрантность . Большинство случаев вызваны спонтанной мутацией в гаметах ; большинство людей с FOP не могут или предпочитают не иметь детей. Похожее, но менее катастрофическое заболевание — фиброзная дисплазия , которая вызывается постзиготической мутацией .
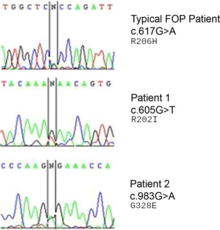
За заболевание отвечает мутация в гене ACVR1 (также известном как активин-подобная киназа 2 (ALK2)). [10] ACVR1 кодирует рецептор активина типа 1, рецептор BMP типа 1. Мутация вызывает замену кодона 206 с аргинина на гистидин в белке ACVR1. [11] [12] Эта замена вызывает аномальную активацию ACVR1, что приводит к трансформации соединительной ткани и мышечной ткани во вторичный скелет. Это заставляет эндотелиальные клетки трансформироваться в мезенхимальные стволовые клетки , а затем в кость. [13] Обычно ген ACVR1 кодирует трансмембранную киназу рецептора активина типа 1 , которая связывает рецепторы BMP (BMPR типа I и BMPR типа II) для передачи сигналов хондрогенеза . BMP относятся к суперсемейству белков, известных как белки трансформирующего фактора роста бета ( TGF- β ). Связывание белка ACVR1 с рецепторами BMP запускает каскад сигналов, который имеет решающее значение для индукции формирования эндохондральной кости во время развития, а также для гомеостаза скелета и тканей . [14]
ФОП — это аутосомно-доминантное заболевание. Таким образом, ребенок пораженного гетерозиготного родителя и здорового родителя имеет 50% вероятность быть пораженным. Два пораженных человека могут произвести здоровых детей. Два здоровых человека могут произвести пораженное потомство в результате мутации гена. Гомозиготная доминантная форма более тяжелая, чем гетерозиготная форма. [15]
Белок, вызывающий окостенение, обычно дезактивируется ингибиторным белком после того, как кости плода формируются в утробе матери, но у пациентов с ФОП белок продолжает работать. Аберрантное формирование костей у пациентов с ФОП происходит, когда поврежденные соединительные ткани или мышечные клетки в местах повреждения или роста неправильно экспрессируют фермент для восстановления костей во время апоптоза (саморегулируемая гибель клеток), в результате чего лимфоциты содержат избыток костного морфогенетического белка 4 (BMP4), предоставляемого во время реакции иммунной системы. Кость, которая получается, возникает независимо от нормального скелета, образуя свои собственные дискретные скелетные элементы. Эти элементы, однако, могут сливаться с нормальной скелетной костью. [16] Диафрагма, язык и экстраокулярные мышцы остаются в этом процессе, как и сердечная и гладкая мускулатура . [5] Поскольку неправильный фермент остается неразрешенным в рамках иммунного ответа, организм продолжает предоставлять неправильные лимфоциты, содержащие BMP4. BMP4 — это продукт, который способствует развитию скелета у нормального эмбриона. [17]
Ген ACVR1 кодирует рецептор костного морфогенетического белка (BMP); этот ген мутирует при FOP. Он отвечает за рост и развитие костей и мышц. Типичная мутация, R202H, заставляет ингибитор FKBP1A менее прочно связываться с активационной GS-петлей. [18] В результате ACVR1 не выключается эффективно, и происходит чрезмерный рост костей и хрящей, а также сращение суставов. [19] Атипичные мутации, затрагивающие другие остатки, работают аналогичным образом. В некоторых случаях рецептор может в конечном итоге сигнализировать о том, что он активен, не будучи связанным со своим активирующим лигандом. [20]
Большинство случаев ФОП являются результатом новой генной мутации: у этих людей не было истории этого конкретного расстройства в их семье. Есть некоторые случаи, когда человек унаследовал мутацию от одного из пораженных родителей. [19]
Как правило, ФОП можно диагностировать с помощью рентгенограмм . Ранняя диагностика этого расстройства с помощью рентгенологии очень важна, чтобы избежать ненужных инвазивных исследований, таких как биопсия . Самая маленькая или тривиальная травма или внутримышечные инъекции могут усилить прогрессирование заболевания через воспаление, отсюда и благоприятность рентгенологии. Клиницисты должны знать об этой редкой сущности, так как ее часто ошибочно диагностируют как рак или другие доброкачественные образования, такие как инфекция, что приводит к биопсии, которая часто может ускорить прогрессирование заболевания. [21]
Вспышки заболевания можно оценить клинически по повышенным уровням щелочной фосфатазы и костно-специфической щелочной фосфатазы . [22] Другим явным признаком ФОП является укороченный большой палец ноги с деформированной дистальной первой плюсневой костью и отсутствующей или аномальной первой фалангой и/или межфаланговым суставом. [23]
В то время как ФОП остается неизлечимым, многообещающим прорывом является одобренное лечение Sohonos ( паловаротен ). [24] Примечательно, что попытки хирургического удаления кости у пациента с ФОП могут привести к взрывному росту новой кости. [25] Во время анестезии люди с ФОП могут столкнуться с трудностями при интубации , рестриктивным заболеванием легких и изменениями в системе электропроводности сердца . [26] Следует избегать действий, которые повышают риск падения или повреждения мягких тканей, поскольку даже незначительная травма может спровоцировать гетеротопическую оссификацию . [27]
Хотя эффективных методов окончательного лечения этого расстройства не существует, существуют периодические методы лечения, такие как противовоспалительные препараты для подавления воспаления в результате обострений или воспаления из-за повреждения мышц. В настоящее время хирургическое вмешательство обычно не рекомендуется для людей с ФОП, поскольку оно может спровоцировать быстрое формирование костей в местах разрезов или там, где были наложены швы на мышцы или соединительную ткань. Можно рассмотреть возможность проведения спасающей жизнь операции, однако разработка хирургического плана с участием специалиста по ФОП может считаться наилучшей практикой. Хирургическое устранение контрактур суставов, как правило, безуспешно и сопряжено с риском новой гетеротопической оссификации, вызванной травмой. [28]
По состоянию на 2017 год [update]во всем мире было подтверждено около 800 случаев ФОП, что делает ФОП одним из самых редких известных заболеваний. [29] По оценкам, заболеваемость ФОП составляет 0,5 случая на миллион человек и затрагивает все этнические группы. [29]
Медицинские отчеты, описывающие людей, страдающих ФОП, датируются доктором Гаем Патеном в 1692 году. [29] ФОП изначально назывался миозитом оссифицирующим прогрессирующим и считалось, что он вызывается мышечным воспалением ( миозитом ), которое вызывает образование костей. [29] Заболевание было переименовано Виктором А. МакКьюсиком в 1970 году после открытия того, что мягкие ткани, помимо мышц (например, связки ), также поражаются процессом заболевания. [29]
Самый известный случай ФОП — случай Гарри Истлака (1933–1973). Его заболевание начало развиваться в возрасте десяти лет, и к моменту его смерти от пневмонии в ноябре 1973 года, за шесть дней до его 40-летия, его тело полностью окостенело, и он мог двигать только губами. Истлак никогда не встречал другого человека с ФОП в течение своей жизни. [30]
Истлак пожертвовал свое тело науке, и его скелет сейчас находится в Музее Мюттера в Филадельфии , и оказался бесценным источником информации в изучении ФОП. Другой человек с ФОП, Кэрол Орзел (20 апреля 1959 г. – февраль 2018 г.), также пожертвовала свое тело музею, и ее скелет был выставлен там, рядом со скелетом Истлака, в феврале 2019 г. [31] [32]
Клинические испытания изотретиноина , этидроната с пероральными кортикостероидами и пергексилина малеата не смогли продемонстрировать эффективность, хотя изменчивое течение заболевания и малая распространенность вызывают неопределенность. [22]
Несколько фармацевтических компаний, специализирующихся на редких заболеваниях, в настоящее время находятся на разных стадиях исследования различных терапевтических подходов к лечению ФОП.
В августе 2015 года Управление по разработке орфанных препаратов Управления по контролю за продуктами питания и лекарственными средствами США (FDA) предоставило компании La Jolla Pharmaceuticals статус орфанного препарата для двух новых соединений для лечения ФОП. Соединения представляют собой низкомолекулярные ингибиторы протеинкиназы , предназначенные для селективной блокировки ACVR1 (ALK2). [38]
В августе 2015 года компания Clementia Pharmaceuticals также начала набор детей (в возрасте от 6 лет и старше) в клиническое исследование II фазы паловаротена для лечения ФОП. [39] Доклинические исследования показали, что паловаротен, агонист гамма-рецептора ретиноевой кислоты, блокировал аномальное формирование костей у животных моделей путем ингибирования вторичных мессенджерных систем в пути BMP. [40] Clementia лицензировала паловаротен у Roche Pharmaceuticals, которая ранее оценивала это соединение у более чем 800 человек, включая здоровых добровольцев и пациентов с хронической обструктивной болезнью легких. Паловаротен получил статус Fast Track от FDA и статус орфанного препарата для лечения ФОП как от FDA, так и от Европейского агентства по лекарственным средствам (EMA). [39]
В сентябре 2015 года компания Regeneron объявила о новом взгляде на механизм заболевания, включающего активацию рецептора ACVR1 активином А. В 2016 году компания инициировала исследование фазы 1 своего антитела к активину, REGN 2477 , на здоровых добровольцах; исследование фазы 2 на пациентах с ФОП было проведено в 2017 году. [41]
Другой потенциальный терапевтический подход включает аллель-специфическую РНК-интерференцию , которая нацелена на мутировавшую мРНК для деградации, сохраняя при этом нормальную экспрессию гена ACVR1. [42]
Дальнейшее изучение механизмов гетеротопического костеобразования при ФОП может помочь в разработке методов лечения других заболеваний, связанных с образованием внескелетной костной ткани.
Фибро/адипогенные предшественники (FAP) могут быть типом клеток, вызывающих заболевание, ответственным за эктопическое образование костей, зависящее от активина А, как в мышцах, так и в сухожилиях мышей, имеющих мутацию ACVR1(R206H), вызывающую FOP. [43]
В декабре 2019 года компания Ipsen частично приостановила проведение клинических исследований для лиц младше 14 лет из-за сообщений о раннем сращении зон роста.
Недавно, в 2021 году [update], потенциальный терапевтический кандидат, саракатиниб , находится на III фазе клинических испытаний в качестве мощного ингибитора гетеротопической оссификации у мышей дикого типа и мышей с мутацией ACVR1. [44]