Фосфоглюкомутаза ( КФ 5.4.2.2) — фермент , который переносит фосфатную группу на мономере α-D- глюкозы из положения 1 в положение 6 в прямом направлении или из положения 6 в положение 1 в обратном направлении.
Точнее, он облегчает взаимопревращение глюкозо-1-фосфата и глюкозо-6-фосфата .
После того, как гликогенфосфорилаза катализирует фосфоролитическое расщепление остатка глюкозы из полимера гликогена , освобожденная глюкоза имеет фосфатную группу на своем 1-углероде. Эта молекула глюкозо-1-фосфата сама по себе не является полезным метаболическим промежуточным продуктом, но фосфоглюкомутаза катализирует превращение этого глюкозо-1-фосфата в глюкозо-6-фосфат (см. ниже механизм этой реакции).
Метаболическая судьба глюкозо-6-фосфата зависит от потребностей клетки в момент его генерации. Если клетка испытывает нехватку энергии, то глюкозо-6-фосфат пойдет по гликолитическому пути , в конечном итоге давая две молекулы аденозинтрифосфата . Если клетка нуждается в биосинтетических промежуточных продуктах, то глюкозо-6-фосфат войдет в пентозофосфатный путь , где он подвергнется серии реакций, чтобы дать рибозы и/или НАДФН , в зависимости от клеточных условий.
Если гликогенолиз происходит в печени, глюкозо-6-фосфат может быть преобразован в глюкозу ферментом глюкозо-6-фосфатазой ; глюкоза, вырабатываемая в печени, затем высвобождается в кровоток для использования в других органах. Мышечные клетки, напротив, не имеют фермента глюкозо-6-фосфатазы, поэтому они не могут делиться своими запасами гликогена с остальным телом.
Фосфоглюкомутаза также действует противоположным образом, когда уровень глюкозы в крови высок. В этом случае фосфоглюкомутаза катализирует превращение глюкозо-6-фосфата (который легко образуется из глюкозы под действием гексокиназы ) в глюкозо-1-фосфат.
Этот глюкозо-1-фосфат затем может реагировать с UTP , чтобы дать UDP-глюкозу в реакции, катализируемой UDP-глюкозо-пирофосфорилазой . При активации инсулином гликогенсинтаза продолжит отщеплять глюкозу от комплекса UDP-глюкозы на полимер гликогена.
Фосфоглюкомутаза влияет на сдвиг фосфорильной группы, обменивая фосфорильную группу с субстратом . [1] Эксперименты по изотопной маркировке подтвердили, что эта реакция протекает через промежуточный продукт глюкозо-1,6-бисфосфат . [2]
Первым шагом в прямой реакции является перенос фосфорильной группы от фермента к глюкозо-1-фосфату, образуя глюкозо-1,6-бисфосфат и оставляя дефосфорилированную форму фермента. [2] Затем фермент подвергается быстрой диффузионной переориентации, чтобы правильно расположить 1-фосфат промежуточного бисфосфата относительно дефосфорилированного фермента. [3] Соотношения субстрат-скорость и тесты на индуцированный транспорт показали, что дефосфорилированный фермент затем облегчает перенос фосфорильной группы от глюкозо-1,6-бисфосфатного промежуточного продукта к ферменту, регенерируя фосфорилированную фосфоглюкомутазу и давая глюкозо-6-фосфат (в прямом направлении). [4] [5] Более поздние структурные исследования подтвердили, что единственным местом в ферменте, которое становится фосфорилированным и дефосфорилированным, является кислород остатка серина активного центра (см. диаграмму ниже). [6] [7] Для ферментативной активности необходим двухвалентный ион металла , обычно магния или кадмия , и было показано, что он образует комплекс непосредственно с фосфорильной группой, этерифицированной в активном центре серина. [8]
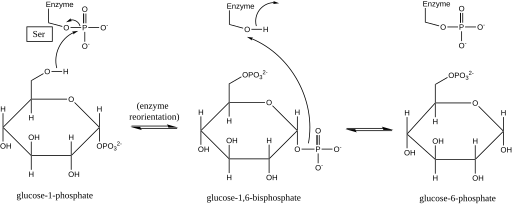
Это образование промежуточного продукта глюкозо-1,6-бисфосфата аналогично взаимопревращению 2-фосфоглицерата и 3-фосфоглицерата , катализируемому фосфоглицератмутазой , в котором в качестве промежуточного продукта образуется 2,3-бисфосфоглицерат . [9]

В то время как мышечная фосфоглюкомутаза кролика послужила прототипом для большей части выяснения структуры этого фермента, новые кристаллические структуры, полученные из бактерий, демонстрируют многие из тех же определяющих характеристик. [10] Каждый мономер фосфоглюкомутазы можно разделить на четыре домена последовательности, I-IV, на основе пространственной конфигурации фермента по умолчанию (см. изображение справа). [11]
Каждый мономер состоит из четырех отдельных структурных единиц α/β, каждая из которых содержит одну из четырех нитей в β-слое каждого мономера и состоит только из остатков в заданном домене последовательности (см. изображение справа). [11] Захоронение активного центра (включая Ser-116, критический остаток фермента, который фосфорилируется и дефосфорилируется) в гидрофобной внутренней части фермента служит для исключения воды из контрпродуктивного гидролиза критических фосфоэфирных связей, при этом позволяя субстрату получать доступ к активному центру. [12]
Человеческие мышцы содержат два изофермента фосфоглюкомутазы с почти идентичными каталитическими свойствами, PGM I и PGM II. [13] Одна или другая из этих форм отсутствует у некоторых людей врожденно. [14] Дефицит PGM1 известен как синдром PGM1-CDG или CDG типа 1t (CDG1T), ранее известный как болезнь накопления гликогена типа 14 (GSD XIV). [15] [16] Заболевание является как гликогенозом, так и врожденным нарушением гликозилирования. [17] [18] Это также метаболическая миопатия и врожденная ошибка углеводного обмена . [19]
Дефицит PGM является чрезвычайно редким состоянием, которое не имеет набора хорошо охарактеризованных физиологических симптомов. Это состояние может быть обнаружено с помощью исследования in vitro анаэробного гликолиза , которое выявляет блок на пути к производству молочной кислоты после глюкозо-1-фосфата, но до глюкозо-6-фосфата. [20] Существует две формы PGM1-CDG: 1.) исключительно миогенная и 2.) мультисистемная (включая мышцы). [16]
Обычный путь образования гликогена из глюкозы крови блокируется, так как без фосфоглюкомутазы глюкозо-6-фосфат не может преобразоваться в глюкозо-1-фосфат. Однако альтернативный путь из галактозы может образовывать гликоген путем преобразования галактозы → галактозо-1-фосфат → глюкозо-1-фосфат. Это позволяет образовываться гликогену, но без фосфоглюкомутазы глюкозо-1-фосфат не может преобразоваться в глюкозо-6-фосфат для гликолиза. Это вызывает аномальное накопление гликогена в мышечных клетках, наблюдаемое при биопсии мышц. [16] [21]
Хотя фенотип и тяжесть заболевания сильно различаются, к общим симптомам относятся: непереносимость физических нагрузок , гипераммониемия , вызванная физическими нагрузками , аномальное накопление гликогена в биопсийном материале мышц, повышенный уровень сывороточной КК, аномальный сывороточный трансферрин (потеря полных N-гликанов), низкий рост, расщелина неба, раздвоенный язычок и гепатопатия. [16] [21]
Феномен « второго дыхания » можно наблюдать у некоторых, но не у всех, людей, измеряя частоту сердечных сокращений во время занятий на беговой дорожке. [16] [22] В состоянии покоя мышечные клетки зависят от глюкозы в крови и свободных жирных кислот; при нагрузке необходим мышечный гликоген вместе с глюкозой в крови и свободными жирными кислотами. [23] [24] Зависимость от мышечного гликогена увеличивается при аэробных упражнениях высокой интенсивности и всех анаэробных упражнениях. [23] [24]
Не имея возможности создавать АТФ из запасенного мышечного гликогена, во время упражнений существует низкий резервуар АТФ (АДФ>АТФ). При таких обстоятельствах частота сердечных сокращений и дыхания несоразмерно увеличивается с учетом интенсивности упражнений, в попытке максимизировать доставку кислорода и переносимого кровью топлива к мышечной клетке. Свободные жирные кислоты являются самой медленной из биоэнергетических систем организма для производства АТФ путем окислительного фосфорилирования , примерно за 10 минут. [23] Облегчение симптомов непереносимости упражнений, включая падение частоты сердечных сокращений по крайней мере на 10 ударов в минуту при движении с той же скоростью на беговой дорожке, примерно после 10 минут аэробных упражнений называется « вторым дыханием », когда из свободных жирных кислот вырабатывается повышенное количество АТФ.
Другим следствием низкого запаса АТФ (АДФ>АТФ) во время упражнений, из-за невозможности вырабатывать АТФ из мышечного гликогена, является повышенное использование реакции миокиназы (аденилаткиназы) и цикла пуриновых нуклеотидов . Реакция миокиназы производит АМФ (2 АДФ → АТФ + АМФ), а затем цикл пуриновых нуклеотидов использует АМФ и производит больше АМФ вместе с фумаратом (фумарат затем преобразуется и производит АТФ посредством окислительного фосфорилирования). Аммиак (NH3 ) является побочным продуктом в цикле пуриновых нуклеотидов, когда АМФ превращается в ИМФ. Во время неишемического теста на предплечье у лиц с PGM1-CDG наблюдается вызванное упражнениями повышенное содержание аммиака в сыворотке (гипераммониемия) и нормальное повышение уровня лактата в сыворотке. [16] [18] [19]
Исследования других заболеваний, имеющих гликолитический блок, показали во время ишемических и неишемических тестов на предплечье, что не только аммиак повышается, но после упражнений также повышается уровень инозина, гипоксантина и мочевой кислоты в сыворотке. [25] [26] Эти исследования подтвердили, что когда упражнения прекращаются или из других видов топлива (таких как свободные жирные кислоты) вырабатывается достаточное количество АТФ, то резервуар АТФ нормализуется, а накопление АМФ и других нуклеотидов преобразуется в нуклеозиды и покидает мышечную клетку, чтобы превратиться в мочевую кислоту , что известно как миогенная гиперурикемия. АМФ → ИМФ → Инозин → Гипоксантин → Ксантин → Мочевая кислота. К сожалению, исследования PGM1-CDG проверяли только уровень аммиака и лактата в сыворотке, поэтому в настоящее время точно неизвестно, испытывают ли люди с PGM1-CDG также миогенную гиперурикемию. [16] [18] [19]