Фотоокислительно-восстановительный катализ — это раздел фотохимии , использующий перенос одного электрона . Фотоокислительно-восстановительные катализаторы обычно извлекаются из трех классов материалов: комплексы переходных металлов, органические красители и полупроводники . В то время как органические фотоокислительно-восстановительные катализаторы доминировали в течение 1990-х и начала 2000-х годов, [1] сегодня чаще используются растворимые комплексы переходных металлов.
Сенсибилизаторы поглощают свет, чтобы дать окислительно-восстановительно-активные возбужденные состояния. Для многих сенсибилизаторов на основе металлов возбуждение реализуется как перенос заряда от металла к лиганду , при котором электрон перемещается от металла (например, ad-орбитали) к орбитали, локализованной на лигандах (например, π*-орбитали ароматического лиганда). Это начальное возбужденное электронное состояние релаксирует в синглетное возбужденное состояние посредством внутренней конверсии , процесса, в котором энергия рассеивается в виде колебательной энергии (тепла), а не в виде электромагнитного излучения. Это синглетное возбужденное состояние может релаксировать далее двумя различными процессами: катализатор может флуоресцировать , излучая фотон и возвращаясь в исходное синглетное основное состояние, или он может перейти в триплетное возбужденное состояние с самой низкой энергией (состояние, в котором два неспаренных электрона имеют одинаковый спин) посредством второго безызлучательного процесса, называемого интерсистемной конверсией .
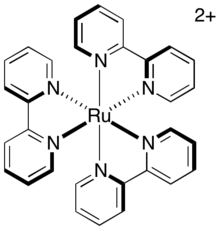
Прямая релаксация возбужденного триплета в основное состояние, называемая фосфоресценцией , требует как испускания фотона, так и инверсии спина возбужденного электрона. Этот путь медленный, поскольку он запрещен по спину , поэтому возбужденное состояние триплета имеет существенное среднее время жизни. Для распространенного фотосенсибилизатора, трис-(2,2'-бипиридил)рутения (сокращенно [Ru(bipy) 3 ] 2+ или [Ru(bpy) 3 ] 2+ ), время жизни возбужденного состояния триплета составляет приблизительно 1100 нс. Этого времени жизни достаточно для других путей релаксации (в частности, путей переноса электронов), чтобы произойти до распада катализатора в его основное состояние.

Долгоживущее триплетное возбужденное состояние, доступное фотовозбуждению, является как более мощным восстановителем , так и более мощным окислителем , чем основное состояние катализатора. Поскольку сенсибилизатор координационно насыщен, перенос электронов должен происходить посредством процесса внешней сферы , где электроны туннелируют между катализатором и субстратом.
Теория Маркуса о переносе электронов во внешней сфере предсказывает, что такой туннельный процесс будет происходить быстрее всего в системах, где перенос электронов термодинамически выгоден (т. е. между сильными восстановителями и окислителями) и где перенос электронов имеет низкий внутренний барьер.
Внутренний барьер электронного переноса вытекает из принципа Франка–Кондона , утверждающего, что электронный переход происходит быстрее при большем перекрытии между начальным и конечным электронными состояниями. Интерпретируемый в общих чертах, этот принцип предполагает, что барьер электронного перехода связан со степенью, в которой система стремится реорганизоваться. Для электронного перехода с системой барьер связан с «перекрытием» между начальной и конечной волновыми функциями возбужденного электрона, т. е. степенью, в которой электрон должен «переместиться» при переходе.
При межмолекулярном переносе электронов аналогичную роль играет степень, в которой ядра стремятся переместиться в ответ на изменение их нового электронного окружения. Сразу после переноса электронов ядерное расположение молекулы, ранее равновесное, теперь представляет собой колебательно-возбужденное состояние и должно релаксировать к своей новой равновесной геометрии. Жесткие системы, геометрия которых не сильно зависит от степени окисления, поэтому испытывают меньше колебательного возбуждения во время переноса электронов и имеют более низкий собственный барьер. Фотокатализаторы, такие как [Ru(bipy) 3 ] 2+ , удерживаются в жестком расположении плоскими бидентатными лигандами, расположенными в октаэдрической геометрии вокруг металлического центра. Поэтому комплекс не претерпевает значительной реорганизации во время переноса электронов. Поскольку перенос электронов этих комплексов происходит быстро, он, вероятно, происходит в течение периода активного состояния катализатора, т. е. в течение жизни триплетного возбужденного состояния.

Для восстановления основного состояния катализатор должен участвовать во втором внешнесферном переносе электронов. Во многих случаях этот перенос электронов происходит со стехиометрическим двухэлектронным восстановителем или окислителем, хотя в некоторых случаях этот шаг включает второй реагент.
Поскольку этап переноса электронов каталитического цикла происходит из возбужденного состояния триплета, он конкурирует с фосфоресценцией как путь релаксации. Эксперименты Штерна–Фольмера измеряют интенсивность фосфоресценции при изменении концентрации каждого возможного гасящего агента. Когда концентрация фактического гасящего агента изменяется, это влияет на скорость переноса электронов и степень фосфоресценции. Эта связь моделируется уравнением:
Здесь I и I 0 обозначают интенсивность излучения с присутствием и без присутствия гасящего агента, k q — константу скорости процесса гашения, τ 0 — время жизни возбужденного состояния в отсутствие гасящего агента, а [Q] — концентрацию гасящего агента. Таким образом, если время жизни возбужденного состояния фоторедокс-катализатора известно из других экспериментов, константу скорости гашения в присутствии одного компонента реакции можно определить, измерив изменение интенсивности излучения при изменении концентрации гасящего агента.
Окислительно-восстановительные потенциалы фотоокислительно-восстановительных катализаторов должны быть согласованы с другими компонентами реакции. В то время как окислительно-восстановительные потенциалы основного состояния легко измеряются с помощью циклической вольтамперометрии или других электрохимических методов, измерение окислительно-восстановительного потенциала электронно-возбужденного состояния не может быть выполнено напрямую этими методами. [2] Однако существуют два метода, которые позволяют оценить окислительно-восстановительные потенциалы возбужденного состояния, и один метод существует для прямого измерения этих потенциалов. Чтобы оценить окислительно-восстановительные потенциалы возбужденного состояния, один метод заключается в сравнении скоростей переноса электронов из возбужденного состояния в ряд реагентов основного состояния, окислительно-восстановительные потенциалы которых известны. Более распространенным методом оценки этих потенциалов является использование уравнения, разработанного Ремом и Веллером, которое описывает потенциалы возбужденного состояния как поправку к потенциалам основного состояния:
В этих формулах E* 1/2 представляет собой потенциал восстановления или окисления возбужденного состояния, E 1/2 представляет собой потенциал восстановления или окисления основного состояния, E 0,0 представляет собой разницу в энергии между нулевыми колебательными состояниями основного и возбужденного состояний, а w r представляет собой работу выхода , электростатическое взаимодействие, которое возникает из-за разделения зарядов, которое происходит во время переноса электронов между двумя химическими видами. Энергия возбуждения ноль-ноль, E 0,0, обычно аппроксимируется соответствующим переходом в спектре флуоресценции. Этот метод позволяет вычислять приблизительные окислительно-восстановительные потенциалы возбужденного состояния из более легко измеряемых окислительно-восстановительных потенциалов основного состояния и спектроскопических данных.
Прямое измерение окислительно-восстановительных потенциалов возбужденного состояния возможно с помощью метода, известного как фазово-модулированная вольтамперометрия . Этот метод работает путем освещения электрохимической ячейки светом для генерации желаемых возбужденных видов, но для модуляции интенсивности света синусоидально , так что концентрация возбужденных видов не является постоянной. Фактически, концентрация возбужденных видов в ячейке должна изменяться точно в фазе с интенсивностью света, падающего на электрохимическую ячейку. Если потенциал, приложенный к ячейке, достаточно силен для того, чтобы произошел перенос электронов, изменение концентрации окислительно-восстановительно-компетентного возбужденного состояния можно измерить как переменный ток (AC). Кроме того, сдвиг фазы переменного тока относительно интенсивности падающего света соответствует среднему времени жизни возбужденного вида до того, как он вступит в процесс переноса электронов.
Для быстрого доступа доступны графики окислительно-восстановительных потенциалов для наиболее распространенных фотоокислительно-восстановительных катализаторов. [3]
Относительную восстановительную и окислительную природу этих фотокатализаторов можно понять, рассмотрев электроотрицательность лигандов и металлический центр каталитического комплекса. Более электроотрицательные металлы и лиганды могут стабилизировать электроны лучше, чем их менее электроотрицательные аналоги. Поэтому комплексы с более электроотрицательными лигандами являются более окислительными, чем комплексы с менее электроотрицательными лигандами. Например, лиганды 2,2'-бипиридин и 2,2'-фенилпиридин являются изоэлектронными структурами, содержащими одинаковое количество и расположение электронов. Фенилпиридин заменяет один из атомов азота в бипиридине на атом углерода. Углерод менее электроотрицателен, чем азот, поэтому он удерживает электроны менее прочно. Поскольку остальная часть молекулы лиганда идентична, а фенилпиридин удерживает электроны менее прочно, чем бипиридин, он является более сильным донором электронов и менее электроотрицательным как лиганд. Следовательно, комплексы с фенилпиридиновыми лигандами являются более сильными восстанавливающими и менее сильными окислительными, чем эквивалентные комплексы с бипиридиновыми лигандами.
Аналогично, фторированный лиганд фенилпиридина более электроотрицателен, чем фенилпиридин, поэтому комплексы с фторсодержащими лигандами сильнее окисляют и слабее восстанавливают, чем эквивалентные незамещенные комплексы фенилпиридина. Электронное влияние металлического центра на комплекс сложнее, чем эффект лиганда. Согласно шкале электроотрицательности Полинга , как рутений, так и иридий имеют электроотрицательность 2,2. Если бы это был единственный фактор, относящийся к окислительно-восстановительным потенциалам, то комплексы рутения и иридия с теми же лигандами должны были бы быть одинаково мощными фотоокислительно-восстановительными катализаторами. Однако, учитывая уравнение Рема-Веллера, спектроскопические свойства металла играют роль в определении окислительно-восстановительных свойств возбужденного состояния. [4] В частности, параметр E 0,0 связан с длиной волны излучения комплекса и, следовательно, с размером сдвига Стокса — разницей в энергии между максимальным поглощением и испусканием молекулы. Обычно комплексы рутения имеют большие сдвиги Стокса и, следовательно, низкие длины волн излучения энергии и малые энергии возбуждения ноль-ноль по сравнению с комплексами иридия. По сути, в то время как комплексы рутения в основном состоянии могут быть сильными восстановителями, комплекс возбужденного состояния является гораздо менее сильным восстановителем или окислителем, чем его эквивалентный комплекс иридия. Это делает иридий предпочтительным для разработки общих органических превращений, поскольку более сильные окислительно-восстановительные потенциалы возбужденного катализатора позволяют использовать более слабые стехиометрические восстановители и окислители или использовать менее реактивные субстраты. [4]
Идентичность противоиона
Часто бывает так, что эти фотокатализаторы уравновешиваются противоионом, как в случае с примером комплекса трис-(2,2'-бипиридил)рутения , который сопровождается двумя анионами, чтобы уравновесить общий заряд ионной пары до нуля. Однако существуют фоторедокс-катализаторы на основе переходных металлов, которые существуют без противоиона, такие как трис(2-фенилпиридин)иридий (часто сокращенно Ir(ppy) 3 ). Значимость этих противоионов зависит от ионной ассоциации между фоторедокс-катализатором и его противоионом(ами) и зависит от растворителя, используемого для реакции. Хотя фотофизические свойства, такие как окислительно-восстановительный потенциал, энергия возбуждения и электроотрицательность лиганда, часто считались ключевыми параметрами для использования и реакционной способности этих комплексов, было показано, что идентичность противоиона играет значительную роль в растворителях с низкой полярностью . [5] [6] В частности, было показано, что наличие прочно связанного противоиона увеличивает скорость переноса электронов при восстановлении субстрата, но значительно снижает скорость переноса электронов при окислении субстрата. Считается, что это происходит потому, что противоион по существу «блокирует» перенос электронов в фотоокислительно-восстановительный комплекс, экранируя более положительно заряженную область комплекса; тогда как наличие прочной ассоциации противоиона отодвигает электронную плотность дальше от металлического центра фотоокислительно-восстановительного катализатора, облегчая ее перенос от катализатора (конечно, это применимо только к случаю, когда фотоокислительно-восстановительный катализатор является катионом , а противоион — анионом ) . Таким образом, идентичность противоиона является дополнительным параметром, который следует учитывать при разработке новых фотоокислительно-восстановительных реакций.
Самые ранние применения фотоокислительно-восстановительного катализа для восстановительного дегалогенирования были ограничены узким диапазоном субстрата или конкурирующим восстановительным сопряжением. [7]
Неактивированные связи углерод-йод могут быть восстановлены с использованием сильно восстанавливающего фотокатализатора трис-(2,2'- фенилпиридин )иридия (Ir(ppy) 3 ). [8] Повышенный восстановительный потенциал Ir(ppy) 3 по сравнению с [Ru(bipy) 3 ] 2+ позволяет осуществлять прямое восстановление связи углерод-йод без взаимодействия со стехиометрическим восстановителем. Таким образом, иридиевый комплекс переносит электрон на субстрат, вызывая фрагментацию субстрата и окисляя катализатор до степени окисления Ir(IV). Окисленный фотокатализатор возвращается в исходную степень окисления путем окисления реакционной добавки.

Подобно реакциям радикального дегалогенирования, опосредованным оловом, фотокаталитическое восстановительное дегалогенирование может быть использовано для инициирования каскадных циклизаций [9]

Ионы иминия являются мощными электрофилами, полезными для создания связей CC в сложных молекулах. Однако конденсация аминов с карбонильными соединениями с образованием ионов иминия часто неблагоприятна, иногда требуя жестких условий дегидратации. Таким образом, альтернативные методы получения ионов иминия, в частности, путем окисления из соответствующего амина, являются ценным инструментом синтеза. Ионы иминия могут быть получены из активированных аминов с использованием Ir(dtbbpy)(ppy) 2PF6 в качестве фотоокислительно-восстановительного катализатора. [10] Предполагается, что это превращение происходит путем окисления амина до катион -радикала аминия возбужденным фотокатализатором. За этим следует перенос атома водорода на сверхстехиометрический окислитель, такой как трихлорметильный радикал (CCl3 для образования иона иминия). Затем ион иминия гасится реакцией с нуклеофилом. Были исследованы родственные превращения аминов с широким спектром других нуклеофилов , таких как цианид ( реакция Штрекера ), эфиры силил енолов ( реакция Манниха ), диалкилфосфаты, аллилсиланы (аза- реакция Сакураи ), индолы ( реакция Фриделя-Крафтса ) и ацетилениды меди. [11] [12] [13] [14] [15]

Аналогичное фотоокислительно-восстановительное образование иминиевых ионов было достигнуто также с использованием чисто органических фотоокислительно-восстановительных катализаторов, таких как бенгальский розовый и эозин Y. [ 16] [17] [18]
Асимметричный вариант этой реакции использует эквиваленты ацильного нуклеофила, полученные катализом N-гетероциклического карбена . [19] Этот метод реакции обходит проблему плохой энантиоиндукции от хиральных фотоокислительно-восстановительных катализаторов, перемещая источник энантиоселективности в N-гетероциклический карбен.
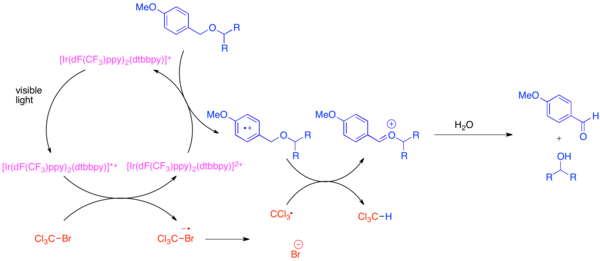
Разработка ортогональных защитных групп является проблемой в органическом синтезе, поскольку эти защитные группы позволяют различать каждый экземпляр общей функциональной группы, такой как гидроксильная группа, во время синтеза сложной молекулы. Очень распространенной защитной группой для гидроксильной функциональной группы является пара -метоксибензиловый (ПМБ) эфир. Эта защитная группа химически похожа на менее богатый электронами бензиловый эфир. Обычно селективное расщепление эфира ПМБ в присутствии бензилового эфира использует сильные стехиометрические окислители, такие как 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ) или нитрат аммония церия (CAN). Эфиры ПМБ гораздо более восприимчивы к окислению, чем бензиловые эфиры, поскольку они более богаты электронами. Избирательное снятие защиты с эфиров PMB может быть достигнуто за счет использования бис-(2-(2',4'-дифторфенил)-5-трифторметилпиридин)-(4,4'-дитретбутилбипиридин)иридий(III) гексафторфосфата (Ir[dF(CF 3 )ppy] 2 (dtbbpy)PF 6 ) и мягкого стехиометрического окислителя, такого как бромтрихлорметан, BrCCl 3 . [20] Фотовозбужденный иридиевый катализатор достаточно восстанавливает, чтобы фрагментировать бромтрихлорметан с образованием трихлорметильного радикала, бромид-аниона и комплекса Ir(IV). Электронобедные фторированные лиганды делают иридиевый комплекс достаточно окисляющимся, чтобы принять электрон из богатого электронами арена, такого как эфир PMB. После окисления арена он легко участвует в переносе атома водорода с трихлорметильным радикалом с образованием хлороформа и оксокарбениевого иона, который легко гидролизуется с образованием свободного гидроксида. Было показано, что эта реакция ортогональна многим обычным защитным группам, когда для нейтрализации полученного HBr добавляется основание.
Циклоприсоединения и другие перициклические реакции являются мощными преобразованиями в органическом синтезе из-за их потенциала быстро генерировать сложные молекулярные архитектуры и, в частности, из-за их способности устанавливать несколько соседних стереоцентров в высококонтролируемой манере. Однако только определенные циклоприсоединения разрешены в термических условиях в соответствии с правилами орбитальной симметрии Вудворда-Хоффмана или другими эквивалентными моделями, такими как пограничная теория молекулярных орбиталей (FMO) или модель Дьюара-Циммермана. Циклоприсоединения, которые не разрешены термически, такие как [2+2] циклоприсоединение, могут быть включены путем фотохимической активации реакции. В некаталитических условиях эта активация требует использования ультрафиолетового света высокой энергии , способного изменять орбитальные популяции реагирующих соединений. В качестве альтернативы сообщалось, что металлические катализаторы, такие как кобальт и медь, катализируют термически запрещенные [2+2] циклоприсоединения посредством одноэлектронного переноса.
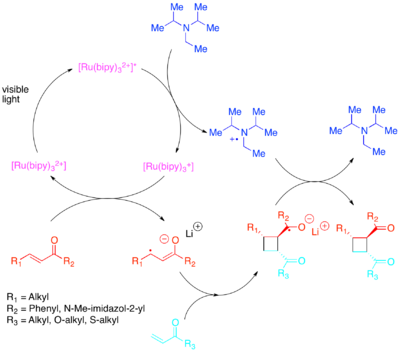
Требуемое изменение заселенности орбиталей может быть достигнуто путем переноса электронов с помощью фотокатализатора, чувствительного к более низкоэнергетическому видимому свету. [21] [22] [23] [24] [25] Юн продемонстрировал эффективные внутри- и межмолекулярные [2+2] циклоприсоединения активированных олефинов : в частности, енонов и стиролов. Было обнаружено, что еноны, или олефины с низким содержанием электронов, реагируют по радикально-анионному пути, используя диизопропилэтиламин в качестве временного источника электронов. Было обнаружено, что для этого переноса электронов [Ru(bipy) 3 ] 2+ является эффективным фотокатализатором. Анионная природа циклизации оказалась решающей: проведение реакции в кислоте, а не с противоионом лития благоприятствовало нециклоприсоединению. [26] Чжао и др. также обнаружили, что для халконов с противоионом самария доступен еще один другой путь циклизации . [27] Наоборот, было обнаружено, что стиролы, богатые электронами, реагируют через механизм радикального катиона, используя метилвиологен или молекулярный кислород в качестве временного стока электронов. В то время как [Ru(bipy) 3 ] 2+ оказался компетентным катализатором для внутримолекулярных циклизаций с использованием метилвиологена , его нельзя было использовать с молекулярным кислородом в качестве стока электронов или для межмолекулярных циклизаций. Для межмолекулярных циклизаций Юн и др. обнаружили, что более сильный окисляющий фотокатализатор [Ru(bpm) 3 ] 2+ и молекулярный кислород обеспечивают каталитическую систему, лучше подходящую для доступа к радикальному катиону, необходимому для осуществления циклоприсоединения. [Ru(bpz) 3 ] 2+ , еще более сильный окисляющий фотокатализатор, оказался проблематичным, поскольку, хотя он мог катализировать желаемое [2+2] циклоприсоединение, он также был достаточно силен, чтобы окислить циклоаддукт и катализировать ретро-[2+2] реакцию. Это сравнение фотокатализаторов подчеркивает важность настройки окислительно-восстановительных свойств фотокатализатора на реакционную систему, а также демонстрирует ценность полипиридильных соединений как лигандов из-за легкости, с которой их можно модифицировать для регулировки окислительно-восстановительных свойств их комплексов.

Фоторедокс-катализируемые [2+2] циклоприсоединения также могут быть осуществлены с использованием трифенилпирилиевого органического фоторедокс-катализатора. [28]

В дополнение к термически запрещенному [2+2] циклоприсоединению, фоторедокс-катализ может быть применен к [4+2] циклизации ( реакция Дильса-Альдера ). Бисеноны, подобные субстратам, используемым для фоторедокс-циклизации [2+2], но с более длинным линкером, соединяющим две енонные функциональные группы, подвергаются внутримолекулярным радикальным анионным гетеро-реакциям Дильса-Альдера быстрее, чем [2+2] циклоприсоединение. [29]

Аналогично, стиролы, богатые электронами, участвуют во внутри- или межмолекулярных циклизациях Дильса-Альдера через механизм радикального катиона. [30] [31] [Ru(bipy) 3 ] 2+ был компетентным катализатором для межмолекулярных, но не внутримолекулярных циклизаций Дильса-Альдера. Эта катализируемая фоторедоксом реакция Дильса-Альдера позволяет осуществлять циклоприсоединение между двумя электронно-несовпадающими субстратами. Нормальный электронный спрос для реакции Дильса-Альдера требует, чтобы богатый электронами диен реагировал с олефином с низким содержанием электронов (или «диенофилом»), в то время как обратная реакция Дильса-Альдера с высоким содержанием электронов происходит между противоположным случаем бедного электронами диена и очень богатого электронами диенофила. Случай фоторедокса, поскольку он происходит по другому механизму, чем термическая реакция Дильса-Альдера, допускает циклоприсоединение между богатым электронами диеном и богатым электронами диенофилом, открывая доступ к новым классам аддуктов Дильса-Альдера.

Синтетическая ценность реакции Дильса-Альдера стирола, катализируемой фоторедокс-процессом, была продемонстрирована с помощью полного синтеза природного продукта гейциамида А. [30] Этот синтез показывает, что термическая реакция Дильса-Альдера благоприятствует нежелательному региоизомеру, но реакция, катализируемая фоторедокс-процессом, дает желаемый региоизомер с улучшенным выходом.

Органокатализ — это подраздел катализа, который исследует потенциал органических малых молекул в качестве катализаторов, в частности, для энантиоселективного создания хиральных молекул. Одной из стратегий в этом подразделе является использование хиральных вторичных аминов для активации карбонильных соединений. В этом случае конденсация амина с карбонильным соединением генерирует нуклеофильный енамин . Хиральный амин сконструирован таким образом, что одна сторона енамина стерически экранирована и только незащищенная сторона свободна для реакции. Несмотря на силу этого подхода для катализа энантиоселективной функционализации карбонильных соединений, некоторые ценные превращения, такие как каталитическое энантиоселективное α-алкилирование альдегидов , оставались неуловимыми. Сочетание органокатализа и фотоокислительно-восстановительных методов обеспечивает каталитическое решение этой проблемы. [32] В этом подходе для α-алкилирования альдегидов [Ru(bipy) 3 ] 2+ восстановительно фрагментирует активированный алкилгалогенид, такой как броммалонат или фенацилбромид , который затем может присоединиться к каталитически полученному енамину энантиоселективным образом. Затем окисленный фотокатализатор окислительно гасит полученный α-аминорадикал с образованием иминиевого иона, который гидролизуется с образованием функционализированного карбонильного соединения. Было показано, что это фотоокислительно-восстановительное превращение механистически отличается от другого органокаталитического радикального процесса, называемого катализом с однократно занятой молекулярной орбиталью (SOMO). Катализ SOMO использует сверхстехиометрический нитрат аммония церия (CAN) для окисления каталитически полученного енамина до соответствующего катион-радикала, который затем может присоединиться к подходящему партнеру по связыванию, такому как аллилсилан. Этот тип механизма исключен для реакции фотокаталитического алкилирования, поскольку, в то время как катион-радикал енамина, как было обнаружено, циклизуется на боковых олефинах и открывает циклопропановые радикальные часы в катализе SOMO, эти структуры были нереакционноспособны в фотоокислительно-восстановительной реакции.
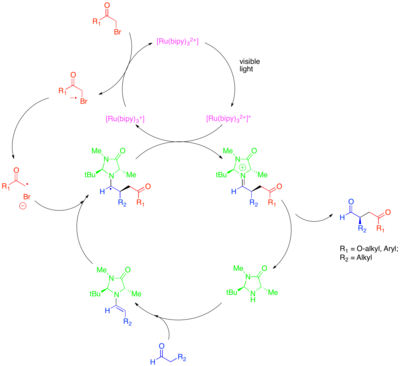
Это преобразование включает алкилирование с другими классами активированных алкилгалогенидов, представляющих синтетический интерес. В частности, использование фотокатализатора Ir(dtbbpy)(ppy) 2 + позволяет проводить энантиоселективное α-трифторметилирование альдегидов, в то время как использование Ir(ppy) 3 позволяет проводить энантиоселективное связывание альдегидов с бензильными бромидами с низким содержанием электронов. [33] [34] Цайтлер и др. также исследовали продуктивное слияние фоторедокс- и органокаталитических методов для достижения энантиоселективного алкилирования альдегидов. [35] Тот же хиральный имидазолидиноновый органокатализатор использовался для образования енамина и введения хиральности. Однако вместо рутениевого или иридиевого комплекса использовался органический фоторедокс-катализатор Eosin Y.
Прямое β-арилирование насыщенных альдегидов и кетонов может быть осуществлено посредством комбинации фотоокислительно-восстановительных и органокаталитических методов. [36] Предыдущий метод для достижения прямой β-функционализации насыщенного карбонила состоит из одностадийного процесса, оба из которых катализируются вторичным аминным органокатализатором: стехиометрическое восстановление альдегида с помощью IBX с последующим добавлением активированного алкильного нуклеофила в бета-положение полученного еналя . [ 37] Это преобразование, которое, как и другие фотоокислительно-восстановительные процессы, происходит по радикальному механизму, ограничивается добавлением высокоэлектрофильных аренов в бета-положение. Серьезные ограничения на область действия аренового компонента в этой реакции обусловлены в первую очередь необходимостью в ареновом радикальном анионе, который достаточно стабилен, чтобы не реагировать напрямую с енаминовым или енаминовым радикальным катионом. В предлагаемом механизме активированный фотоокислительно-восстановительный катализатор гасится окислительно электронно-дефицитным ареном, таким как 1,4-дицианобензол . Затем фотокатализатор окисляет енаминовые виды, временно образующиеся при конденсации альдегида с вторичным амином-сокатализатором, таким как оптимальный изопропилбензиламин. Образующийся енаминовый радикальный катион обычно реагирует как 3 π-электронная система, но из-за стабильности партнеров по радикальному связыванию депротонирование β-метиленовой позиции приводит к образованию 5 π-электронной системы с сильным радикальным характером на вновь доступном β-углероде. Хотя эта реакция основана на использовании вторичного амина-органокатализатора для получения енаминовых видов, которые окисляются в предлагаемом механизме, энантиоселективного варианта этой реакции не существует.

Развитие этого прямого β-арилирования альдегидов привело к родственным реакциям для β-функционализации циклических кетонов. В частности, β-арилирование циклических кетонов было достигнуто в схожих условиях реакции, но с использованием азепана в качестве вторичного аминного сокатализатора. Фотокаталитическая «гомо-альдольная» реакция работает для циклических кетонов, позволяя связывать бета-положение кетона с ипсо-углеродом арилкетонов, таких как бензофенон и ацетофенон . [38] В дополнение к азепановому сокатализатору, эта реакция требует использования более сильно восстанавливающего фотоокислительно-восстановительного катализатора Ir(ppy) 3 и добавления гексафторарсенида лития (LiAsF 6 ) для содействия одноэлектронному восстановлению арилкетона.
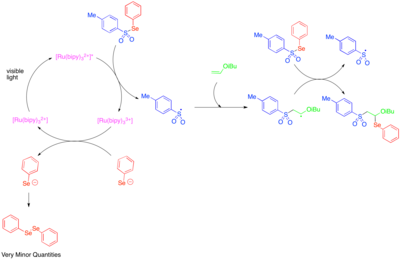
Использование фоторедокс-катализа для получения реакционноспособных гетероатом-центрированных радикалов было впервые исследовано в 1990-х годах. [39] Было обнаружено, что [Ru(bipy) 3 ] 2+ катализирует фрагментацию тозилфенилселенида до фенилселенолата-аниона и тозильного радикала, и что механизм распространения радикальной цепи допускает добавление тозильного радикала и фенилселено-радикала через двойную связь алкилвиниловых эфиров с высоким содержанием электронов. Поскольку фенилселенолата-анион легко окисляется до дифенилдиселенида, наблюдаемые низкие количества дифенилдиселенида были приняты как указание на то, что фоторедокс-катализируемая фрагментация тозилфенилселенида была важна только как этап инициирования, и что большая часть реакционной способности была обусловлена радикальным цепным процессом.
Гетероароматические присоединения к олефинам включают многокомпонентные реакции окси- и аминотрифторметилирования. [40] [41] Эти реакции используют реагент Умемото, сульфониевую соль, которая служит электрофильным источником трифторметильной группы и которая, как известно, реагирует через одноэлектронный путь переноса. Таким образом, одноэлектронное восстановление реагента Умемото высвобождает трифторметильный радикал, который присоединяется к реактивному олефину. Впоследствии одноэлектронное окисление алкильного радикала, полученного в результате этого присоединения, дает катион, который может быть захвачен водой, спиртом или нитрилом. Для достижения высоких уровней региоселективности эта реакционная способность была исследована в основном для стиролов, которые смещены в сторону образования бензильного радикального промежуточного соединения.

Гидротрифторметилирование стиролов и алифатических алкенов может быть осуществлено с использованием органического фотоокислительно-восстановительного катализатора мезитилакридиния и реагента Ланглуа в качестве источника радикала CF 3 . [42] В этой реакции было обнаружено, что трифторэтанол и субстехиометрические количества ароматического тиола, такого как метилтиосалицилат, используемые в тандеме, служат наилучшим источником водородного радикала для завершения каталитического цикла.
Внутримолекулярные гидроэтерификации и гидроаминирования протекают с антимарковниковской селективностью. [43] [44] Один механизм вызывает одноэлектронное окисление олефина, захватывая радикальный катион боковой гидроксильной или аминогруппой и гася полученный алкильный радикал переносом атома водорода от высоколабильного донорного вида. Расширения этой реакционной способности на межмолекулярные системы привели к i) новому синтетическому пути к сложным тетрагидрофуранам с помощью «полярно-радикальной кроссоверной циклоприсоединения» (PRCC-реакции) аллилового спирта с олефином, и ii) антимарковниковскому присоединению карбоновых кислот к олефинам. [45] [46]
Сульфоксимидирование аренов, богатых электронами, возможно благодаря фотоокислительно-восстановительному катализу. [47]