
Взаимодействие катион-π представляет собой нековалентное молекулярное взаимодействие между поверхностью богатой электронами π-системы (например, бензола , этилена , ацетилена ) и соседним катионом (например, Li + , Na + ). Это взаимодействие является примером нековалентной связи между монополем (катионом) и квадруполем (π-системой). Энергии связи значительны: значения в фазе раствора находятся в пределах того же порядка, что и водородные связи и солевые мостики . Подобно этим другим нековалентным связям, взаимодействия катион-π играют важную роль в природе, особенно в структуре белка , молекулярном распознавании и ферментативном катализе . Этот эффект также наблюдался и использовался в синтетических системах. [1] [2]

Бензол , модельная π-система, не имеет постоянного дипольного момента , поскольку вклады слабополярных связей углерод-водород сокращаются из-за молекулярной симметрии . Однако богатая электронами π-система выше и ниже бензольного кольца несет частичный отрицательный заряд. Уравновешивающий положительный заряд связан с плоскостью атомов бензола, в результате чего образуется электрический квадруполь (пара диполей, выровненных как параллелограмм, поэтому нет чистого молекулярного дипольного момента). Отрицательно заряженная область квадруполя может тогда благоприятно взаимодействовать с положительно заряженными частицами; особенно сильный эффект наблюдается для катионов с высокой плотностью заряда . [2]
Наиболее изученные катион-π-взаимодействия включают связывание ароматической π-системы с катионом щелочного металла или азотистым катионом. Оптимальная геометрия взаимодействия помещает катион в контакт Ван-дер-Ваальса с ароматическим кольцом, расположенным в центре верхней части π-грани вдоль оси 6-го порядка. [3] Исследования показали, что электростатика доминирует во взаимодействиях в простых системах, а относительные энергии связи хорошо коррелируют с электростатической потенциальной энергией . [4] [5]
Электростатическая модель, разработанная Догерти и его коллегами, описывает тенденции изменения энергии связи, основанные на различиях в электростатическом притяжении. Было обнаружено, что энергии взаимодействия пар катион-π хорошо коррелируют с электростатическим потенциалом над π-гранью аренов: для одиннадцати Na + -ароматических аддуктов изменение энергии связи между различными аддуктами может быть полностью объяснено электростатическими различиями. Практически это позволяет качественно прогнозировать тенденции на основе визуального представления карт электростатического потенциала ряда аренов. Электростатическое притяжение - не единственный компонент связи катион-π. Например, 1,3,5-трифторбензол взаимодействует с катионами, несмотря на незначительный квадрупольный момент. Несмотря на присутствие неэлектростатических сил, эти компоненты остаются одинаковыми для широкого спектра аренов, что делает электростатическую модель полезным инструментом для прогнозирования относительных энергий связи. Другие «эффекты», способствующие связыванию, недостаточно изучены. Здесь задействованы поляризация , донорно-акцепторное [ постоянное мертвое звено ] и взаимодействия переноса заряда ; однако энергетические тенденции плохо согласуются со способностью аренов и катионов использовать эти эффекты. Например, если бы индуцированный диполь был контролирующим эффектом, алифатические соединения, такие как циклогексан, должны были бы быть хорошими партнерами катион-π (но это не так). [4]
Взаимодействие катион-π является нековалентным и поэтому принципиально отличается от связи между переходными металлами и π-системами. Переходные металлы обладают способностью разделять электронную плотность с π-системами через d-орбитали , создавая связи, которые имеют высококовалентный характер и не могут быть смоделированы как взаимодействие катион-π.
На прочность связи влияют несколько критериев: природа катиона, эффекты сольватации , природа π-системы и геометрия взаимодействия.
Из электростатики ( закон Кулона ) более мелкие и более положительно заряженные катионы приводят к большему электростатическому притяжению. Поскольку взаимодействия катион-π предсказываются электростатикой, из этого следует, что катионы с большей плотностью заряда сильнее взаимодействуют с π-системами.
В следующей таблице показан ряд значений свободной энергии Гиббса связи между бензолом и несколькими катионами в газовой фазе. [2] [6] Для однозарядных частиц энергия взаимодействия газовой фазы коррелирует с ионным радиусом ( несферические ионные радиусы являются приблизительными). [7] [8]
Эта тенденция подтверждает идею о том, что кулоновские силы играют центральную роль в силе взаимодействия, поскольку для других типов связей можно было бы ожидать, что более крупные и более поляризуемые ионы будут иметь более высокие энергии связи.
Природа растворителя также определяет абсолютную и относительную прочность связи. Большинство данных о взаимодействии катион-π получается в газовой фазе , поскольку в этом случае притяжение наиболее выражено. Любая промежуточная молекула растворителя будет ослаблять эффект, поскольку энергия, полученная в результате взаимодействия катион-π, частично компенсируется потерей энергии сольватации.
Для данного аддукта катион-π энергия взаимодействия уменьшается с увеличением полярности растворителя . Об этом можно судить по следующим рассчитанным энергиям взаимодействия метиламмония и бензола в различных растворителях. [9]

Кроме того, компромисс между сольватацией и эффектом катион-π приводит к перестановке порядка силы взаимодействия для ряда катионов. Хотя в газовой фазе наиболее плотно заряженные катионы обладают наиболее сильным катион-π-взаимодействием, эти ионы также имеют высокий штраф за десольватацию. Об этом свидетельствуют относительные силы связи катион–π в воде для щелочных металлов: [10]
Сравнение квадрупольного момента различных аренов является полезным качественным инструментом для прогнозирования тенденций связывания катион-π, поскольку он примерно коррелирует с силой взаимодействия. Арены с большими квадрупольными моментами обычно лучше связывают катионы.
Однако модельная система квадруполь-иона не может быть использована для количественного моделирования катион-π-взаимодействий. Такие модели предполагают точечные заряды и поэтому недействительны, учитывая короткое расстояние катион-π-связь. Чтобы использовать электростатику для прогнозирования энергии, необходимо учитывать всю поверхность электростатического потенциала, а не только квадрупольный момент как точечный заряд. [2]

Электронные свойства заместителей также влияют на силу притяжения. [11] Электроноакцепторные группы (например, циано -CN) ослабляют взаимодействие, тогда как электронодонорные заместители (например, амино-NH 2 ) усиливают связь катион-π. Эта связь количественно иллюстрируется на полях для нескольких заместителей.
Электронные тенденции в энергии связи катион-π не совсем аналогичны тенденциям в реакционной способности арила. Действительно, эффект резонансного участия заместителя не вносит существенного вклада в связывание катион-π, несмотря на то, что он очень важен во многих химических реакциях с аренами. Это было показано наблюдением, что сила взаимодействия катион-π для различных замещенных аренов коррелирует с мета- параметром Гаммета σ . Этот параметр предназначен для иллюстрации индуктивного воздействия функциональных групп на арильное кольцо. [4]
Происхождение эффектов заместителя во взаимодействиях катион-π часто объясняют поляризацией в результате отдачи или вывода электронов в π-систему или из нее. [12] Это объяснение имеет интуитивный смысл, но последующие исследования показали, что оно ошибочно. Недавние вычислительные работы Уиллера и Хоука убедительно показывают, что этот эффект обусловлен в первую очередь прямым взаимодействием в пространстве между катионом и диполем заместителя. В этом исследовании расчеты, моделирующие незамещенный бензол плюс взаимодействие с молекулой «HX», расположенной там, где должен находиться заместитель (с поправкой на дополнительные атомы водорода), объясняют почти всю тенденцию связывания катион-π. Для очень сильных доноров или акцепторов пи эта модель не могла полностью объяснить все взаимодействие; в этих случаях поляризация может быть более значимым фактором. [5]
Гетероциклы часто активируются в направлении связывания катион-π, когда неподеленная пара гетероатома включена в ароматическую систему (например, индол , пиррол ). И наоборот, когда неподеленная пара не вносит вклад в ароматичность (например, пиридин ), электроотрицательность гетероатома побеждает и ослабляет способность связывания катион-π.
Поскольку несколько классически «богатых электронами» гетероциклов являются плохими донорами, когда дело доходит до связывания катион-π, невозможно предсказать тенденции катион-π на основе тенденций реакционной способности гетероциклов. К счастью, упомянутые тонкости проявляются на электростатических потенциальных поверхностях соответствующих гетероциклов. [2]

взаимодействие катион-гетероцикл не всегда является взаимодействием катион-π; в некоторых случаях более выгодно, чтобы ион был связан непосредственно с неподеленной парой. Например, считается, что так обстоит дело с комплексами пиридин-Na + .
Взаимодействия катион-π имеют приблизительную зависимость от расстояния 1/r n, где n <2. Взаимодействие менее чувствительно к расстоянию, чем простое ионно-квадрупольное взаимодействие, имеющее зависимость 1/r 3 . [13]
Исследование Шерилла и его коллег дополнительно исследовало геометрию взаимодействия, подтвердив, что взаимодействия катион-π наиболее сильны, когда катион расположен перпендикулярно плоскости атомов (θ = 0 градусов на изображении ниже). Вариации этой геометрии по-прежнему демонстрируют значительное взаимодействие, которое ослабевает по мере приближения угла θ к 90 градусам. Для внеосевых взаимодействий предпочтительный φ помещает катион между двумя атомами H. Равновесные расстояния связи также увеличиваются с увеличением угла отклонения от оси. Энергии, при которых катион копланарен с углеродным кольцом, являются седловыми точками на поверхности потенциальной энергии , что согласуется с идеей о том, что взаимодействие между катионом и положительной областью квадруполя не является идеальным. [14]

В водных средах взаимодействие катион-π сравнимо (и потенциально сильнее) с солевыми мостиками аммония и карбоксилата . Рассчитанные ниже значения показывают, что с увеличением полярности растворителя прочность комплекса катион-π снижается менее резко. Эту тенденцию можно объяснить эффектами десольватации: образование солевых мостиков имеет высокий штраф за десольватацию для обоих заряженных частиц, тогда как комплекс катион-π будет платить значительный штраф только за катион. [9]

Строительные блоки природы содержат в большом количестве ароматические фрагменты. Недавно стало ясно, что многие структурные особенности, которые когда-то считались чисто гидрофобными по своей природе, на самом деле участвуют во взаимодействиях катион-π. Боковые цепи аминокислот фенилаланина , триптофана , тирозина , гистидина способны связываться с катионными видами , такими как заряженные боковые цепи аминокислот, ионы металлов, низкомолекулярные нейротрансмиттеры и фармацевтические агенты. Фактически, было обнаружено, что места связывания макромолекул , которые, как предполагалось, включают анионные группы (на основании сродства к катионам), вместо этого во многих случаях состоят из ароматических остатков. Взаимодействия катион-π могут регулировать pKa азотистых боковых цепей, увеличивая содержание протонированной формы; это имеет значение для структуры и функции белка . [15] Хотя основания ДНК менее изучены в этом контексте, они также способны участвовать во взаимодействиях катион-π. [16] [17]
Ранним свидетельством того, что взаимодействия катион-π играют роль в структуре белка, было наблюдение, что в кристаллографических данных ароматические боковые цепи появляются в тесном контакте с азотсодержащими боковыми цепями (которые могут существовать в виде протонированных катионных частиц) с непропорциональной частотой.
Исследование, опубликованное в 1986 году Берли и Петско, рассмотрело разнообразный набор белков и обнаружило, что ~ 50% ароматических остатков Phe, Tyr и Trp находились в пределах 6 Å от аминогрупп. Кроме того, примерно 25% азотсодержащих боковых цепей Lys, Asn, Gln и His находились в пределах ван-дер-ваальсового контакта с ароматическими соединениями, а 50% Arg - в контакте с несколькими ароматическими остатками (в среднем 2). [18]
Исследования на более крупных наборах данных выявили аналогичные тенденции, в том числе некоторые впечатляющие массивы чередующихся стопок катионных и ароматических боковых цепей. В некоторых случаях атомы водорода NH были ориентированы по направлению к ароматическим остаткам, а в других катионный фрагмент располагался над π-системой. Особенно сильная тенденция была обнаружена для тесных контактов между Arg и Trp. Гуанидиновый фрагмент Arg, в частности, имеет высокую склонность к укладке поверх ароматических остатков, а также к образованию водородных связей с близлежащими атомами кислорода. [19] [20] [21]

Пример взаимодействий катион-π при молекулярном распознавании можно увидеть в никотиновом рецепторе ацетилхолина (nAChR), который связывает свой эндогенный лиганд , ацетилхолин (положительно заряженную молекулу), посредством взаимодействия катион-π с четвертичным аммонием. Нейрорецептор nAChR представляет собой хорошо изученный лиганд-управляемый ионный канал , который открывается при связывании ацетилхолина. Рецепторы ацетилхолина являются терапевтическими мишенями для целого ряда неврологических расстройств, включая болезнь Паркинсона , болезнь Альцгеймера , шизофрению , депрессию и аутизм . Исследования Догерти и его коллег подтвердили, что взаимодействия катион-π важны для связывания и активации nAChR путем внесения определенных структурных изменений в ключевой остаток триптофана и корреляции результатов активности со способностью связывания катион-π. [22]
nAChR особенно важен для связывания никотина в мозге и играет ключевую роль в никотиновой зависимости . Никотин имеет фармакофор, аналогичный ацетилхолину, особенно в протонированном виде. Убедительные доказательства подтверждают, что взаимодействия катион-π играют центральную роль в способности никотина избирательно активировать рецепторы мозга, не влияя на мышечную активность. [23] [24]

Еще одним примером является растительный белок UV-B, чувствительный к ультрафиолетовому излучению UVR8 . Несколько остатков триптофана взаимодействуют посредством катион-π-взаимодействий с остатками аргинина, которые, в свою очередь, образуют солевые мостики с кислотными остатками на второй копии белка. Высказано предположение [25] , что поглощение фотона остатками триптофана нарушает это взаимодействие и приводит к диссоциации димера белка.
Также считается, что связывание катион-π важно для распознавания на клеточной поверхности [2] [26]
Взаимодействия катион-π могут катализировать химические реакции, стабилизируя накопление положительного заряда в переходных состояниях . Подобного рода эффект наблюдается в ферментативных системах. Например, ацетилхолинэстераза содержит важные ароматические группы, которые связывают четвертичный аммоний в ее активном центре. [2]
Ферменты полициклизации также основаны на взаимодействиях катион-π. Поскольку полициклизация сквалена , запускаемая протонами, протекает через (потенциально согласованный) катионный каскад, взаимодействия катион-π идеальны для стабилизации этого рассеянного положительного заряда. Кристаллическая структура сквален-гопенциклазы показывает, что активный центр выстлан ароматическими остатками. [27]

Взаимодействия катион-π наблюдались и в кристаллах синтетических молекул. Например, Аоки и его коллеги сравнили твердотельные структуры холинового эфира индол-3-уксусной кислоты и незаряженного аналога. В заряженных частицах наблюдается внутримолекулярное катион-π-взаимодействие с индолом, а также взаимодействие с индольным фрагментом соседней молекулы в решетке. В кристалле изостерического нейтрального соединения не наблюдается такой же укладки и нет взаимодействий между трет -бутильной группой и соседними индолами. [28]

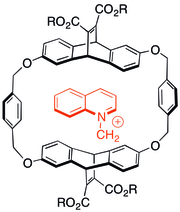
Некоторые из первых исследований взаимодействия катион-π включали изучение взаимодействий заряженных азотистых молекул в химии циклофан -хозяин-гость . Было обнаружено, что даже когда к ароматическим капсулам-хозяевам добавлялись анионные солюбилизирующие группы, во многих случаях катионные гости предпочитали связываться с π-системой. Тип хозяина, показанный справа, также был способен катализировать реакции N-алкилирования с образованием катионных продуктов. [29]
Совсем недавно катион-π-центрированное связывание и катализ субстрата были задействованы в супрамолекулярных кластерных каталитических системах металл-лиганд, разработанных Раймондом и Бергманом. [30]
π-системы являются важными строительными блоками супрамолекулярной сборки из-за их разносторонних нековалентных взаимодействий с различными функциональными группами. В частности, взаимодействия π-π, CH-π и π-катионов широко используются в супрамолекулярной сборке и распознавании.

π-π-взаимодействие касается прямых взаимодействий между двумя &pi-системами; а взаимодействие катион–π возникает в результате электростатического взаимодействия катиона с гранью π-системы. В отличие от этих двух взаимодействий, взаимодействие CH-π возникает в основном за счет переноса заряда между орбиталью CH и π-системой.
Ярким примером применения π-π-взаимодействий в супрамолекулярной сборке является синтез катенана . Основная задача синтеза катенана — контролируемое соединение молекул. Стоддарт и его коллеги разработали серию систем, использующих сильные π-π-взаимодействия между богатыми электронами производными бензола и бедными электронами пиридиниевыми кольцами. [31] [2]Катанен был синтезирован путем взаимодействия бис(пиридиния) (А), биспарафенилен-34-крауна-10 (Б) и 1,4-бис(бромметил)бензола С (рис. 2). π-π-взаимодействие между A и B привело к образованию взаимосвязанного матричного промежуточного соединения, которое далее циклизовалось в результате реакции замещения соединением C с образованием продукта [2] катенана.

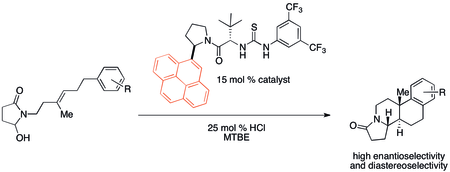
Взаимодействия катион-π, вероятно, исторически играли важную, хотя и незамеченную, роль во множестве органических реакций. Однако в последнее время внимание было обращено на потенциальное применение в конструкции катализаторов. В частности, было обнаружено, что нековалентные органокатализаторы иногда демонстрируют тенденции реакционной способности и селективности, которые коррелируют со свойствами связывания катион-π. Полициклизация, разработанная Якобсеном и его коллегами, демонстрирует особенно сильный катион-π-эффект при использовании катализатора, показанного ниже. [32]

Во многих отношениях взаимодействие анион -π является противоположностью взаимодействия катион-π, хотя основные принципы идентичны. На сегодняшний день известно значительно меньше примеров. Чтобы притянуть отрицательный заряд, распределение заряда π-системы должно измениться на противоположное. Это достигается путем размещения нескольких сильных электроноакцепторных заместителей вдоль π-системы ( например, гексафторбензола ). [33] Эффект анион-π успешно используется в химических сенсорах для определенных анионов. [34]