Электролит — это вещество, которое проводит электричество посредством движения ионов , но не посредством движения электронов . [1] [2] [3] Сюда входят большинство растворимых солей , кислот и оснований , растворенных в полярном растворителе, таком как вода. При растворении вещество разделяется на катионы и анионы , которые равномерно распределяются по всему растворителю. [4] Существуют также твердотельные электролиты . В медицине, а иногда и в химии, термин «электролит» относится к растворенному веществу. [5] [6]
Электрически такой раствор нейтрален. Если к такому раствору приложить электрический потенциал , катионы раствора притягиваются к электроду , имеющему избыток электронов , в то время как анионы притягиваются к электроду, имеющему дефицит электронов. Движение анионов и катионов в противоположных направлениях внутри раствора равносильно току. Некоторые газы, такие как хлористый водород (HCl), в условиях высокой температуры или низкого давления также могут функционировать как электролиты. [ необходимо разъяснение ] Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК , полипептиды ) или синтетических полимеров (например, полистиролсульфонат ), называемых « полиэлектролитами », которые содержат заряженные функциональные группы . Вещество, которое диссоциирует на ионы в растворе или в расплаве, приобретает способность проводить электричество. Натрий , калий , хлорид , кальций , магний и фосфат в жидкой фазе являются примерами электролитов.
В медицине восполнение электролитов необходимо, когда у человека длительная рвота или диарея , а также в ответ на потоотделение из-за напряженной спортивной активности. Доступны коммерческие электролитные растворы, особенно для больных детей (например, раствор для пероральной регидратации , Suero Oral или Pedialyte ) и спортсменов ( спортивные напитки ). Мониторинг электролитов важен при лечении анорексии и булимии .
В науке электролиты являются одними из основных компонентов электрохимических ячеек . [2]
В клинической медицине упоминания электролитов обычно метонимически относятся к ионам и (особенно) к их концентрациям (в крови, сыворотке, моче или других жидкостях). Таким образом, упоминания уровней электролитов обычно относятся к различным концентрациям ионов, а не к объемам жидкости.
Слово «электролит» происходит от древнегреческого ήλεκτρο- ( ēlectro -), префикса, изначально означавшего янтарь , но в современном контексте связанного с электричеством, и λυτός ( lytos ), означающего «способный быть развязанным или ослабленным». [ необходима цитата ]

В своей диссертации 1884 года Сванте Аррениус изложил свое объяснение диссоциации твердых кристаллических солей на парные заряженные частицы при растворении, за что он получил Нобелевскую премию по химии 1903 года. [7] [8] [9] [10] Объяснение Аррениуса состояло в том, что при образовании раствора соль диссоциирует на заряженные частицы, которым Майкл Фарадей (1791-1867) дал название « ионы » много лет назад. Фарадей считал, что ионы образуются в процессе электролиза . Аррениус предположил, что даже при отсутствии электрического тока растворы солей содержат ионы. Таким образом, он предположил, что химические реакции в растворе являются реакциями между ионами. [8] [9] [10]
Вскоре после гипотезы Аррениуса об ионах Франц Хофмейстер и Зигмунд Левит [11] [12] [13] обнаружили, что различные типы ионов оказывают разное влияние на такие вещи, как растворимость белков. Последовательное упорядочение этих различных ионов по величине их влияния возникает последовательно и во многих других системах. С тех пор это стало известно как ряд Хофмейстера .
Хотя происхождение этих эффектов не совсем ясно и обсуждалось на протяжении всего прошлого столетия, было высказано предположение, что плотность заряда этих ионов важна [14] и на самом деле может иметь объяснения, основанные на работе Шарля-Огюстена де Кулона, написанной более 200 лет назад.
Электролитные растворы обычно образуются, когда соль помещается в растворитель, такой как вода, и отдельные компоненты диссоциируют из-за термодинамических взаимодействий между молекулами растворителя и растворенного вещества, в процессе, называемом « сольватация ». Например, когда поваренная соль ( хлорид натрия ), NaCl, помещается в воду, соль (твердое вещество) растворяется в своих ионных компонентах, в соответствии с реакцией диссоциации: [ необходима цитата ]
Также возможно, что вещества реагируют с водой, производя ионы. Например, углекислый газ растворяется в воде, образуя раствор, содержащий ионы гидроксония , карбоната и гидрокарбоната . [ необходима цитата ]
Расплавленные соли также могут быть электролитами, например, когда хлорид натрия расплавлен, жидкость проводит электричество. В частности, ионные жидкости, которые представляют собой расплавленные соли с температурой плавления ниже 100 °C, [15] являются типом высокопроводящих неводных электролитов и, таким образом, находят все больше и больше применений в топливных элементах и батареях. [16]
Электролит в растворе можно описать как «концентрированный», если он имеет высокую концентрацию ионов, или «разбавленный», если он имеет низкую концентрацию. Если большая часть растворенного вещества диссоциирует с образованием свободных ионов, электролит сильный; если большая часть растворенного вещества не диссоциирует, электролит слабый. Свойства электролитов можно использовать с помощью электролиза для извлечения составных элементов и соединений, содержащихся в растворе. [ необходима цитата ]
Щелочноземельные металлы образуют гидроксиды, которые являются сильными электролитами с ограниченной растворимостью в воде из-за сильного притяжения между входящими в их состав ионами. Это ограничивает их применение в ситуациях, где требуется высокая растворимость. [17]
В 2021 году исследователи обнаружили, что электролит может «существенно облегчить исследования электрохимической коррозии в менее проводящих средах» [18] .
В физиологии основными ионами электролитов являются натрий (Na + ), калий (K + ), кальций (Ca 2+ ), магний (Mg 2+ ), хлорид (Cl − ), гидрофосфат (HPO 4 2− ) и гидрокарбонат (HCO 3 − ). [19] [ проверка не пройдена ] Символы электрического заряда плюс (+) и минус (−) указывают на то, что вещество имеет ионную природу и имеет несбалансированное распределение электронов, что является результатом химической диссоциации . Натрий является основным электролитом, обнаруженным во внеклеточной жидкости, а калий является основным внутриклеточным электролитом; [20] оба участвуют в балансе жидкости и контроле артериального давления . [21]
Все известные многоклеточные формы жизни требуют тонкого и сложного электролитного баланса между внутриклеточной и внеклеточной средой. [19] В частности, важно поддержание точных осмотических градиентов электролитов. Такие градиенты влияют и регулируют гидратацию тела, а также pH крови , и имеют решающее значение для нервной и мышечной функции. Различные механизмы существуют у живых видов, которые держат концентрации различных электролитов под строгим контролем. [22]
И мышечная ткань, и нейроны считаются электрическими тканями тела. Мышцы и нейроны активируются электролитной активностью между внеклеточной жидкостью или интерстициальной жидкостью и внутриклеточной жидкостью . Электролиты могут входить или выходить из клеточной мембраны через специализированные белковые структуры, встроенные в плазматическую мембрану, называемые « ионными каналами ». Например, сокращение мышц зависит от присутствия кальция (Ca 2+ ), натрия (Na + ) и калия (K + ). Без достаточного уровня этих ключевых электролитов может возникнуть мышечная слабость или сильные мышечные сокращения. [ необходима цитата ] [23]
Электролитный баланс поддерживается пероральным или, в экстренных случаях, внутривенным (IV) приемом электролитсодержащих веществ и регулируется гормонами , в основном почками , вымывающими избыток. У людей гомеостаз электролитов регулируется гормонами, такими как антидиуретические гормоны , альдостерон и паратиреоидные гормоны . Серьезные нарушения электролитного баланса , такие как обезвоживание и гипергидратация , могут привести к сердечным и неврологическим осложнениям и, если их быстро не устранить, приведут к неотложной медицинской помощи .
Измерение электролитов является широко используемой диагностической процедурой, выполняемой посредством анализа крови с помощью ион-селективных электродов или анализа мочи медицинскими технологами . Интерпретация этих значений несколько бессмысленна без анализа клинической истории и часто невозможна без параллельных измерений функции почек . Чаще всего измеряются электролиты натрий и калий. Уровни хлорида измеряются редко, за исключением интерпретаций газов артериальной крови , поскольку они по своей сути связаны с уровнями натрия. Одним из важных тестов, проводимых с мочой, является тест на удельный вес для определения возникновения электролитного дисбаланса . [ необходима ссылка ]
Согласно исследованию, оплаченному Институтом спортивных наук Gatorade , электролитные напитки, содержащие соли натрия и калия, восполняют концентрацию воды и электролитов в организме после обезвоживания, вызванного физическими упражнениями , чрезмерным употреблением алкоголя , потоотделением (сильным потоотделением), диареей, рвотой, интоксикацией или голоданием; в исследовании говорится, что спортсмены, тренирующиеся в экстремальных условиях (в течение трех или более часов непрерывно, например, марафон или триатлон ), которые не потребляют электролиты, рискуют получить обезвоживание (или гипонатриемию ). [24] [ требуется независимое подтверждение ]
Домашний электролитный напиток можно приготовить, используя воду, сахар и соль в точных пропорциях . [25] Важно включить глюкозу (сахар), чтобы использовать механизм котранспорта натрия и глюкозы. Коммерческие препараты также доступны [26] как для человеческого, так и для ветеринарного использования.
Электролиты обычно содержатся во фруктовых соках , спортивных напитках, молоке, орехах и многих фруктах и овощах (цельных или в виде сока) (например, картофеле, авокадо ).
Когда электроды помещаются в электролит и подается напряжение , электролит будет проводить электричество. Одиночные электроны обычно не могут проходить через электролит; вместо этого на катоде происходит химическая реакция , поставляющая электроны электролиту. Другая реакция происходит на аноде , потребляя электроны из электролита. В результате в электролите вокруг катода образуется облако отрицательного заряда, а вокруг анода — положительный заряд. Ионы в электролите нейтрализуют эти заряды, позволяя электронам продолжать течь и реакциям продолжаться. [ необходима цитата ]
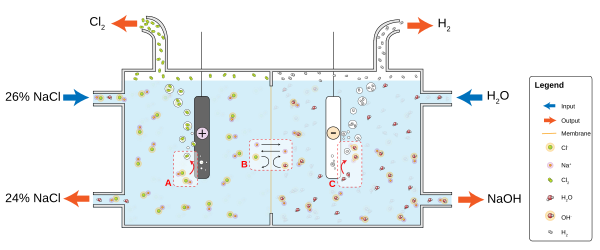
Например, в растворе обычной поваренной соли (хлорида натрия, NaCl) в воде катодная реакция будет иметь вид
и водородный газ будет пузыриться; анодная реакция
и газообразный хлор будет выделяться в раствор, где он реагирует с ионами натрия и гидроксила, образуя гипохлорит натрия - бытовой отбеливатель . Положительно заряженные ионы натрия Na + будут реагировать по направлению к катоду, нейтрализуя там отрицательный заряд OH − , а отрицательно заряженные ионы гидроксида OH − будут реагировать по направлению к аноду, нейтрализуя там положительный заряд Na + . Без ионов из электролита заряды вокруг электрода замедлили бы непрерывный поток электронов; диффузия H + и OH − через воду к другому электроду занимает больше времени, чем движение гораздо более распространенных ионов соли. Электролиты диссоциируют в воде, потому что молекулы воды являются диполями, а диполи ориентируются энергетически выгодным образом для сольватации ионов.
В других системах в электродных реакциях могут участвовать как металлы электродов, так и ионы электролита.
Электролитические проводники используются в электронных устройствах, где химическая реакция на границе раздела металл-электролит дает полезные эффекты.
Твердые электролиты можно разделить на четыре группы, описанные ниже.
Гелевые электролиты – очень похожи на жидкие электролиты. По сути, это жидкости в гибкой решетчатой структуре . Для повышения проводимости таких систем часто применяются различные добавки . [27] [29]
Твердые керамические электролиты – ионы мигрируют через керамическую фазу посредством вакансий или междоузлий внутри решетки . Существуют также стеклокерамические электролиты.
Сухие полимерные электролиты – отличаются от жидких и гелевых электролитов тем, что соль растворяется непосредственно в твердой среде. Обычно это полимер с относительно высокой диэлектрической проницаемостью ( ПЭО , ПММА , ПАН , полифосфазены , силоксаны и т. д.) и соль с низкой энергией решетки . Для повышения механической прочности и проводимости таких электролитов очень часто изготавливают композиты , вводят инертную керамическую фазу. Существует два основных класса таких электролитов: полимер-в-керамике и керамика-в-полимере. [30] [31] [32]
Органические ионные пластиковые кристаллы – это тип органических солей, демонстрирующих мезофазы (т.е. состояние вещества, промежуточное между жидкостью и твердым телом), в которых подвижные ионы ориентационно или вращательно неупорядочены, в то время как их центры расположены в упорядоченных местах в кристаллической структуре. [28] Они имеют различные формы беспорядка из-за одного или нескольких переходов твердое тело-твердое тело ниже точки плавления и поэтому обладают пластическими свойствами и хорошей механической гибкостью, а также улучшенным контактом на границе раздела электрод-электролит. В частности, протонные органические ионные пластиковые кристаллы (POIPC), [28] которые представляют собой твердые протонные органические соли, образованные переносом протона от кислоты Бренстеда к основанию Бренстеда и по сути являются протонными ионными жидкостями в расплавленном состоянии , оказались перспективными твердотельными протонными проводниками для топливных элементов . Примерами являются перфторбутансульфонат 1,2,4-триазолия [28] и метансульфонат имидазолия . [33]
在正常人体内,钠离子占细胞外液阳离子总量的92%, 98% 。钠、钾离子的相对平衡,维持着整个细胞的功能和结构的完整。钠、钾是人体内最主要的电解质成分...