Эпителий кишечника — это одноклеточный слой , который образует люминальную поверхность (слизистую оболочку) как тонкой , так и толстой кишки (ободочной кишки) желудочно -кишечного тракта . Состоит из простого столбчатого эпителия, его основными функциями являются абсорбция и секреция. Полезные вещества всасываются в организм, а проникновение вредных веществ ограничивается. Секреции включают муцины и пептиды .
Всасывающие клетки в тонком кишечнике известны как энтероциты , а в толстой кишке они известны как колоноциты . Другие типы клеток - это секреторные клетки - бокаловидные клетки , клетки Панета , энтероэндокринные клетки и клетки Тафта . Клетки Панета отсутствуют в толстой кишке. [1] [2]
В рамках своей защитной функции кишечный эпителий образует важный компонент кишечного слизистого барьера . Некоторые заболевания и состояния вызваны функциональными дефектами кишечного эпителия. С другой стороны, различные заболевания и состояния могут привести к его дисфункции, что, в свою очередь, может привести к дальнейшим осложнениям.
Эпителий кишечника является частью слизистой оболочки. Эпителий представляет собой простой кубический эпителий, состоящий из одного слоя клеток, в то время как другие два слоя слизистой оболочки, собственная пластинка и мышечная пластинка слизистой оболочки , поддерживают и сообщаются с эпителиальным слоем. Для надежного удержания содержимого просвета кишечника клетки эпителиального слоя соединены между собой плотными соединениями , образуя таким образом непрерывную и относительно непроницаемую мембрану.

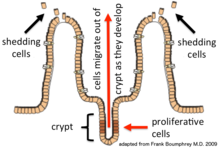
Эпителиальные клетки непрерывно обновляются каждые 4–5 дней посредством процесса деления клеток, созревания и миграции. Обновление зависит от пролиферативных клеток ( стволовых клеток ), которые находятся в крипте (основании) кишечных желез (эпителиальные инвагинации в лежащую под ними соединительную ткань). [3] После формирования в основании новые клетки мигрируют вверх и из крипты, созревая по пути. В конце концов, они подвергаются апоптозу и сбрасываются в просвет кишечника. [4] Таким образом, слизистая оболочка кишечника постоянно обновляется, в то время как количество клеток, составляющих эпителиальный слой, остается постоянным. [5]
В тонком кишечнике слизистый слой специально адаптирован для обеспечения большой площади поверхности, чтобы максимизировать всасывание питательных веществ. Расширение всасывающей поверхности, в 600 раз превышающее таковое у простой цилиндрической трубки, достигается тремя анатомическими особенностями: [6]
Щеточная кайма на апикальной поверхности эпителиальных клеток покрыта гликокаликсом , который состоит из олигосахаридов, прикрепленных к мембранным гликопротеинам и гликолипидам . [7]

Различные типы клеток производятся стволовыми клетками, которые находятся в основании крипт. [4] Каждый тип созревает в соответствии со своей специфической программой дифференциации , поскольку он мигрирует вверх и из крипты. Многие из генов, необходимых для дифференциации в различные типы эпителиальных клеток, были идентифицированы и охарактеризованы. Производимые типы клеток: энтероциты (тонкий кишечник) (известные как колоноциты в толстой кишке), бокаловидные клетки , энтероэндокринные клетки , клетки Панета , микроскладчатые клетки , клетки чашечек и клетки пучков . Их функции перечислены здесь: [8]
Распределение различных типов эпителиальных клеток по всему пищеварительному тракту варьируется в зависимости от функции этого региона. [5]

Важное значение для барьерной функции кишечного эпителия имеет то, что его клетки надежно соединены между собой четырьмя типами клеточных соединений , которые можно идентифицировать на ультраструктурном уровне: [14] [15]
Щелевые контакты сводят соседние клетки на расстояние 2 нанометров друг от друга. Они образованы несколькими гомологичными белками, кодируемыми семейством генов коннексина, которые объединяются, образуя мультипротеиновый комплекс . Молекулярная структура этого комплекса имеет форму гексамера . Комплекс, который встроен в клеточные мембраны двух соединенных клеток, образует щель или канал в середине шести белков. Этот канал позволяет различным молекулам , ионам и электрическим импульсам проходить между двумя клетками. [16]
Эти комплексы, состоящие из трансмембранных адгезионных белков семейства кадгеринов , связывают соседние клетки вместе посредством их цитоскелетов . [17] Десмосомы оставляют зазор в 30 нанометров между клетками. [16]
Adherens соединения, также называемые zonula attacheds, представляют собой мультипротеиновые комплексы, образованные белками семейств катенина и кадгерина. Они расположены в мембране в точках контакта между клетками. Они образованы взаимодействиями между внутриклеточными адаптерными белками, трансмембранными белками и актиновыми цитоскелетами клеток. Помимо своей роли в связывании соседних клеток, эти комплексы важны для регулирования эпителиальной миграции, полярности клеток и образования других комплексов клеточных соединений. [15]
Плотные соединения, также называемые zonula occludens, являются важнейшими компонентами кишечного эпителия для его барьерной функции. [18] Эти комплексы, образованные в основном членами семейств клаудинов и окклюдинов , состоят примерно из 35 различных белков, [14] образуют кольцевидную непрерывную ленту вокруг клеток и располагаются вблизи границ латеральных и апикальных мембран. [15]
Внеклеточные домены трансмембранных белков в соседних клетках перекрестно соединяются, образуя плотное уплотнение. Эти взаимодействия включают взаимодействия между белками в одной мембране («цис») и белками в соседних клетках («транс»). Кроме того, взаимодействия могут быть гомофильными (между идентичными белками) или гетерофильными (между разными белками). [15]
Подобно адгезивным соединениям, внутриклеточные домены плотных соединений взаимодействуют с различными белками каркаса , адаптерными белками и сигнальными комплексами для регулирования цитоскелетных связей, клеточной полярности, клеточной сигнализации и везикального транспорта. [15]
Плотные соединения обеспечивают узкое, но модифицируемое уплотнение между соседними клетками в эпителиальном слое и тем самым обеспечивают селективный парацеллюлярный транспорт растворенных веществ. [15] Хотя ранее считалось, что это статические структуры, теперь известно, что плотные соединения являются динамичными и могут изменять размер отверстия между клетками и тем самым адаптироваться к различным состояниям развития, физиологии и патологиям. [18] Они функционируют как селективный и полупроницаемый парацеллюлярный барьер между апикальными и базолатеральными компартментами эпителиального слоя. Они функционируют, чтобы облегчить прохождение небольших ионов и водорастворимых растворенных веществ через парацеллюлярное пространство, одновременно предотвращая прохождение люминальных антигенов, микроорганизмов и их токсинов. [15]
Кишечный эпителий имеет сложную анатомическую структуру, которая обеспечивает моторику и координацию пищеварительных, всасывательных, иммунологических и нейроэндокринных функций. [19]
Слизь , выделяемая бокаловидными клетками, действует как смазка и защищает слой эпителиальных клеток от раздражения содержимым слизистой оболочки. [20]
Традиционно клетки крипт считались в первую очередь секреторными, в то время как энтероциты считаются в основном абсорбционными. Однако недавние исследования поставили под сомнение это классическое функциональное разделение и показали, что как поверхностные, так и криптовые клетки могут выполнять как секреторные, так и абсорбционные функции и что, по сути, эти функции могут происходить одновременно. [21] [22]
На щеточную кайму апикальной поверхности энтероцитов накладывается гликокаликс , который представляет собой рыхлую сеть, состоящую из боковых цепей олигосахаридов интегральных мембранных гидролаз и других ферментов, необходимых для переваривания белков и углеводов. Эти гликопротеины , гликолипиды и ферменты катализируют конечные стадии переваривания люминальных углеводов и белков. Моносахариды и аминокислоты, полученные таким образом, впоследствии транспортируются через эпителий кишечника и в конечном итоге попадают в кровоток. [7]
Всасывание электролитов и воды является одной из важнейших функций пищеварительного тракта. Всасывание воды является пассивным и изотоническим - в зависимости от скорости и направления потока растворенного вещества. Другими факторами, влияющими на всасывание жидкости, являются осмолярность и конкретная область кишечника. [19] Регулируемая избирательная проницаемость осуществляется двумя основными путями: трансцеллюлярным (трансэпителиальным) путем и парацеллюлярным путем. [15]

Это состоит из специфического транспорта растворенных веществ через эпителиальные клетки. Он в основном регулируется деятельностью специализированных транспортеров, которые перемещают определенные электролиты, аминокислоты, сахара, короткоцепочечные жирные кислоты и другие молекулы в клетку или из нее. [15]
Парацеллюлярная проницаемость зависит от транспорта через пространства, которые существуют между эпителиальными клетками. Она регулируется клеточными соединениями, которые локализованы в ламинарных мембранах клеток. [15] Это основной путь пассивного потока воды и растворенных веществ через кишечный эпителий. Регулирование зависит от межклеточных плотных соединений, которые оказывают наибольшее влияние на парацеллюлярный транспорт. [23] Исследования с использованием электронного микроскопа показали, что электрическое сопротивление эпителиальных слоев зависит от сложности и количества нитей в трансмембранных белковых комплексах плотных соединений. [19] Кроме того, сопротивление плазматической мембраны и переменная трансмембранная проводимость эпителиальных клеток также могут модулировать функцию парацеллюлярного пути. [19]
Барьер, образованный кишечным эпителием, отделяет внешнюю среду (содержимое просвета кишечника ) от организма [15] и является самой обширной и важной слизистой поверхностью организма. [18]
Кишечный эпителий выполняет несколько важнейших функций, демонстрируя как врожденные, так и адаптивные иммунные особенности. Он внимательно следит за своей внутриклеточной и внеклеточной средой, передает сообщения соседним клеткам и быстро инициирует активные защитные и восстановительные меры, если это необходимо. [24] С одной стороны, он действует как барьер, предотвращая проникновение вредных веществ, таких как чужеродные антигены , токсины и микроорганизмы . [14] [15] С другой стороны, он действует как селективный фильтр, который облегчает усвоение пищевых питательных веществ , электролитов , воды и различных других полезных веществ из просвета кишечника. [15]
При потере целостности барьера увеличивается проницаемость кишечника и может произойти неконтролируемый проход вредных веществ. Это может привести, в зависимости от генетической предрасположенности человека, к развитию воспаления , инфекции , аллергии , аутоиммунных заболеваний или рака — как в самом кишечнике, так и в других органах. [19]
Хотя они в первую очередь функционируют как часть пищеварительной системы , энтероциты кишечного эпителия также экспрессируют толл-подобные рецепторы и белки домена олигомеризации нуклеотидов , которые распознают различные типы микробов и способствуют функционированию иммунной системы . [25] [26] Таким образом, кишечный эпителий не только служит физическим барьером, отделяющим просвет кишечника от самого тела, но и выполняет функции распознавания патогенов как часть внутренней иммунной системы .
Потеря целостности кишечного эпителия играет ключевую патогенную роль в воспалительном заболевании кишечника (ВЗК). [27] Изменения в составе кишечной микробиоты являются важным фактором окружающей среды в развитии ВЗК. Пагубные изменения в кишечной микробиоте вызывают неадекватный (неконтролируемый) иммунный ответ , который приводит к повреждению кишечного эпителия. Нарушения в этом критическом барьере (кишечном эпителии) допускают дальнейшее проникновение микробиоты, что, в свою очередь, вызывает дальнейшие иммунные ответы. ВЗК является многофакторным заболеванием, которое, тем не менее, частично обусловлено чрезмерным иммунным ответом на кишечную микробиоту, что вызывает дефекты функции эпителиального барьера. [28]
Желчные кислоты являются нормальными компонентами содержимого просвета желудочно-кишечного тракта , где они могут действовать как физиологические детергенты и регуляторы гомеостаза эпителия кишечника . [29] Чрезмерное длительное воздействие желчных кислот на эпителиальные клетки кишечника может вызвать окислительный стресс, приводящий к окислительному повреждению ДНК и канцерогенным мутациям . [30]