Аминокислота с разветвленной цепью ( BCAA ) — это аминокислота, имеющая алифатическую боковую цепь с ответвлением (центральный атом углерода, связанный с тремя или более атомами углерода). Среди протеиногенных аминокислот есть три BCAA: лейцин , изолейцин и валин . [1] Непротеиногенные BCAA включают 2-аминоизомасляную кислоту и аллоизолейцин .


Три протеиногенных BCAA входят в число девяти незаменимых аминокислот для человека, составляя 35% незаменимых аминокислот в мышечных белках и 40% преформированных аминокислот, необходимых млекопитающим. [2] Синтез BCAA происходит во всех местах растений, в пластидах клетки, что определяется наличием мРНК , которые кодируют ферменты в метаболическом пути. [3] [4] [5] Окисление BCAA может увеличить окисление жирных кислот и играть роль в ожирении. Физиологически BCAA играют роль в иммунной системе и в функционировании мозга. BCAA эффективно расщепляются ферментами дегидрогеназой и декарбоксилазой, экспрессируемыми иммунными клетками, и необходимы для роста и пролиферации лимфоцитов и активности цитотоксических Т-лимфоцитов. [4] Наконец, BCAA разделяют тот же транспортный белок в мозг с ароматическими аминокислотами (Trp, Tyr и Phe). Попадая в мозг, BCAA могут играть роль в синтезе белка, синтезе нейротрансмиттеров и выработке энергии. [4]
Совет по продовольствию и питанию (FNB) Института медицины США установил Рекомендуемые нормы потребления (RDA) незаменимых аминокислот в 2002 году. Для лейцина для взрослых от 19 лет и старше — 42 мг/кг веса тела в день; для изолейцина — 19 мг/кг веса тела в день; для валина — 24 мг/кг веса тела в день. [6] Для человека весом 70 кг (154 фунта) это составляет 2,9, 1,3 и 1,7 г/день. Диеты, которые соответствуют или превышают RDA для общего белка (0,8 г/кг/день; 56 граммов для человека весом 70 кг), соответствуют или превышают RDA для аминокислот с разветвленной цепью.
В параллельных путях синтеза изолейцина, валина и лейцина участвуют пять ферментов: треониндегидрогеназа, синтаза ацетогидроксикислот, редуктоизомераза кетокислот, дегидрогеназа дигидроксикислот и аминотрансфераза . [3] Треониндегидрогеназа катализирует дезаминирование и дегидратацию треонина до 2-кетобутирата и аммиака. Изолейцин образует отрицательную обратную связь с треониндегидрогеназой. Синтаза ацетогидроксикислот является первым ферментом для параллельного пути, выполняющим реакцию конденсации на обоих этапах — конденсацию пирувата в ацетолактат в валиновом пути и конденсацию пирувата и 2-кетобутирата с образованием ацетогидроксибутирата в изолейциновом пути. Следующая кетокислоторедуктоизомераза восстанавливает ацетогидроксикислоты из предыдущего шага, чтобы получить дигидроксикислоты в обоих путях валина и изолейцина. Дигидроксикислотодегидрогеназа преобразует дигидроксикислоты на следующем шаге. Последний шаг в параллельном пути осуществляется аминотрансферазой, которая дает конечные продукты валин и изолейцин. [3] Серия из еще четырех ферментов — изопропилмалатсинтаза, изопропилмалатизомераза, изопропилмалатдегидрогеназа и аминотрансфераза — необходимы для образования лейцина из 2-оксолсовалерата. [3]
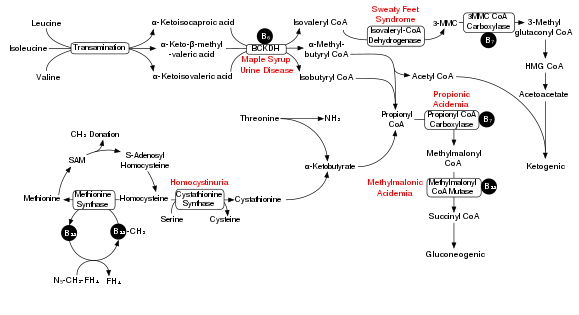
Деградация аминокислот с разветвленной цепью включает комплекс дегидрогеназы альфа-кетокислот с разветвленной цепью (BCKDH). Дефицит этого комплекса приводит к накоплению аминокислот с разветвленной цепью ( лейцин , изолейцин и валин ) и их токсичных побочных продуктов в крови и моче, что дало этому состоянию название болезнь кленового сиропа мочи . С другой стороны, неконтролируемая активность этого комплекса вызывает дефицит киназы дегидрогеназы кетокислот с разветвленной цепью .
Комплекс BCKDH преобразует аминокислоты с разветвленной цепью в производные ацил-КоА , которые после последующих реакций превращаются либо в ацетил-КоА , либо в сукцинил-КоА , которые поступают в цикл лимонной кислоты . [7]
В этом процессе задействованы ферменты — аминотрансфераза с разветвленной цепью и 3-метил-2-оксобутаноатдегидрогеназа .
В модели болезни мочи с запахом кленового сиропа у крыс острое введение BCAA увеличивает повреждение ДНК в области гиппокампа мозга. [8] На рисунке рядом показан путь деградации BCAA и, в частности, ключевая роль неадекватного BCKDH в болезни мочи с запахом кленового сиропа. Хроническое введение BCAA, по сравнению с острым введением, увеличило повреждение ДНК не только в гиппокампе, но и в области полосатого тела мозга. [8] Антиоксидантная терапия смогла предотвратить повреждение ДНК в этих областях мозга, что позволяет предположить, что BCAA вызывают повреждение ДНК посредством выработки окислительного стресса .
В то время как большинство аминокислот окисляются в печени, BCAA в первую очередь окисляются в скелетных мышцах и других периферических тканях. [4] Было проверено влияние введения BCAA на рост мышц в диафрагме крысы, и был сделан вывод, что не только смесь BCAA в отдельности оказывает такое же влияние на рост, как полная смесь аминокислот, но и смесь аминокислот со всеми, кроме BCAA, не влияет на рост мышц диафрагмы крысы. [9] Введение изолейцина или валина в отдельности не повлияло на рост мышц, хотя введение лейцина в отдельности, по-видимому, почти так же эффективно, как и полная смесь BCAA. Лейцин косвенно активирует киназу p70 S6 , а также стимулирует сборку комплекса eIF4F , которые необходимы для связывания мРНК при трансляционной инициации. [9] Киназа P70 S6 является частью сигнального пути комплекса рапамицина млекопитающих (mTOR) и, как было показано, обеспечивает адаптивную гипертрофию и восстановление мышц крысы. [10] В состоянии покоя инфузия белка стимулирует синтез белка через 30 минут после начала инфузии, и синтез белка остается повышенным в течение еще 90 минут. [11] Инфузия лейцина в состоянии покоя производит шестичасовой стимулирующий эффект и увеличивает синтез белка за счет фосфорилирования киназы p70 S6 в скелетных мышцах. [11] После силовых упражнений, без введения BCAA, сеанс силовых упражнений не влияет на фосфорилирование mTOR и даже вызывает снижение фосфорилирования Akt. Было обнаружено некоторое фосфорилирование киназы p70 S6. Когда BCAA вводились после тренировочной сессии, достаточное фосфорилирование киназы p70 S6 и S6 указывало на активацию сигнального каскада. [11]
Помимо клеточной сигнализации, путь mTOR также играет роль в росте бета-клеток, что приводит к секреции инсулина . [12] Высокий уровень глюкозы в крови запускает процесс сигнального пути mTOR, в котором лейцин играет косвенную роль. [10] [13] Сочетание глюкозы, лейцина и других активаторов заставляет mTOR начать сигнализацию для пролиферации бета-клеток и секреции инсулина. Более высокие концентрации лейцина вызывают гиперактивность в пути mTOR, и активируется киназа S6, что приводит к ингибированию субстрата рецептора инсулина через фосфорилирование серина. [12] [13] В клетке повышенная активность комплекса mTOR вызывает в конечном итоге неспособность бета-клеток высвобождать инсулин, а ингибирующее действие киназы S6 приводит к резистентности к инсулину в клетках, способствуя развитию диабета 2 типа . [12]
Метформин способен активировать AMP-киназу, которая фосфорилирует белки, участвующие в пути mTOR, а также приводит к переходу комплекса mTOR из неактивного состояния в активное. [12] Предполагается, что метформин действует как конкурентный ингибитор аминокислоты лейцина в пути mTOR.
BCAA оказывают инсулиноподобное действие на глюкозу , вызывая снижение уровня глюкозы. BCAA, которые принимаются перед тренировкой, могут окисляться скелетными мышцами и использоваться в качестве энергии во время тренировки, снижая потребность печени в повышении уровня гликогенолиза . Во время анаэробных упражнений молекулы пирувата , которые возникают в результате метаболизма глюкозы, преобразуются в молочную кислоту , накопление которой может привести к метаболическому ацидозу с уровнем pH до 6,4. [14] Высокий уровень молочной кислоты приводит к остановке метаболизма глюкозы, чтобы уменьшить дальнейшее снижение pH. Было показано, что добавление BCAA снижает уровень молочной кислоты в мышцах, позволяя метаболизму глюкозы продолжаться. [15] Это приводит к снижению скорости гликогенолиза в печени и, следовательно, к снижению уровня глюкозы в плазме. Однако исследования, проведенные в отношении долгосрочного воздействия BCAA на уровень глюкозы, показали, что постоянный прием BCAA не оказывает заметного влияния на уровень глюкозы в крови вне тренировки. [15]
BCAA снижают уровень циркулирующих свободных жирных кислот (СЖК) в крови. [15] СЖК конкурируют за места связывания на альбумине с триптофаном , и когда уровень СЖК в крови снижается, уровень свободного триптофана также снижается, поскольку больше его связывается альбумином. Во время упражнений уровень свободного триптофана, поступающего в мозг, увеличивается, вызывая увеличение 5-гидрокситриптамина (5-HT, он же серотонин ), способствующего ощущению усталости . Благодаря снижению уровня СЖК в крови, BCAA могут помочь снизить уровень свободного триптофана, поступающего в мозг, и помочь уменьшить ощущение усталости в результате нагрузки. [16] Снижение поглощения триптофана в мозге приводит к снижению синтеза и высвобождения серотонина (у крыс. [17] ) Снижение серотонина может достигать 90%; Низкий уровень серотонина снижает чувство усталости, но также приводит к потере концентрации, плохому контролю импульсов, агрессивному поведению и плохому планированию.
BCAA также подавляет поглощение тирозина в мозге (тирозин является другой ароматической аминокислотой, подобной триптофану); сниженное поглощение подавляет синтез катехоламинов и высвобождение в мозге. Катехоламины связаны с повышением физической работоспособности. Одновременное снижение синтеза как катехоламинов, так и серотонина может объяснять относительно нейтральное влияние BCAA на физическую работоспособность. [17]
Также обнаружено, что BCAA снижают повышение уровня аммиака в сыворотке , которое происходит во время упражнений. Это достигается за счет увеличения количества аммиака, используемого в синтезе глутамина , что предотвращает чрезмерное накопление аммиака в крови. [15] Повышение уровня аммиака в мозге приводит к снижению уровня ГАМК и глутамата , что приводит к увеличению центральной усталости . Повышение уровня аммиака в мышечной ткани также увеличивает активность фосфофруктокиназы (ФФК), что приводит к увеличению молочной кислоты, которая является основным фактором мышечной усталости. [18]
Кроме того, было показано, что добавление BCAA снижает уровень креатинкиназы в мышечных клетках после тренировки. Креатинкиназа является индикатором повреждения мышц и отвечает за перенос фосфатной группы из АТФ для создания молекулы фосфокреатина . [19] Было показано, что добавление BCAA снижает уровень креатинкиназы, что приводит к более высокому уровню внутриклеточного АТФ и уменьшению чувства усталости. [20] См. также DOMS .
Пищевые BCAA использовались в попытке лечения некоторых случаев печеночной энцефалопатии . [21] Они могут оказывать эффект облегчения симптомов печеночной энцефалопатии, но нет никаких доказательств того, что они улучшают показатели смертности, питания или общее качество жизни, поскольку необходимы дальнейшие исследования. [22]
Некоторые исследования предполагают возможную связь между высокой частотой бокового амиотрофического склероза (БАС) среди профессиональных игроков в американский футбол и итальянских футболистов и некоторыми спортивными добавками, включая BCAA. [23] В исследованиях на мышах было показано, что BCAA вызывают гипервозбудимость клеток, напоминающую ту, что обычно наблюдается у пациентов с БАС. Предложенный основной механизм заключается в том, что гипервозбудимость клеток приводит к повышенному поглощению кальция клеткой и, таким образом, вызывает гибель клеток, в частности нейрональных клеток, которые имеют особенно низкие возможности буферизации кальция. [23] Тем не менее, какая-либо связь между BCAA и БАС еще полностью не установлена. Хотя BCAA могут вызывать гипервозбудимость, подобную той, которая наблюдается у мышей с БАС, текущая работа не показывает, действительно ли обогащенная BCAA диета, принимаемая в течение длительного периода, вызывает симптомы, подобные БАС. [23]
Уровень BCAA в крови повышен у тучных, инсулинорезистентных людей, а также у мышей и крыс с диабетом, вызванным диетой, что предполагает возможность того, что BCAA способствуют патогенезу ожирения и диабета. [24] [25] Диеты с ограничением BCAA улучшают толерантность к глюкозе и способствуют похудению у мышей с нормальным весом, [26] восстанавливают чувствительность к инсулину и нормальную массу тела у мышей с ожирением [27] и способствуют чувствительности к инсулину у крыс с ожирением. [28] У худых и тучных мышей эти преимущества ограничения BCAA опосредованы изолейцином и валином, а не ограничением лейцина. [29]
Ограничение BCAA в рационе увеличивает продолжительность жизни мух, [30] в то время как ограничение BCAA у мышей увеличивает продолжительность жизни самцов и снижает слабость, но не увеличивает продолжительность жизни самок. [31] У мышей диетические добавки с BCAA сами по себе уменьшают продолжительность жизни и способствуют ожирению. [32] Однако потребление добавки с незаменимыми аминокислотами, обогащенной BCAA, увеличивает продолжительность жизни мышей. [33]