
Химические соединения в пиве придают ему характерный вкус, запах и внешний вид. Большинство соединений в пиве образуются в результате метаболической активности растений и дрожжей , поэтому они попадают в сферу биохимии и органической химии . [1] Главным исключением является то, что пиво содержит более 90% воды, а минеральные ионы в воде (жесткость) могут оказывать значительное влияние на вкус. [2]
В процессе пивоварения для приготовления пива используются четыре основных ингредиента : углеводы (из солода ), хмель , дрожжи и вода .
Источник углеводов является неотъемлемой частью пива, поскольку одноклеточные дрожжевые организмы преобразуют углеводы в энергию для жизни. Дрожжи метаболизируют источник углеводов, образуя ряд соединений, включая этанол . Процесс пивоварения начинается с соложения и затирания , которые расщепляют длинные углеводы в ячменном зерне на более простые сахара . Это важно, поскольку дрожжи могут метаболизировать только очень короткие цепи сахаров. [3] Длинные углеводы представляют собой полимеры , большие разветвленные связи одной и той же молекулы снова и снова. В случае ячменя мы в основном видим полимеры, называемые амилопектином и амилозой , которые состоят из повторяющихся связей глюкозы . В очень больших временных масштабах (термодинамически) эти полимеры распадались бы сами по себе, и не было бы необходимости в процессе соложения. [4] Процесс обычно ускоряется путем нагревания ячменного зерна. [3] Этот процесс нагрева активирует ферменты, называемые амилазами . Форма этих ферментов, их активный центр , дает им уникальную и мощную способность ускорять эти реакции деградации более чем в 100 000 раз быстрее. Реакция, которая происходит в активном центре, называется реакцией гидролиза , которая представляет собой расщепление связей между сахарами. Повторный гидролиз разрушает длинные полимеры амилопектина на более простые сахара, которые могут быть переварены дрожжами. [4]
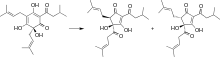
Хмель — это цветы растения хмеля Humulus lupulus . Эти цветы содержат более 440 эфирных масел, которые способствуют аромату и не горькому вкусу пива. [4] Однако отчетливая горечь, особенно характерная для светлых элей, исходит от семейства соединений, называемых альфа-кислотами (также называемыми гумулонами ) и бета-кислотами (также называемыми лупулонами ). Обычно пивовары считают, что α-кислоты придают пиву приятную горечь, тогда как β-кислоты считаются менее приятными. [4] α-кислоты изомеризуются во время процесса кипячения в реакции, изображенной на рисунке. Шестичленное кольцо в гумулоне изомеризуется в пятичленное кольцо, но обычно не обсуждается, как это влияет на воспринимаемую горечь.

В пиве отходы метаболизма дрожжей играют важную роль. В аэробных условиях дрожжи используют в гликолизе простые сахара, полученные в процессе соложения , и преобразуют пируват , основной органический продукт гликолиза, в углекислый газ и воду посредством клеточного дыхания . Многие домашние пивовары используют этот аспект метаболизма дрожжей для газирования пива. Однако в промышленных анаэробных условиях дрожжи не могут использовать пируват, конечные продукты гликолиза, для получения энергии в клеточном дыхании. Вместо этого они полагаются на процесс, называемый брожением . Брожение преобразует пируват в этанол через промежуточный ацетальдегид .
Вода часто может играть, прямо или косвенно, очень важную роль во вкусе пива, [2] [4], поскольку она является основным ингредиентом. Виды ионов , присутствующие в воде , могут влиять на метаболические пути дрожжей , и, таким образом, на метаболиты, которые можно почувствовать на вкус. Например, ионы кальция и железа необходимы в небольших количествах для выживания дрожжей, поскольку эти ионы металлов обычно являются необходимыми кофакторами для дрожжевых ферментов . [4]
В аэробных условиях дрожжи превращают сахара в пируват, а затем преобразуют пируват в воду и углекислый газ . Этот процесс может карбонизировать пиво. В коммерческом производстве дрожжи работают в анаэробных условиях, чтобы преобразовать пируват в этанол , и не карбонизируют пиво. Пиво карбонизируется с помощью сжатого CO2 . Когда пиво наливается, углекислый газ, растворенный в пиве, выходит и образует крошечные пузырьки. Эти пузырьки растут и ускоряются по мере подъема, питаясь близлежащими более мелкими пузырьками, явление, известное как созревание Оствальда . Эти более крупные пузырьки приводят к образованию «более грубой» пены на поверхности налитого пива.
Пиво можно газировать с помощью CO2 или делать игристым с помощью инертного газа, такого как азот (N2 ) , аргон (Ar) или гелий (He). Инертные газы не так растворимы в воде, как углекислый газ, поэтому они образуют пузырьки, которые не растут в процессе созревания Оствальда . Это означает, что пиво имеет более мелкие пузырьки и более кремовую и стабильную пену. [6] Эти менее растворимые инертные газы придают пиву другую и более плоскую текстуру. С точки зрения пива, ощущение во рту гладкое, а не игристое, как у пива с нормальной карбонизацией. Нитропиво (для азотного пива) может быть на вкус менее кислым, чем обычное пиво. [7]
Пиво содержит много ароматических веществ. До сих пор химики, используя передовые аналитические приборы, такие как газовые и высокоэффективные жидкостные хроматографы, соединенные с масс-спектрометрами , обнаружили более 7700 различных химических соединений в пиве. [8]
Стабильность пивной пены зависит, помимо прочего, от присутствия ионов переходных металлов ( Fe2+
, Ко2+
, Ни2+
, Cu2+
...), макромолекулы, такие как полисахариды , белки и соединения изогумулона из хмеля в пиве. Стабильность пены является важным фактором для первого восприятия пива потребителем и поэтому является предметом наибольшего внимания со стороны пивоваров и барменов, отвечающих за подачу разливного пива или за правильное наливание пива в стакан из бутылки (с хорошей пеностойкостью и без чрезмерного вспенивания или фонтанирования при открывании бутылки).
За последние десятилетия пивоваренные заводы и агрохимическая промышленность подали множество патентов на различные типы стабилизаторов пивной пены. Соли кобальта , добавляемые в низкой концентрации (1–2 ppm ), были популярны в шестидесятые годы, но подняли вопрос о токсичности кобальта в случае необнаруженной случайной передозировки во время производства пива. В качестве альтернативы органические стабилизаторы пены производятся путем гидролиза восстановленных побочных продуктов производства пива, таких как дробина или остатки хмеля . [9]
Среди большого спектра очищенных или модифицированных натуральных пищевых добавок , доступных на рынке, растворимая карбоксиметилгидроксиэтилцеллюлоза , [10] пропиленгликольальгинат (ПГА, пищевая добавка с номером E405), [11] пектины и геллановая камедь также были исследованы в качестве стабилизаторов пены.
В 1957 году два химика-пивовара, Торн и Хелм, обнаружили, что Co2+
катион смог стабилизировать пивную пену и избежать перепенивания и фонтанирования пива. [12] Добавление небольшого количества ионов кобальта в диапазоне 1–2 мг/л ( ppm ) было эффективным. Более высокие концентрации были бы токсичными, а более низкие — неэффективными.
Кобальт является переходным металлом , атомные орбитали которого способны взаимодействовать с лигандами или функциональными группами (–OH, –COOH, –NH 2 ), присоединенными к органическим молекулам, естественным образом присутствующим в пиве, создавая макромолекулярные координационные комплексы, стабилизирующие пивную пену. Кобальт может вести себя как меж- или внутримолекулярный мостик между различными молекулами полисахаридов (изменяя их форму или размер) или вызывать некоторые конформационные изменения [13] различных типов молекул, присутствующих в растворе, влияя на их абсолютную конфигурацию и, таким образом, на молекулярную структуру пены и ее поведение.
Торн и Хельм (1957) также сформулировали гипотезу о том, что кобальт, образуя комплекс с некоторыми азотистыми компонентами пива (например, аминокислотами из солодовых белков ), может образовывать поверхностно-активные вещества, инактивирующие газообразные ядра, ответственные за чрезмерное пенообразование и фонтанирование. [12]
Фонтанирование — это специфическая проблема, также более подробно изученная Рудином и Хадсоном (1958). [14] Эти авторы обнаружили, что фонтанированию также способствуют ионы других переходных металлов, таких как ионы никеля и железа , но не ионы кобальта . Изогумулон ( изо-альфа-кислота, ответственная за горький вкус хмеля ) и его комбинации с Ni или Fe также способствуют фонтанированию, в то время как чистые ионы Co или их комбинации с изогумулоном не проявляют фонтанирования и чрезмерного вспенивания. Это объясняет, почему соли кобальта были специально выбраны в концентрации 1–2 мг/л в качестве антифонтанирующего агента для пива. Рудин и Хадсон (1958) и другие авторы также обнаружили, что ионы Co, Ni и Fe преимущественно концентрируются в самой пене. [14]
В шестидесятые годы, после одобрения FDA США , сульфат кобальта в низкой концентрации широко использовался в США в качестве добавки для стабилизации пивной пены и предотвращения выплескивания пива после того, как оно подвергалось вибрации во время транспортировки или обработки.
Хотя кобальт является важным микроэлементом, необходимым для синтеза витамина B12 , избыточный уровень кобальта в организме может привести к отравлению кобальтом и его следует избегать. Это послужило толчком к разработке методов качественного и количественного анализа для точного определения кобальта в пиве с целью предотвращения случайной передозировки и отравления кобальтом. [15]
Известно, что слишком высокие уровни кобальта вызывают кардиомиопатию у любителей пива . Первые упоминания о проблемах в литературе появились в Канаде в середине шестидесятых после случайной передозировки на пивоварне Dow Breweries в Квебеке .
В августе 1965 года в больницу города Квебек поступил человек с симптомами, указывающими на алкогольную кардиомиопатию . В течение следующих восьми месяцев в том же районе было зарегистрировано еще пятьдесят случаев с аналогичными результатами, двадцать из которых закончились летальным исходом. Было отмечено, что все они были заядлыми алкоголиками, которые в основном пили пиво и предпочитали бренд Dow ; тридцать из них выпивали более 6 литров (12 пинт) пива в день. [16] Эпидемиологические исследования показали, что пивоварни Dow добавляли в пиво сульфат кобальта для стабильности пены с июля 1965 года, и что концентрация, добавленная на пивоварне города Квебек, была в десять раз выше, чем в том же пиве, сваренном в Монреале , где не было зарегистрировано ни одного случая. [17] [18]

Особая проблема с пивом заключается в том, что, в отличие от вина , его качество имеет тенденцию к ухудшению с возрастом. [20] Запах и вкус кошачьей мочи, называемый ribes , названный в честь вида черной смородины, имеет тенденцию развиваться и достигать пика. [21] Затем доминирует запах картона, который обусловлен высвобождением 2-ноненаля . [22] В целом химики считают, что «неприятные привкусы», которые появляются у старого пива, вызваны реактивными формами кислорода. Они могут иметь форму свободных радикалов кислорода , например, которые могут изменять химическую структуру соединений в пиве, придающих ему вкус. [22] Радикалы кислорода могут вызывать повышенную концентрацию альдегидов из-за реакций деградации аминокислот в пиве по Штрекеру. [23]
Пиво уникально по сравнению с другими алкогольными напитками, потому что оно нестабильно в конечной упаковке. Существует множество переменных и химических соединений, которые влияют на вкус пива на этапах производства, а также во время хранения пива. Пиво приобретает неприятный привкус во время хранения из-за многих факторов, включая солнечный свет и количество кислорода в свободном пространстве бутылки. Помимо изменений вкуса, пиво также может приобретать визуальные изменения. Пиво может стать мутным во время хранения. Это называется коллоидной стабильностью (образованием мутности) и обычно вызывается сырьем, используемым в процессе пивоварения. Основная реакция, вызывающая мутность пива, — это полимеризация полифенолов и связывание со специфическими белками. Этот тип мутности можно увидеть , когда пиво охлаждают ниже 0 градусов по Цельсию. Когда пиво нагревают до комнатной температуры, мутность растворяется. Но если пиво хранится при комнатной температуре слишком долго (около 6 месяцев), образуется постоянная мутность. [24] Исследование, проведенное Хойбергером и др. (2012) приходит к выводу, что температура хранения пива влияет на стабильность вкуса. Они обнаружили, что профиль метаболитов пива, хранящегося при комнатной температуре и при низкой температуре, значительно отличается от свежего пива. У них также есть доказательства, подтверждающие значительное окисление пива после недель хранения, что также влияет на вкус пива. [25]
Неприятный привкус в пиве, такой как привкус картона или зеленого яблока, часто связан с появлением стареющих альдегидов . Альдегиды Стрекера, ответственные за изменение вкуса, образуются во время хранения пива. Филип Витсток и др. провели эксперименты, чтобы проверить, что вызывает образование альдегидов Стрекера во время хранения. Они обнаружили, что только концентрация аминокислот ( лейцин (Leu), изолейцин (Ile) и фенилаланин (Phe) в частности) и концентрация растворенного кислорода вызывают образование альдегидов Стрекера. Они также протестировали добавки углеводов и Fe 2+ . Была обнаружена линейная зависимость между образованными альдегидами Стрекера и общим упакованным кислородом. Это важно знать пивоварам, чтобы они могли контролировать вкус своего пива. Витсток приходит к выводу, что укупоривание пива кроненпробками с кислородным барьером уменьшит образование альдегидов Стрекера. [23]
В другом исследовании, проведенном Вандерхагеном и др. (2003), были протестированы различные условия старения бутилированного пива после 6 месяцев. Они обнаружили, что уменьшение летучих эфиров было ответственно за уменьшение фруктового вкуса. Они также обнаружили увеличение многих других соединений, включая карбонильные соединения, этиловые эфиры, соединения Майяра, диоксоланы и фурановые эфиры. [26] Карбонильные соединения, как было указано ранее в экспериментах Витстока, будут создавать альдегиды Штрекера , которые, как правило, вызывают вкус зеленого яблока. Известно, что эфиры вызывают фруктовые вкусы, такие как груши, розы и бананы. Соединения Майяра вызовут поджаренный, солодовый вкус.
Исследование, проведенное Чарльзом Бэмфортом и Роем Парсонсом (1985), также подтверждает, что привкусы старения пива вызваны различными карбонильными соединениями. Они использовали тиобарбитуровую кислоту (ТБК) для оценки веществ, вызывающих старение, после использования техники ускоренного старения. Они обнаружили, что старение пива уменьшается с помощью поглотителей гидроксильного радикала ( • ОН), таких как маннит и аскорбиновая кислота . Они также проверили гипотезу о том, что экстракты сои, включенные в ферментирующее сусло, увеличивают срок хранения вкуса пива. [27]