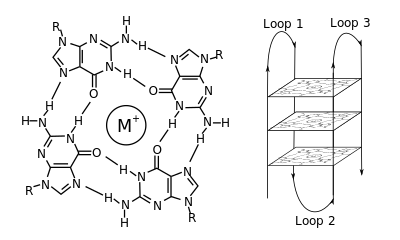
В молекулярной биологии вторичные структуры G-квадруплекса (G4) образуются в нуклеиновых кислотах последовательностями, богатыми гуанином . [2] Они имеют спиральную форму и содержат тетрады гуанина, которые могут образовываться из одной, [3] двух [4] или четырех нитей. [5] Мономолекулярные формы часто встречаются в природе вблизи концов хромосом, более известных как теломерные регионы, и в транскрипционных регуляторных регионах нескольких генов, как у микробов [6] [7], так и у позвоночных [8] [7], включая онкогены у людей. [9] Четыре основания гуанина могут связываться посредством водородных связей Хугстина, образуя квадратную плоскую структуру, называемую тетрадой гуанина (G-тетрада или G-квартет), а две или более тетрады гуанина (от G-трактов, непрерывных последовательностей гуанина) могут накладываться друг на друга, образуя G-квадруплекс.
Размещение и связывание для формирования G-квадруплексов не являются случайными и служат очень необычным функциональным целям. Структура квадруплекса дополнительно стабилизируется присутствием катиона , особенно калия , который находится в центральном канале между каждой парой тетрад. [3] Они могут быть образованы из ДНК , РНК , LNA и PNA и могут быть внутримолекулярными , бимолекулярными или тетрамолекулярными. [10] В зависимости от направления нитей или частей нити, которые образуют тетрады, структуры могут быть описаны как параллельные или антипараллельные . Структуры G-квадруплекса могут быть вычислительно предсказаны из мотивов последовательности ДНК или РНК, [11] [12] но их фактические структуры могут значительно различаться внутри и между мотивами, которых может быть более 100 000 на геном. Их активность в основных генетических процессах является активной областью исследований в области теломер, регуляции генов и функциональной геномики. [13] [14]
Идентификация структур с высокой ассоциацией гуанина стала очевидной в начале 1960-х годов посредством идентификации гелеобразных веществ, связанных с гуанинами. [15] Более конкретно, это исследование детализировало четырехцепочечные структуры ДНК с высокой ассоциацией гуанинов, которые позже были идентифицированы в эукариотических теломерных областях ДНК в 1980-х годах. [16] Важность открытия структуры G-квадруплекса была описана в утверждении: «Если G-квадруплексы так легко образуются in vitro , Природа нашла способ использовать их in vivo » - Аарон Клуг , лауреат Нобелевской премии по химии (1982). Интерес к функции G-квадруплексов in vivo резко возрос после того, как крупномасштабный геномный анализ показал распространенность потенциальных последовательностей, образующих G-квадруплекс (pG4), в промоторах генов человека, шимпанзе, мыши и крысы, представленных на Первой международной встрече по G-квадруплексам, состоявшейся в апреле 2007 года в Луисвилле, штат Кентукки. [7] В 2006 году было сообщено о распространенности G-квадруплексов в промоторах генов нескольких бактериальных геномов, что предсказывает регуляцию генов, опосредованную G-квадруплексом. [6] Благодаря обилию G-квадруплексов in vivo , эти структуры играют биологически значимую роль посредством взаимодействия с промоторными областями онкогенов и теломерными областями цепей ДНК. Текущие исследования заключаются в определении биологической функции этих структур G-квадруплексов для конкретных онкогенов и открытии эффективных терапевтических методов лечения рака на основе взаимодействия с G-квадруплексами. Ранние доказательства образования G-квадруплексов in vivo в клетках были получены путем их выделения из клеток [17] , а позднее — путем наблюдения за тем, что можно было идентифицировать специфические ДНК-хеликазы, где в клетках накапливались небольшие молекулы, специфичные для этих структур ДНК. [18]
Длина последовательностей нуклеиновых кислот, участвующих в формировании тетрады, определяет, как сворачивается квадруплекс. Короткие последовательности, состоящие только из одной смежной последовательности из трех или более оснований гуанина, требуют четырех отдельных нитей для образования квадруплекса. Такой квадруплекс описывается как тетрамолекулярный, что отражает необходимость четырех отдельных нитей. Термин G4 DNA изначально был зарезервирован для этих тетрамолекулярных структур, которые могут играть роль в мейозе . [5] Однако, как в настоящее время используется в молекулярной биологии, термин G4 может означать G-квадруплексы любой молекулярности. Более длинные последовательности, которые содержат две смежные последовательности из трех или более оснований гуанина, где области гуанина разделены одним или несколькими основаниями, требуют только двух таких последовательностей, чтобы обеспечить достаточное количество оснований гуанина для образования квадруплекса. Эти структуры, образованные из двух отдельных нитей, богатых G, называются бимолекулярными квадруплексами. Наконец, последовательности, которые содержат четыре отдельных ряда гуаниновых оснований, могут образовывать стабильные квадруплексные структуры сами по себе, а квадруплекс, образованный полностью из одной цепи, называется внутримолекулярным квадруплексом. [19]
В зависимости от того, как отдельные прогоны гуаниновых оснований расположены в бимолекулярном или внутримолекулярном квадруплексе, квадруплекс может принимать одну из ряда топологий с различными конфигурациями петель. [20] Если все нити ДНК идут в одном направлении, квадруплекс называется параллельным. Для внутримолекулярных квадруплексов это означает, что любые присутствующие области петель должны быть пропеллерного типа, расположенными по бокам квадруплекса. Если один или несколько прогонов гуаниновых оснований имеют направление 5'-3', противоположное другим прогонам гуаниновых оснований, говорят, что квадруплекс принял антипараллельную топологию. Петли, соединяющие прогоны гуаниновых оснований во внутримолекулярных антипараллельных квадруплексах, являются либо диагональными, соединяющими два диагонально противоположных прогона гуаниновых оснований, либо петлями бокового (реберного) типа, соединяющими два соседних прогона пар гуаниновых оснований.
В квадруплексах, образованных из двухцепочечной ДНК, также обсуждались возможные межцепочечные топологии [21] . [22] Межцепочечные квадруплексы содержат гуанины, которые происходят из обеих цепей двухцепочечной ДНК.
После секвенирования генома человека было обнаружено множество последовательностей, богатых гуанином, которые потенциально могли образовывать квадруплексы. [23] В зависимости от типа клеток и клеточного цикла, опосредующие факторы, такие как ДНК-связывающие белки на хроматине , состоящие из ДНК, плотно намотанной вокруг гистоновых белков, и другие условия окружающей среды и стрессы влияют на динамическое образование квадруплексов. Например, количественные оценки термодинамики молекулярного скучивания показывают , что антипараллельный g-квадруплекс стабилизируется молекулярным скучиванием. [24] Этот эффект, по-видимому, опосредован изменением гидратации ДНК и его влиянием на связывание пар оснований Хугстина . [25] Эти квадруплексы, по-видимому, легко возникают на концах хромосомы . Кроме того, склонность к образованию g-квадруплекса во время транскрипции в последовательностях РНК с потенциалом образовывать взаимоисключающие шпильковые или G-квадруплексные структуры в значительной степени зависит от положения последовательности, образующей шпильку. [26]
Поскольку ферменты репарации естественным образом распознают концы линейных хромосом как поврежденную ДНК и обрабатывают их как таковые, оказывая вредное воздействие на клетку, на концах линейных хромосом необходимы четкая сигнализация и жесткая регуляция. Функция теломеров заключается в обеспечении этой сигнализации. Теломеры, богатые гуанином и склонные к образованию g-квадруплексов, расположены на концевых концах хромосом и помогают поддерживать целостность генома, защищая эти уязвимые концы от нестабильности.
Эти теломерные регионы характеризуются длинными областями двухцепочечных повторов CCCTAA:TTAGGG. Повторы заканчиваются 3'-выступом из 10-50 одноцепочечных повторов TTAGGG. Гетеродимерный комплексный рибонуклеопротеиновый фермент теломераза добавляет повторы TTAGGG на 3'-конец цепей ДНК. На этих 3'-концевых выступах G-богатый выступ может образовывать вторичные структуры, такие как G-квадруплексы, если выступ длиннее четырех повторов TTAGGG. Наличие этих структур предотвращает удлинение теломер комплексом теломеразы. [27]
Было показано, что теломерные повторы в различных организмах образуют эти квадруплексные структуры in vitro , а впоследствии было показано, что они также образуются in vivo . [28] [29] Человеческий теломерный повтор (который одинаков для всех позвоночных ) состоит из множества повторов секвенированной (TTAGGG), и квадруплексы, образованные этой структурой, могут быть в виде бусин размером от 5 нм до 8 нм и были хорошо изучены с помощью ЯМР , ТЭМ и определения структуры рентгеновских лучей . [30] Было показано, что образование этих квадруплексов в теломерах снижает активность фермента теломеразы , который отвечает за поддержание длины теломер и участвует примерно в 85% всех видов рака . Это активная цель открытия лекарств, включая теломестатин .
Квадруплексы присутствуют в местах, отличных от теломер . Анализ геномов человека, шимпанзе, мыши и крысы показал огромное количество потенциальных последовательностей, образующих G-квадруплекс (pG4) в нетеломерных областях. Большое количество нетеломерных G-квадруплексов было обнаружено в промоторах генов и сохранилось у всех видов. [6] [7] Аналогично большое количество G-квадруплексов было обнаружено в E. coli и сотнях других микробных геномов. Здесь также, как и у позвоночных, G-квадруплексы были обогащены в промоторах генов. [6] Кроме того, в растениях и водорослях был обнаружен более миллиарда лет сохраняющегося локуса G-квадруплекса в гене, кодирующем большую субъединицу РНК-полимеразы II. [31] Хотя эти исследования предсказали опосредованную G-квадруплексом регуляцию генов, маловероятно, что все pG4 будут формироваться in vivo. Протоонкоген c -myc образует квадруплекс в гиперчувствительной к нуклеазе области, критической для активности гена. [32] [33] Другие гены, которые, как было показано, образуют G-квадруплексы в своих промоторных областях, включают ген куриного β-глобина , человеческую убиквитин -лигазу RFP2 и протоонкогены c-kit , bcl-2 , VEGF , H-ras и N-ras . [34] [35] [36]
Были проведены исследования по всему геному , основанные на правиле складывания квадруплексов, которые выявили 376 000 предполагаемых квадруплексных последовательностей (PQS) в геноме человека , хотя не все из них, вероятно, образуются in vivo . [37] Аналогичные исследования выявили предполагаемые G-квадруплексы в прокариотах , а именно в бактерии E. coli . [38] Существует несколько возможных моделей того, как квадруплексы могут влиять на активность генов, либо путем повышения , либо понижения . Одна из моделей показана ниже, с образованием G-квадруплекса в промоторе или рядом с ним, блокирующим транскрипцию гена и, следовательно, деактивирующим его. В другой модели квадруплекс, образованный на некодирующей цепи ДНК, помогает поддерживать открытую конформацию кодирующей цепи ДНК и усиливать экспрессию соответствующего гена.
Было высказано предположение, что образование квадруплекса играет роль в переключении тяжелой цепи иммуноглобулина . [5] Поскольку клетки развили механизмы для разрешения (т. е. раскручивания) образующихся квадруплексов. Образование квадруплекса может быть потенциально опасным для клетки; геликазы WRN и белок синдрома Блума имеют высокое сродство к разрешению G-квадруплексов ДНК. [39] Хеликаза DEAH/RHA, DHX36 , также была идентифицирована как ключевая резольваза G-квадруплекса. [40] [41] В 2009 году было обнаружено, что белок-супрессор метастазов NM23H2 (также известный как NME2) напрямую взаимодействует с G-квадруплексом в промоторе гена c-myc и транскрипционно регулирует c-myc. [42] [43] Совсем недавно сообщалось, что NM23H2 взаимодействует с G-квадруплексом в промоторе гена человеческой теломеразы (hTERT) и регулирует экспрессию hTERT [44] В 2019 году было показано, что фактор связывания теломер-2 (TRF2 или TERF2) связывается с тысячами нетеломерных G-квадруплексов в геноме человека с помощью TRF2 ChIP-seq. [45] Существует много исследований, которые предполагают участие квадруплексов как в положительной, так и в отрицательной регуляции транскрипции, включая эпигенетическую регуляцию генов, таких как hTERT. [44] Также сообщалось о функции G-квадруплексов в обеспечении запрограммированной рекомбинации генов тяжелой иммуноглобулина и системы антигенной вариации пилина патогенной Neisseria . [46] Роль структуры квадруплекса в контроле трансляции изучена не так хорошо. Прямая визуализация структур G-квадруплекса в клетках человека [47] , а также сокристаллическая структура РНК-хеликазы, связанной с G-квадруплексом [48], предоставили важные подтверждения их значимости для клеточной биологии. Потенциальные положительные и отрицательные роли квадруплексов в репликации и функционировании теломер остаются спорными. T-петли и G-квадруплексы описываются как две третичные структуры ДНК, которые защищают концы теломер и регулируют длину теломер. [49]
Многие из регуляторных процессов генома были связаны с образованием структур G-квадруплекса, что объясняется огромной ролью, которую он играет в репарации ДНК апуриновых/апиримидиновых сайтов, также известных как сайты AP. [50] Была разработана новая методика картирования сайтов AP, известная как AP-seq, которая использует меченый биотином альдегид-реактивный зонд (ARP) для маркировки определенных областей генома, где возникновение повреждений сайтов AP было значительным. [51] Другой метод секвенирования для картирования всего генома, известный как ChIP-секвенирование , был использован для картирования как повреждений в сайтах AP, так и фермента, ответственного за их восстановление, AP-эндонуклеазы 1 (APE1). Оба этих метода секвенирования для картирования всего генома, ChIP-секвенирование и ARP, показали, что возникновение повреждений сайтов AP не является случайным. Повреждение AP-сайта также было более распространено в определенных регионах генома, которые содержат специфические активные маркеры промотора и энхансера, некоторые из которых были связаны с регионами, ответственными за аденокарциному легких и рак толстой кишки. [52] Было обнаружено, что повреждение AP-сайта преобладает в регионах PQS генома, где образование структур G-квадруплекса регулируется и стимулируется процессом репарации ДНК, репарацией эксцизии оснований (BER). [52] Было доказано, что процессы репарации эксцизии оснований в клетках снижаются со старением, поскольку ее компоненты в митохондриях начинают снижаться, что может привести к формированию многих заболеваний, таких как болезнь Альцгеймера (БА). [53] Говорят, что эти структуры G-квадруплекса образуются в промоторных регионах ДНК посредством суперспиральности, которая способствует раскручиванию двойной спиральной структуры ДНК и, в свою очередь, закручивает нити, образуя структуры G-квадруплекса в регионах, богатых гуанином. [54] Путь BER сигнализируется, когда он указывает на окислительное повреждение основания ДНК, где структуры, такие как 8-оксогуанин-ДНК-гликозилаза 1 (OGG1), APE1 и G-квадруплекс играют огромную роль в его восстановлении. Эти ферменты участвуют в BER для восстановления определенных повреждений ДНК, таких как 7,8-дигидро-8-оксогуанин (8-oxoG), который образуется при окислительном стрессе в основания гуанина. [55]
Основания гуанина (G) в G-квадруплексе имеют самый низкий окислительно-восстановительный потенциал, что делает его более восприимчивым к образованию 8-оксогуанина (8-oxoG), эндогенного окисленного повреждения основания ДНК в геноме. Поскольку гуанин имеет более низкий потенциал восстановления электронов, чем другие основания нуклеотидов, [56] 8-оксо-2'-дезоксигуанозин (8-oxo-dG) является известным основным продуктом окисления ДНК. Его концентрация используется в качестве меры окислительного стресса в клетке. [57] Когда ДНК подвергается окислительному повреждению, возможное структурное изменение гуанина после ионизирующего излучения приводит к образованию енольной формы, 8-OH-Gua. Этот окислительный продукт образуется посредством таутомерного сдвига от исходного поврежденного гуанина, 8-oxo-Gua, и представляет собой повреждение ДНК, которое вызывает изменения в структуре. Эта форма позволяет ферменту репарации оснований эксцизионной репарации (BER) OGG1 связывать и удалять окислительное повреждение с помощью APE1, что приводит к образованию AP-сайта. [55] [53] Более того, AP-сайт — это место в ДНК, которое не имеет ни пуринового, ни пиримидинового основания из-за повреждения ДНК, они являются наиболее распространенным типом эндогенного повреждения ДНК в клетках. AP-сайты могут образовываться спонтанно или после расщепления модифицированных оснований, таких как 8-OH-Gua. [51] Образование AP-сайта позволяет расплавить дуплексную ДНК, чтобы раскрыть PQS, приняв [53] G-квадруплексную складку. С использованием анализа геномного секвенирования ChIP , клеточных анализов и биохимических анализов in vitro была установлена связь между окисленными AP-сайтами, полученными из оснований ДНК, и образованием G-квадруплекса. [52]
Влияние окисления ДНК на возникновение заболеваний
Кроме того, концентрация 8-oxo-dG является известным биомаркером окислительного стресса внутри клетки, а чрезмерное количество окислительного стресса связывают с канцерогенезом и другими заболеваниями. [58] При образовании 8-oxo-dG обладает способностью инактивировать OGG1, тем самым предотвращая восстановление повреждений ДНК, вызванных окислением гуанина. [52] Возможная инактивация позволяет невосстановленным повреждениям ДНК накапливаться в нереплицирующихся клетках, таких как мышцы, и также может вызывать старение. [57] Более того, окислительное повреждение ДНК, такое как 8-oxo-dG, способствует канцерогенезу посредством модуляции экспрессии генов или индукции мутаций. [57] При условии, что 8-oxo-dG восстанавливается BER, части белка репарации остаются, что может привести к эпигенетическим изменениям или модуляции экспрессии генов. [59] После введения 8-oxo-dG в ген тимидинкиназы человека было установлено, что если 8-oxo-dG не контролировать и не восстанавливать с помощью BER, это может привести к частым мутациям и в конечном итоге к канцерогенезу. [52] [53]
Эндонуклеаза AP 1 (APE1) — это фермент, отвечающий за продвижение и формирование структур G-квадруплекса. APE1 в основном отвечает за восстановление повреждений, нанесенных сайтам AP через путь BER. APE1 считается очень важным, поскольку повреждение сайта AP, как известно, является наиболее повторяющимся типом эндогенного повреждения ДНК. [59] Окисление определенных пуриновых оснований, таких как гуанин, образует окисленные нуклеотиды, которые нарушают функцию ДНК из-за несоответствия нуклеотидов в последовательностях. [57] Это чаще встречается в последовательностях PQS, которые образуют окисленные структуры, такие как 8-оксогуанин . Как только клетка осознает окислительный стресс и повреждение, она привлекает к сайту OGG1 , чья основная функция заключается в инициировании пути BER. [52] OGG1 делает это, расщепляя окисленное основание и таким образом создавая сайт AP, в первую очередь через процесс отрицательной суперспиральности. [54] Затем этот сайт AP подает клеткам сигнал о необходимости связывания APE1, который связывается с открытой дуплексной областью. [58] Затем связывание APE1 играет важную роль, стабилизируя образование структур G-квадруплекса в этой области. Это способствует образованию структур G-квадруплекса путем складывания основания. [60] Этот процесс образования петли сближает четыре основания, которые будут удерживаться вместе с помощью спаривания оснований Хугстина. После этой стадии APE1 ацетилируется несколькими остатками лизина на хроматине, образуя ацетилированный APE1 (AcAPE1). [60] AcAPE1 очень важен для пути BER, поскольку он действует как транскрипционный коактиватор или корепрессор, функционируя для загрузки факторов транскрипции (TF) в место повреждения, что позволяет ему регулировать экспрессию гена. [61] AcAPE1 также очень важен, поскольку он позволяет APE1 связываться в течение более длительных периодов времени за счет задержки его диссоциации от последовательности, что позволяет процессу восстановления быть более эффективным. [62] Деацетилирование AcAPE1 является движущей силой загрузки этих TF, где APE1 диссоциирует от структур G-квадруплекса. [63] Когда исследование снижало присутствие APE1 и AcAPE1 в клетке, образование структур G-квадруплекса было ингибировано, что доказывает важность APE1 для формирования этих структур. Однако не все структуры G-квадруплекса требуют APE1 для формирования, на самом деле некоторые из них образовывали более крупные структуры G-квадруплекса в его отсутствие. [52] Таким образом, мы можем сделать вывод, что APE1 играет две важные роли в регуляции генома: стабилизация формирования структур g-квадруплекса и загрузка факторов транскрипции на сайт AP.
G-квадруплексные последовательности, образующие последовательности, распространены в эукариотических клетках, особенно в теломерах, 5`-нетранслируемых цепях и горячих точках транслокации. G-квадруплексы могут подавлять нормальную функцию клеток, а в здоровых клетках легко и быстро раскручиваются геликазой . Однако в раковых клетках, в которых мутировала геликаза, эти комплексы не могут быть раскручены и приводят к потенциальному повреждению клетки. Это вызывает репликацию поврежденных и раковых клеток. Для терапевтических достижений стабилизация G-квадруплексов раковых клеток может подавлять рост и репликацию клеток, что приводит к гибели клетки . [64]
Наряду с ассоциацией G-квадруплексов в теломерных областях ДНК, структуры G-квадруплексов были идентифицированы в различных областях промотора человеческих протоонкогенов . Структуры, наиболее присутствующие в областях промотора этих онкогенов, как правило, представляют собой параллельно-цепочечные структуры ДНК G-квадруплексов. [65] Некоторые из этих онкогенов включают c-KIT, PDGF-A, c-Myc и VEGF, что показывает важность этой вторичной структуры в росте и развитии рака. Хотя формирование структуры G-квадруплекса в некоторой степени варьируется для различных областей промотора онкогенов, была обнаружена последовательная стабилизация этих структур при развитии рака. [66] Текущие терапевтические исследования активно фокусируются на нацеливании этой стабилизации структур G-квадруплексов для остановки нерегулируемого роста и деления клеток.
Один конкретный генный регион, путь c-myc, играет неотъемлемую роль в регуляции белкового продукта c-Myc. С этим продуктом белок c-Myc функционирует в процессах апоптоза и роста или развития клеток, а также в качестве транскрипционного контроля обратной транскриптазы теломеразы человека . [67] В 2009 году было показано, что взаимодействие промотора c-Myc G-квадруплекса с NM23H2 регулирует c-Myc в раковых клетках [42]
Регуляция c-myc через обратную транскриптазу теломеразы человека (hTERT) также напрямую регулируется через промотор G-квадруплекса путем взаимодействия с фактором транскрипции NM23H2, где эпигенетические модификации зависят от ассоциации NM23H2-G-квадруплекс. [44] Недавно сообщалось, что эпигенетическая регуляция hTERT опосредована взаимодействием промотора G-квадруплекса hTERT с теломерным фактором TRF2. [68]
Другой генный путь связан с геном VEGF, фактора роста эндотелия сосудов, который по-прежнему участвует в процессе ангиогенеза или образовании новых кровеносных сосудов. Образование внутримолекулярной структуры G-квадруплекса было показано с помощью исследований полипуринового тракта промоторной области гена VEGF. Благодаря недавним исследованиям роли функции G-квадруплекса in vivo было показано, что стабилизация структур G-квадруплекса регулирует транскрипцию гена VEGF с ингибированием факторов транскрипции в этом пути. Внутримолекулярные структуры G-квадруплекса образуются в основном за счет обильной последовательности гуанина в промоторной области этого специфического пути. [69] Ген ингибитора киназы контрольной точки циклин-зависимого клеточного цикла-1 CDKN1A (также известный как p21) содержит промотор G-квадруплекса. Взаимодействие этого G-квадруплекса с TRF2 (также известным как TERF2) привело к эпигенетической регуляции p21, что было протестировано с использованием лиганда 360A, связывающего G-квадруплекс. [70]
Фактор 1ɑ, индуцируемый гипоксией, HIF-1ɑ, по-прежнему участвует в передаче сигналов рака посредством связывания с элементом ответа на гипоксию, HRE, в присутствии гипоксии для начала процесса ангиогенеза . Благодаря недавним исследованиям этого специфического генного пути, полипуриновая и полипиримидиновая область допускает транскрипцию этого специфического гена и образование внутримолекулярной структуры G-квадруплекса. Однако необходимы дополнительные исследования, чтобы определить, регулирует ли образование G-квадруплекса экспрессию этого гена положительным или отрицательным образом. [71]
Онкоген c-kit имеет дело с путем, который кодирует RTK, который, как было показано, имеет повышенные уровни экспрессии при определенных типах рака. Богатая гуаниновая последовательность этого промоутерного региона показала способность образовывать различные квадруплексы. Текущие исследования этого пути сосредоточены на обнаружении биологической функции этого специфического образования квадруплекса на пути c-kit, в то время как эта квадруплексная последовательность была замечена у различных видов. [36]
Онкоген RET функционирует в транскрипции киназы , которая широко распространена в некоторых типах рака. Богатая гуанином последовательность в области промотора для этого пути указывает на необходимость базовой транскрипции этой рецепторной тирозинкиназы. При некоторых типах рака белок RET показал повышенные уровни экспрессии. Исследования этого пути предположили образование G-квадруплекса в области промотора и применимую мишень для терапевтического лечения. [72]
Другой онкогенный путь, включающий PDGF-A, тромбоцитарный фактор роста, включает процесс заживления ран и функционирует как митогенный фактор роста для клеток. Высокие уровни экспрессии PDGF были связаны с повышенным ростом клеток и раком. Наличие богатой гуанином последовательности в промоторной области PDGF-A продемонстрировало способность образовывать внутримолекулярные параллельные G-квадруплексные структуры и по-прежнему предполагается, что она играет роль в регуляции транскрипции PDGF-A. Однако исследования также выявили наличие G-квадруплексных структур в этой области из-за взаимодействия TMPyP4 с этой промоторной последовательностью. [73]
Теломеры, как правило, состоят из G-квадруплексов и остаются важными целями для терапевтических исследований и открытий. Эти комплексы имеют высокое сродство к порфириновым кольцам , что делает их эффективными противораковыми средствами. Однако TMPyP4 был ограничен в использовании из-за его неселективности по отношению к теломерам раковых клеток и нормальной двухцепочечной ДНК (dsDNA). Для решения этой проблемы был синтезирован аналог TMPyP4, известный как 5Me, который нацелен только на G-квадруплексную ДНК, которая подавляет рост рака более эффективно, чем TMPyP4. [74]
Разработка и проектирование лигандов остается важной областью исследований терапевтических реагентов из-за обилия G-квадруплексов и их множественных конформационных различий. Один тип лиганда, включающий производное хиндолина, SYUIQ-05, использует стабилизацию G-квадруплексов в промоторных областях для ингибирования продукции как продукта белка c-Myc, так и обратной транскриптазы человеческой теломеразы (hTERT). Этот основной путь нацеливания на эту область приводит к отсутствию удлинения теломеразы, что приводит к остановке развития клеток. Дальнейшие исследования остаются необходимыми для открытия единственной генной мишени для минимизации нежелательной реактивности с более эффективной противоопухолевой активностью. [67]
Одним из способов индукции или стабилизации образования G-квадруплекса является введение молекулы, которая может связываться со структурой G-квадруплекса. Ряд лигандов , которые могут быть как малыми молекулами, так и белками , могут связываться с G-квадруплексом. Эти лиганды могут быть как естественными, так и синтетическими. Это становится все более обширной областью исследований в генетике, биохимии и фармакологии.
Было показано, что катионные порфирины интеркаляционно связываются с G-квадруплексами, а также с молекулой теломестатина .
Связывание лигандов с G-квадруплексами жизненно важно для противораковых исследований, поскольку G-квадруплексы обычно обнаруживаются в горячих точках транслокации. MM41, лиганд, который селективно связывается с квадруплексом на промоторе BCL-2 , имеет форму центрального ядра и 4 боковых цепей, стерически разветвляющихся наружу. Форма лиганда жизненно важна, поскольку она точно соответствует квадруплексу, который имеет сложенные квартеты и петли нуклеиновых кислот, удерживающие его вместе. При связывании центральный хромофор MM41 располагается на вершине 3'-концевого G-квартета, а боковые цепи лиганда ассоциируются с петлями квадруплекса. Квартет и хромофор связаны π-π связью, в то время как боковые цепи и петли не связаны, но находятся в непосредственной близости. Сильным это связывание делает текучесть в положении петель, что позволяет им лучше связываться с боковыми цепями лиганда. [75]
TMPyP4, катионный порфирин, является более известным лигандом связывания G4, который помогает подавлять c-Myc. Способ, которым TMPyP4 связывается с G4, похож на MM41, с кольцом, наложенным на внешний G-квартет, и боковыми цепями, связанными с петлями G4. [76]
При проектировании лигандов для связывания с G-квадруплексами лиганды имеют более высокое сродство к параллельно сложенным G-квадруплексам. Было обнаружено, что лиганды с меньшими боковыми цепями лучше связываются с квадруплексом, поскольку меньшие лиганды имеют более концентрированную электронную плотность . Кроме того, водородные связи лигандов с меньшими боковыми цепями короче и, следовательно, прочнее. Лиганды с подвижными боковыми цепями, которые способны вращаться вокруг своего центрального хромофора, сильнее ассоциируются с G-квадруплексами, поскольку конформация петель G4 и боковых цепей лиганда может выровняться. [77]
Определение и предсказание последовательностей, которые способны образовывать квадруплексы, является важным инструментом для дальнейшего понимания их роли. Обычно для поиска возможных внутрицепочечных квадруплексообразующих последовательностей используется простое сопоставление с образцом: d(G 3+ N 1-7 G 3+ N 1-7 G 3+ N 1-7 G 3+ ), где N — любое нуклеотидное основание (включая гуанин ). [78] Это правило широко использовалось в онлайн- алгоритмах . Хотя правило эффективно идентифицирует сайты образования G-квадруплекса, оно также идентифицирует подмножество несовершенных гомопуриновых зеркальных повторов, способных к образованию триплекса [79] и образованию i-мотива C-цепи. [80] Более того, эти последовательности также способны образовывать смещенные и фолдбэк-структуры, которые являются неявными промежуточными звеньями в образовании как квадруплексных [4] , так и триплексных структур ДНК [81] . В одном исследовании [82] было обнаружено, что наблюдаемое число на пару оснований (т. е. частота) этих мотивов быстро возросло у эуметазоа , для которых доступны полные геномные последовательности. Это говорит о том, что последовательности могут находиться под положительным отбором, который стал возможным благодаря эволюции систем, способных подавлять формирование не-B-структур.
Совсем недавно были разработаны усовершенствованные веб-инструменты для идентификации последовательностей, формирующих G-квадруплекс, включая удобную для пользователя и открытую версию G4Hunter, основанную на подходе скользящего окна [83] или G4RNA Screener, основанный на алгоритме машинного обучения. [84]
Для идентификации G-квадруплексов был разработан ряд экспериментальных методов. Эти методы можно в целом разделить на два класса: биофизические и биохимические методы. [85]
Биохимические методы были использованы для исследования образования G-квадруплекса в контексте более длинной последовательности. В анализе остановки ДНК-полимеразы образование G-квадруплекса в ДНК-матрице может действовать как препятствие и вызывать остановку полимеразы, что останавливает удлинение праймера. [86] Диметилсульфат (DMS) с последующим анализом расщепления пиперидином основан на том факте, что образование G-квадруплекса запретит метилирование гуанина N7, вызванное DMS, что приводит к защитному паттерну, наблюдаемому в области G-квадруплекса ДНК после расщепления пиперидином. [87]
Топологию структуры G-квадруплекса можно определить, отслеживая положительные или отрицательные сигналы кругового дихроизма (CD) на определенных длинах волн. [88] Параллельные G-квадруплексы имеют отрицательные и положительные сигналы CD при 240 и 262 нм соответственно, тогда как антипараллельные G-квадруплексы размещают эти сигналы при 262 и 295 нм соответственно. Чтобы проверить образование G-квадруплекса, следует также провести эксперименты CD в условиях, не стабилизирующих G-квадруплекс (Li+), и в условиях, стабилизирующих G-квадруплекс (таких как K+ или с лигандами G-квадруплекса), и сканировать в направлении дальней УФ-области (180–230 нм). Аналогичным образом, термостабильность структуры G-квадруплекса можно определить, наблюдая УФ-сигнал при 295 нм. [89] При плавлении G-квадруплекса поглощение УФ-излучения при 295 нм уменьшается, что приводит к гипохромному сдвигу, который является отличительной чертой структуры G-квадруплекса. Другой подход к обнаружению G-квадруплексов включает методы на основе нанопор . Во-первых, было показано, что биологические нанопоры могут обнаруживать G-квадруплексы на основе исключения размера и специфического взаимодействия G-квадруплекса и белковой нанополости. [90] Новый подход объединяет твердотельные нанопоры и ДНК-нанотехнологию для обнаружения G-квадруплексов без меток, для их картирования на dsDNA и для мониторинга образования G-квадруплекса. [91]
G-квадруплексы вовлечены в неврологические расстройства посредством двух основных механизмов. Первый механизм заключается в расширении G-повторов в генах, что приводит к образованию структур G-квадруплексов, которые напрямую вызывают заболевание, как в случае с геном C9orf72 и боковым амиотрофическим склерозом (БАС) или лобно-височной деменцией (ЛВД). Второй механизм заключается в мутациях, которые влияют на экспрессию белков, связывающих G-квадруплексы, как это наблюдается в гене 1 умственной отсталости ломкой X- хромосомы (FMR1) и синдроме ломкой X-хромосомы . [92]
Ген C9orf72 кодирует белок C9orf72 , который находится по всему мозгу в цитоплазме нейронов и в пресинаптических окончаниях. [93] Мутации гена C9orf72 связаны с развитием ЛВД и БАС. [94] Эти два заболевания имеют причинно-следственную связь с повторами GGGGCC (G 4 C 2 ) в 1-м интроне гена C9orf72. У нормальных людей обычно имеется около 2-8 повторов G 4 C 2 , но у людей с ЛВД или БАС имеется от 500 до нескольких тысяч повторов G 4 C 2 . [95] [96] Было показано, что транскрибированная РНК этих повторов образует стабильные G-квадруплексы, при этом имеются данные, показывающие, что повторы G 4 C 2 в ДНК также способны образовывать смешанные параллельно-антипараллельные структуры G-квадруплексов. [97] [98] Было показано, что эти РНК-транскрипты, содержащие повторы G 4 C 2, связывают и разделяют широкий спектр белков, включая нуклеолин . Нуклеолин участвует в синтезе и созревании рибосом в ядре, а разделение нуклеолина мутированными РНК-транскриптами нарушает ядрышковую функцию и синтез рибосомальной РНК. [99]
Белок умственной отсталости ломкой Х-хромосомы (FMRP) — широко экспрессируемый белок, кодируемый геном FMR1, который связывается с вторичными структурами G-квадруплекса в нейронах и участвует в синаптической пластичности . [100] FMRP действует как отрицательный регулятор трансляции, а его связывание стабилизирует структуры G-квадруплекса в транскриптах мРНК, ингибируя рибосомное удлинение мРНК в дендрите нейрона и контролируя время экспрессии транскрипта. [101] [102] Мутации этого гена могут вызывать развитие синдрома ломкой Х-хромосомы, аутизма и других неврологических расстройств. [103] В частности, синдром ломкой Х-хромосомы вызывается увеличением с 50 до более чем 200 повторов CGG в экзоне 13 гена FMR1. Это повторное расширение способствует метилированию ДНК и другим эпигенетическим гетерохроматиновым модификациям FMR1, которые предотвращают транскрипцию гена, что приводит к патологически низким уровням FMRP. [104] [105]
Антисмысловые вмешательства и лиганды малых молекул являются распространенными стратегиями, используемыми для нацеливания на неврологические заболевания, связанные с повторами расширения G-квадруплекса. Поэтому эти методы особенно выгодны для нацеливания на неврологические заболевания, которые имеют механизм усиления функции, когда измененный генный продукт имеет новую функцию или новую экспрессию гена; это было обнаружено в C9orf72 (хромосома 9 открытая рамка считывания 72). [106]
Антисмысловая терапия — это процесс, при котором синтезированные нити нуклеиновых кислот используются для прямого и специфического связывания с мРНК, продуцируемой определенным геном, что инактивирует ее. Антисмысловые олигонуклеотиды (ASO) обычно используются для нацеливания на РНК C9orf72 области повторения расширения G-квадруплекса GGGGCC, что снизило токсичность в клеточных моделях C9orf72. [107] [108] [109] ASO ранее использовались для восстановления нормальных фенотипов при других неврологических заболеваниях, имеющих механизмы усиления функции, единственное отличие заключается в том, что они использовались при отсутствии областей повторения расширения G-квадруплекса. [110] [111] [112] [113]
Стратегия приманки G-квадруплекса является еще одним многообещающим подходом к нацеливанию на раковые клетки путем использования уникальных структурных особенностей G-квадруплекса. Стратегия включает в себя разработку синтетических олигонуклеотидов , которые имитируют структуру G-квадруплекса и конкурируют с эндогенными G-квадруплексами за связывание с факторами транскрипции. Эти приманки обычно состоят из последовательности, богатой G, которая может образовывать стабильную структуру G-квадруплекса, и короткой линкерной области, которая может быть модифицирована для оптимизации их свойств. [114] При введении в раковые клетки приманка может перехватывать связанные факторы транскрипции и связывать их, что приводит к регуляции экспрессии генов. Было успешно продемонстрировано, что приманки ингибируют онкогенный KRAS у мышей SCID, что приводит к снижению роста опухоли и увеличению медианного времени выживания. [115]
Другой часто используемый метод — использование низкомолекулярных лигандов . Их можно использовать для воздействия на области G-квадруплекса, вызывающие неврологические расстройства. Существует около 1000 различных лигандов G-квадруплекса, в которых они способны взаимодействовать через свои ароматические кольца ; это позволяет низкомолекулярным лигандам укладываться на плоских концевых тетрадах в областях G-квадруплекса. Недостатком использования низкомолекулярных лигандов в качестве терапевтического метода является то, что специфичностью трудно управлять из-за изменчивости G-квадруплексов в их первичных последовательностях, ориентации, термодинамической стабильности и стехиометрии нитей нуклеиновой кислоты. На данный момент [ когда? ] ни один низкомолекулярный лиганд не смог быть совершенно специфичным для одной последовательности G-квадруплекса. [116] [117] Однако катионный порфирин, известный как TMPyP4, способен связываться с областью повтора C9orf72 GGGGCC, что приводит к развертыванию области повтора G-квадруплекса и потере взаимодействия с белками, что приводит к потере его функциональности. [118] Маломолекулярные лиганды, состоящие в основном из свинца, также могут воздействовать на области повтора GGGGCC и в конечном итоге снижают как связанную с повтором не-ATG трансляцию, так и фокусы РНК в нейронных клетках, полученных от пациентов с боковым амиотрофическим склерозом (БАС). Это свидетельствует о том, что маломолекулярные лиганды являются эффективным и действенным процессом для нацеливания на области GGGGCC, и что специфичность связывания маломолекулярных лигандов является достижимой целью для научного сообщества.
Металлические комплексы имеют ряд особенностей, которые делают их особенно подходящими в качестве связующих веществ ДНК G4 и, следовательно, в качестве потенциальных лекарств. Хотя металл играет в основном структурную роль в большинстве связующих веществ G4, есть также примеры, когда он напрямую взаимодействует с G4 посредством электростатических взаимодействий или прямой координации с азотистыми основаниями. [119]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ){{cite book}}: |journal=проигнорировано ( помощь ){{cite book}}: |journal=проигнорировано ( помощь )