
Соединение Холлидея представляет собой разветвленную структуру нуклеиновой кислоты , содержащую четыре соединенных двухцепочечных плеча. Эти плечи могут принимать одну из нескольких конформаций в зависимости от концентрации буферной соли и последовательности азотистых оснований, ближайших к соединению. Структура названа в честь Робина Холлидея , молекулярного биолога , который предположил ее существование в 1964 году.
В биологии соединения Холлидея являются ключевым промежуточным звеном во многих типах генетической рекомбинации , а также в репарации двухцепочечных разрывов . Эти соединения обычно имеют симметричную последовательность и, таким образом, являются подвижными, что означает, что четыре отдельных плеча могут скользить через соединение в определенном порядке, который в значительной степени сохраняет спаривание оснований . Кроме того, соединения с четырьмя плечами, похожие на соединения Холлидея, появляются в некоторых функциональных молекулах РНК .
Неподвижные соединения Холлидея с асимметричными последовательностями, которые фиксируют нити в определенном положении, были искусственно созданы учеными для изучения их структуры в качестве модели для природных соединений Холлидея. Эти соединения также позже нашли применение в качестве основных структурных строительных блоков в нанотехнологии ДНК , где несколько соединений Холлидея могут быть объединены в определенные спроектированные геометрии, которые обеспечивают молекулам высокую степень структурной жесткости .
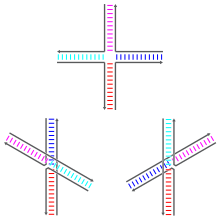
Соединения Холлидея могут существовать в различных конформационных изомерах с различными моделями коаксиальной укладки между четырьмя двойными спиральными плечами. Коаксиальная укладка — это тенденция тупых концов нуклеиновых кислот связываться друг с другом посредством взаимодействия между открытыми основаниями. Существует три возможных конформера: неупакованная (или открытая-X) форма и две упаковываемые формы. Неупакованная форма доминирует в отсутствие двухвалентных катионов, таких как Mg2 + , из-за электростатического отталкивания между отрицательно заряженными остовами нитей. В присутствии по крайней мере около 0,1 мМ Mg2 + электростатическое отталкивание нейтрализуется, и упаковываемые структуры преобладают. По состоянию на 2000 год не было точно известно, является ли электростатическое экранирование результатом сайт-специфического связывания катионов с соединением или наличия диффузного сбора ионов в растворе. [1]
Несложенная форма представляет собой почти квадратную плоскую, расширенную конформацию. С другой стороны, сложенные конформеры имеют два непрерывных домена двойной спирали, разделенных углом около 60° в правом направлении. Две из четырех нитей остаются примерно спиральными, оставаясь внутри каждого из двух доменов двойной спирали, в то время как другие две пересекают два домена антипараллельным образом . [ 1]
Две возможные сложенные формы различаются тем, какие пары плеч сложены друг с другом; какая из двух доминирует, в значительной степени зависит от последовательностей оснований, ближайших к соединению. Некоторые последовательности приводят к равновесию между двумя конформерами, в то время как другие решительно предпочитают один конформер. В частности, соединения, содержащие последовательность A-CC, соединяющую точку соединения, по-видимому, решительно предпочитают конформер, который позволяет образовывать водородную связь между вторым цитозином и одним из фосфатов в точке соединения. Хотя большинство исследований были сосредоточены на идентичности четырех оснований, ближайших к соединению на каждом плече, очевидно, что основания, расположенные дальше, также могут влиять на наблюдаемые конформации укладки. [1]
В соединениях с симметричными последовательностями точка ветвления подвижна и может мигрировать в процессе случайного блуждания . Скорость миграции ветвей резко меняется в зависимости от концентрации ионов, при этом время одного шага увеличивается с 0,3 до 0,4 мс без ионов до 270−300 мс при 10 мМ Mg2 + . Изменение скорости коррелирует с образованием сложенных по сравнению с не сложенными структурами. [1]
Соединения Холлидея с надрезом или разрывом в одной из цепей в точке соединения принимают перпендикулярную ориентацию и всегда предпочитают конформер укладки, который помещает надрез на кроссоверную цепочку, а не на спиральную цепочку. [1]
Соединения Холлидея РНК принимают антипараллельную стопочную конформацию при высоких концентрациях магния, перпендикулярную стопочную конформацию при умеренных концентрациях и поворачиваются в параллельную стопочную конформацию при низких концентрациях, в то время как даже небольшие концентрации ионов кальция благоприятствуют антипараллельному конформеру. [1]

Соединение Холлидея является ключевым промежуточным звеном в гомологичной рекомбинации , биологическом процессе, который увеличивает генетическое разнообразие путем смещения генов между двумя хромосомами , а также в событиях сайт-специфической рекомбинации с участием интеграз . Они также участвуют в восстановлении двухцепочечных разрывов . [1] Кроме того, крестообразные структуры , включающие соединения Холлидея, могут возникать для снятия спирального напряжения в симметричных последовательностях в суперспиралях ДНК . [2] Хотя четырехплечевые соединения также появляются в функциональных молекулах РНК, таких как РНК-сплайсосома U1 и шпильковый рибозим вируса кольцевой пятнистости табака , они обычно содержат неспаренные нуклеотиды между парными двухспиральными доменами и, таким образом, не принимают строго структуру Холлидея. [1]
Соединения Холлидея в гомологичной рекомбинации находятся между идентичными или почти идентичными последовательностями, что приводит к симметричному расположению последовательностей вокруг центрального соединения. Это позволяет процессу миграции ветвей происходить там, где нити перемещаются через точку соединения. [1] Расщепление или разрешение соединения Холлидея может происходить двумя способами. Расщепление исходного набора нитей приводит к двум молекулам, которые могут показывать генную конверсию , но не хромосомный кроссинговер , в то время как расщепление другого набора из двух нитей заставляет полученные рекомбинантные молекулы показывать кроссинговер. Все продукты, независимо от расщепления, являются гетеродуплексами в области миграции соединения Холлидея. [3]
Многие белки способны распознавать или искажать структуру соединения Холлидея. Один из таких классов содержит ферменты, разрешающие соединения , которые расщепляют соединения, иногда в последовательности-специфической манере. Такие белки искажают структуру соединения различными способами, часто вытягивая соединение в несложенную конформацию, разрывая центральные пары оснований и/или изменяя углы между четырьмя плечами. Другие классы - это белки миграции ветвей, которые увеличивают скорость обмена на порядки, и сайт-специфические рекомбиназы . [1] У прокариот резольвазы соединений Холлидея делятся на два семейства, интегразы и нуклеазы, каждое из которых структурно похоже, хотя их последовательности не сохраняются. [3]
У эукариот две основные модели того, как гомологичная рекомбинация восстанавливает двухцепочечные разрывы в ДНК, — это путь репарации двухцепочечных разрывов (DSBR) (иногда называемый моделью двойного соединения Холлидея ) и путь синтез-зависимого отжига цепи (SDSA). [4] В случае двухцепочечного разрыва 3'-конец деградирует, а более длинный 5'-конец вторгается в смежную сестринскую хроматиду, образуя репликационный пузырь. Когда этот пузырек приближается к разорванной ДНК, более длинная 5'-антисмысловая цепь снова вторгается в смысловую цепь этой части ДНК, транскрибируя вторую копию. Когда репликация заканчивается, оба хвоста снова соединяются, образуя два соединения Холлидея, которые затем расщепляются белками в различных узорах. [5] Анимацию этого процесса можно увидеть здесь. [6]
Двухцепочечные разрывы ДНК у бактерий восстанавливаются путем гомологичной рекомбинации RecBCD . Разрывы, которые происходят только на одной из двух цепей ДНК, известные как одноцепочечные разрывы, как полагают, восстанавливаются путем RecF . Оба пути RecBCD и RecF включают серию реакций, известных как миграция ветвей, в которой отдельные цепи ДНК обмениваются между двумя перекрещенными молекулами дуплексной ДНК, и разрешение , в которой эти две перекрещенные молекулы ДНК разрезаются и восстанавливаются до своего нормального двухцепочечного состояния. [7] Гомологичная рекомбинация происходит в нескольких группах вирусов. В ДНК-вирусах, таких как вирус герпеса , рекомбинация происходит посредством механизма разрыва и повторного соединения, как у бактерий и эукариот. [8] У бактерий миграция ветвей облегчается комплексом RuvABC или белком RecG, молекулярными моторами, которые используют энергию гидролиза АТФ для перемещения соединения. Затем соединение должно быть разделено на два отдельных дуплекса, восстанавливая либо родительскую конфигурацию, либо кроссоверную конфигурацию. Разрешение может происходить как горизонтально, так и вертикально во время гомологичной рекомбинации, давая продукты заплатки (если они находятся в одной ориентации во время репарации двухцепочечного разрыва) или продукты сплайсинга (если они находятся в разных ориентациях во время репарации двухцепочечного разрыва). [9] [10] RuvA и RuvB являются белками миграции ветвей, в то время как RuvC является ферментом разрешения соединений. [1]
Существуют доказательства рекомбинации в некоторых РНК-вирусах , в частности, вирусах с положительной полярностью ssRNA, таких как ретровирусы , пикорнавирусы и коронавирусы . Существуют разногласия относительно того, происходит ли гомологичная рекомбинация в вирусах с отрицательной полярностью ssRNA, таких как грипп . [11]
В почкующихся дрожжах Saccharomyces cerevisiae соединения Холлидея могут быть разрешены четырьмя различными путями, которые по сути отвечают за все разрешение соединений Холлидея in vivo . [12] Путь, который производит большинство кроссинговеров в почкующихся дрожжах S. cerevisiae , и, возможно, у млекопитающих, включает белки EXO1 , гетеродимер MLH1 - MLH3 (называемый MutL gamma) и SGS1 (ортолог геликазы синдрома Блума ). [12] Гетеродимер MLH1-MLH3 связывается преимущественно с соединениями Холлидея. [13] Это эндонуклеаза, которая делает одноцепочечные разрывы в суперспирализованной двухцепочечной ДНК. [13] [14] Гетеродимер MLH1-MLH3 способствует образованию кроссоверных рекомбинантов . [15] В то время как другие три пути, включающие белки MUS81 -MMS4, SLX1 и YEN1 соответственно, могут способствовать разрешению соединений Холлидея in vivo, отсутствие всех трех нуклеаз оказывает лишь умеренное влияние на образование продуктов кроссинговера.
Двойные мутанты, удаленные как для MLH3 (основной путь), так и для MMS4 (второстепенный путь), показали значительно сниженный кроссинговер по сравнению с диким типом (в 6–17 раз); однако жизнеспособность спор была достаточно высокой (62%), а хромосомное расхождение оказалось в основном функциональным. [15]
Хотя MUS81 является компонентом второстепенного пути кроссинговера в мейозе почкующихся дрожжей, растений и позвоночных, [16] у простейших Tetrahymena thermophila MUS81, по-видимому, является частью существенного, если не преобладающего пути кроссинговера. [16] Путь MUS81 также, по-видимому, является преобладающим путем кроссинговера у делящихся дрожжей Schizosaccharomyces pombe . [16]
Белки MSH4 и MSH5 образуют гетероолигомерную структуру (гетеродимер) у дрожжей и людей. [17] [18] [19] У дрожжей Saccharomyces cerevisiae MSH4 и MSH5 действуют специфически, облегчая кроссинговер между гомологичными хромосомами во время мейоза. [17] Комплекс MSH4/MSH5 связывает и стабилизирует двойные соединения Холлидея и способствует их разрешению в продукты кроссинговера. Гипоморфный (частично функциональный) мутант MSH4 S. cerevisiae показал 30%-ное снижение числа кроссинговеров по всему геному и большое количество мейозов с необменными хромосомами. [20] Тем не менее, этот мутант дал начало моделям жизнеспособности спор, предполагающим, что сегрегация необменных хромосом происходила эффективно. Таким образом, у S. cerevisiae надлежащая сегрегация, по-видимому, не полностью зависит от кроссинговеров между гомологичными парами.

ДНК-нанотехнология — это проектирование и производство искусственных структур нуклеиновых кислот в качестве конструкционных материалов для нанотехнологий, а не в качестве носителей генетической информации в живых клетках. В этой области разветвленные структуры ДНК используются в качестве основных компонентов для создания более сложных, рационально спроектированных структур. Таким образом, соединения Холлидея являются компонентами многих таких структур ДНК. Поскольку изолированные комплексы соединений Холлидея слишком гибки для сборки в большие упорядоченные массивы, структурные мотивы с несколькими соединениями Холлидея используются для создания жестких « плиток », которые затем могут собираться в более крупные «массивы». [22] [23]

Наиболее распространенным таким мотивом является комплекс двойного кроссовера (DX), который содержит два соединения Холлидея в непосредственной близости друг от друга, что приводит к жесткой структуре, которая может самоорганизовываться в более крупные массивы. Структура молекулы DX заставляет соединения Холлидея принимать конформацию с доменами двойной спирали, расположенными непосредственно рядом, в отличие от их предпочтительного угла около 60°. Комплекс может быть разработан так, чтобы заставить соединения либо принять параллельную, либо антипараллельную ориентацию, но на практике антипараллельная разновидность ведет себя лучше, а параллельная версия используется редко. [22] [23]
Структурный мотив DX является фундаментальным строительным блоком метода ДНК-оригами , который используется для создания более крупных двух- и трехмерных структур произвольной формы. Вместо использования отдельных плиток DX, одна длинная нить каркаса складывается в желаемую форму с помощью ряда коротких скрепочных нитей. При сборке нить каркаса непрерывна через домены двойной спирали, в то время как скрепочные нити участвуют в соединениях Холлидея как кроссоверные нити. [25]
Были продемонстрированы некоторые типы плиток, которые сохраняют естественный угол 60° соединения Холлидея. Один из таких массивов использует плитки, содержащие четыре соединения Холлидея в параллелограммном расположении. Эта структура имела преимущество, позволяя непосредственно визуализировать угол соединения с помощью атомно-силовой микроскопии . Плитки из трех соединений Холлидея в треугольной форме использовались для создания периодических трехмерных массивов для использования в рентгеновской кристаллографии биомолекул. Эти структуры названы из-за их сходства со структурными единицами, основанными на принципе тенсегрити , который использует элементы как в растяжении, так и в сжатии. [22] [23]
Робин Холлидей предложил структуру соединения, которая теперь носит его имя как часть его модели гомологичной рекомбинации в 1964 году, основанную на его исследованиях организмов Ustilago maydis и Saccharomyces cerevisiae . Модель предоставила молекулярный механизм, который объяснил как генную конверсию , так и хромосомный кроссинговер . Холлидей понял, что предложенный путь создаст гетеродуплексные сегменты ДНК с несовпадением оснований между различными версиями одного гена. Он предсказал, что клетка будет иметь механизм для исправления несовпадений, который был позже обнаружен. [3] До модели Холлидея принятая модель включала механизм копирования-выбора [26] , где новая цепь синтезируется непосредственно из частей различных родительских цепей. [27]
В оригинальной модели Холлидея для гомологичной рекомбинации одноцепочечные разрывы происходят в одной и той же точке на одной цепи каждой родительской ДНК. Свободные концы каждой разорванной цепи затем мигрируют к другой спирали ДНК. Там вторгшиеся цепи соединяются со свободными концами, с которыми они сталкиваются, в результате чего образуется соединение Холлидея. Поскольку каждая кроссоверная цепь повторно отжигается со своей исходной партнерской цепью, она вытесняет исходную комплементарную цепь перед собой. Это заставляет соединение Холлидея мигрировать, создавая гетеродуплексные сегменты. В зависимости от того, какая цепь использовалась в качестве шаблона для восстановления другой, четыре клетки, полученные в результате мейоза, могут оказаться с тремя копиями одного аллеля и только одной другой вместо обычных двух каждой, свойство, известное как генная конверсия. [3]
Первоначальная модель Холлидея предполагала, что гетеродуплексная ДНК будет присутствовать на обеих хромосомах, но экспериментальные данные по дрожжам опровергли это. Обновленная модель Мэтта Месельсона и Чарли Раддинга в 1975 году ввела идею миграции ветвей. [26] Дальнейшие наблюдения в 1980-х годах привели к предложению альтернативных механизмов рекомбинации, таких как модель двухцепочечного разрыва ( Джека Шостака , Фрэнка Шталя и других) и модель одноцепочечного отжига. Третья, модель отжига нитей, зависящая от синтеза, не включала соединения Холлидея. [3]
Первые экспериментальные доказательства структуры соединения Холлидея были получены в ходе исследований с помощью электронной микроскопии в конце 1970-х годов, где четырехрукавная структура была четко видна на изображениях плазмидной и бактериофаговой ДНК. Позднее, в 1980-х годах, были идентифицированы ферменты, ответственные за инициирование образования соединений Холлидея и связывание с ними, хотя по состоянию на 2004 год идентификация резольваз соединений Холлидея у млекопитающих оставалась неуловимой (однако, см. раздел «Разрешение соединений Холлидея» выше для получения более свежей информации). В 1983 году искусственные молекулы соединений Холлидея были впервые сконструированы из синтетических олигонуклеотидов Надрианом Симаном , что позволило провести более прямое изучение их физических свойств. Большая часть раннего анализа структуры соединений Холлидея была выведена из гель-электрофореза , FRET и исследований гидроксильных радикалов и нуклеазного футпринтинга. В 1990-х годах стали доступны методы кристаллографии и ЯМР нуклеиновых кислот , а также инструменты вычислительного молекулярного моделирования . [1] [3] [28]
Первоначально генетики предполагали, что соединение примет параллельную, а не антипараллельную конформацию, поскольку это поместило бы гомологичные дуплексы в более близкое расположение друг к другу. [1] Химический анализ в 1980-х годах показал, что соединение на самом деле предпочитает антипараллельную конформацию, открытие, которое считалось спорным, и сам Робин Холлидей изначально сомневался в этих открытиях. [1] [3] Антипараллельная структура позже получила широкое признание благодаря данным рентгеновской кристаллографии молекул in vitro , хотя по состоянию на 2004 год ее значение для структуры in vivo оставалось неясным, особенно структура соединений часто изменяется белками, связанными с ней. [3]
Концептуальная основа для ДНК-нанотехнологии была впервые заложена Надрианом Симаном в начале 1980-х годов. [29] В то время было известно несколько природных разветвленных структур ДНК, включая репликативную вилку ДНК и подвижное соединение Холлидея, но идея Симана заключалась в том, что неподвижные соединения нуклеиновых кислот могут быть созданы путем правильного проектирования последовательностей нитей для удаления симметрии в собранной молекуле, и что эти неподвижные соединения в принципе могут быть объединены в жесткие кристаллические решетки. Первая теоретическая статья, предлагающая эту схему, была опубликована в 1982 году, а первая экспериментальная демонстрация неподвижного соединения ДНК была опубликована в следующем году. [23] [30] Симан разработал более жесткий мотив двойного кроссинговера (DX) , подходящий для формирования двумерных решеток, продемонстрированный в 1998 году им и Эриком Уинфри . [22] В 2006 году Пол Ротемунд впервые продемонстрировал технику ДНК-оригами для простого и надежного создания складчатых структур ДНК произвольной формы. Этот метод позволил создать гораздо более крупные структуры, чем это было возможно ранее, и которые менее сложны в техническом плане для проектирования и синтеза. [31] Синтез трехмерной решетки был наконец опубликован Симаном в 2009 году, почти через тридцать лет после того, как он намеревался достичь этого. [32]