Конфокальная микроскопия , чаще всего конфокальная лазерная сканирующая микроскопия ( CLSM ) или лазерная сканирующая конфокальная микроскопия (LSCM), представляет собой метод оптического изображения для увеличения оптического разрешения и контрастности микрофотографии посредством использования пространственной точечной дыры для блокировки расфокусированного света . в формировании имиджа. [1] Захват нескольких двумерных изображений на разной глубине в образце позволяет реконструировать трехмерные структуры (процесс, известный как оптическое разрезание ) внутри объекта. Этот метод широко используется в научных и промышленных кругах, а типичными применениями являются науки о жизни , контроль полупроводников и материаловедение .
Свет проходит через образец под обычным микроскопом настолько глубоко, насколько это возможно, в то время как конфокальный микроскоп фокусирует только меньший луч света на одном узком уровне глубины за раз. CLSM обеспечивает контролируемую и сильно ограниченную глубину резкости.


Принцип конфокальной визуализации был запатентован в 1957 году Марвином Мински [2] и направлен на преодоление некоторых ограничений традиционных флуоресцентных микроскопов с широким полем зрения . [3] В обычном (т.е. широкопольном) флуоресцентном микроскопе весь образец равномерно освещается светом от источника света. Все части образца могут быть возбуждены одновременно, и возникающая в результате флуоресценция регистрируется фотодетектором или камерой микроскопа , включая большую несфокусированную фоновую часть. Напротив, конфокальный микроскоп использует точечное освещение (см. « Функция распространения точки ») и точечное отверстие в оптически сопряженной плоскости перед детектором для устранения сигнала вне фокуса - название «конфокальный» происходит от этой конфигурации. Поскольку можно обнаружить только свет, создаваемый флуоресценцией очень близко к фокальной плоскости , оптическое разрешение изображения , особенно в направлении глубины образца, намного лучше, чем у широкоугольных микроскопов. Однако, поскольку большая часть света флуоресценции образца блокируется в точечном отверстии, такое повышенное разрешение достигается за счет снижения интенсивности сигнала, поэтому часто требуются длительные экспозиции . Чтобы компенсировать это падение сигнала после точечного отверстия , интенсивность света обнаруживается чувствительным детектором, обычно фотоумножителем (ФЭУ) или лавинным фотодиодом , преобразующим световой сигнал в электрический. [4]
Поскольку одновременно освещается только одна точка образца, 2D или 3D визуализация требует сканирования обычного растра (т. е. прямоугольного рисунка параллельных линий сканирования) в образце. Луч сканируется по образцу в горизонтальной плоскости с помощью одного или нескольких ( сервоуправляемых ) колеблющихся зеркал. Этот метод сканирования обычно имеет низкую задержку реакции , а скорость сканирования можно изменять. Более медленное сканирование обеспечивает лучшее соотношение сигнал/шум , что приводит к лучшей контрастности .
Достижимая толщина фокальной плоскости определяется главным образом длиной волны используемого света, разделенной на числовую апертуру объектива , а также оптическими свойствами образца. Возможность получения тонких оптических срезов делает эти типы микроскопов особенно эффективными при 3D-визуализации и профилировании поверхности образцов.
Последовательные срезы составляют «z-стек», который можно либо обработать для создания 3D-изображения, либо объединить в 2D-стек (преимущественно берется максимальная интенсивность пикселей, другие распространенные методы включают использование стандартного отклонения или суммирование пикселей). [1]
Конфокальная микроскопия обеспечивает возможность прямого, неинвазивного, серийного оптического разделения неповрежденных, толстых, живых образцов с минимальной подготовкой проб, а также незначительное улучшение латерального разрешения по сравнению с широкопольной микроскопией. [4] Биологические образцы часто обрабатывают флуоресцентными красителями , чтобы сделать выбранные объекты видимыми. Однако фактическая концентрация красителя может быть низкой, чтобы свести к минимуму нарушение биологических систем: некоторые инструменты могут отслеживать отдельные флуоресцентные молекулы. Кроме того, с помощью трансгенных методов можно создавать организмы, которые производят свои собственные флуоресцентные химерные молекулы (например, слияние GFP, зеленого флуоресцентного белка с интересующим белком). Конфокальные микроскопы работают по принципу точечного возбуждения в образце (пятно, ограниченное дифракцией) и точечного обнаружения результирующего флуоресцентного сигнала. Отверстие в детекторе обеспечивает физический барьер, блокирующий флуоресценцию вне фокуса. Записывается только фокус, или центральное пятно диска Эйри .
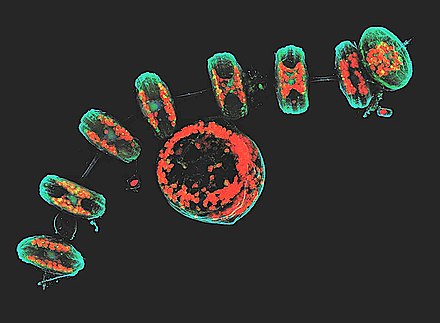
В продаже имеются четыре типа конфокальных микроскопов:
В конфокальных лазерных сканирующих микроскопах используется несколько зеркал (обычно 2 или 3, сканирующих линейно вдоль осей X и Y) для сканирования лазером по образцу и «десканирования» изображения через фиксированное отверстие и детектор. Этот процесс обычно медленный и не работает для изображений в реальном времени, но может быть полезен для создания репрезентативных изображений фиксированных образцов с высоким разрешением.
Конфокальные микроскопы с вращающимся диском ( диск Нипкова ) используют серию движущихся отверстий на диске для сканирования световых пятен. Поскольку ряд точечных отверстий сканирует область параллельно, каждому точечному отверстию разрешено зависать над определенной областью в течение более длительного периода времени, тем самым уменьшая энергию возбуждения, необходимую для освещения образца, по сравнению с лазерными сканирующими микроскопами. Снижение энергии возбуждения снижает фототоксичность и фотообесцвечивание образца, что часто делает его предпочтительной системой для визуализации живых клеток или организмов.
Конфокальные микроскопы с улучшенными микролинзами или с двойным вращающимся диском работают по тем же принципам, что и конфокальные микроскопы с вращающимся диском, за исключением того, что второй вращающийся диск, содержащий микролинзы, помещается перед вращающимся диском, содержащим точечные отверстия. Каждому точечному отверстию соответствует соответствующая микролинза. Микролинзы улавливают широкую полосу света и фокусируют ее в каждом точечном отверстии, значительно увеличивая количество света, направляемого в каждое точечное отверстие, и уменьшая количество света, блокируемого вращающимся диском. Таким образом, конфокальные микроскопы с микролинзами значительно более чувствительны, чем стандартные системы с вращающимся диском. Yokogawa Electric изобрела эту технологию в 1992 году. [5]
В программируемых матричных микроскопах (PAM) используется пространственный модулятор света (SLM) с электронным управлением, который создает набор движущихся точечных отверстий. SLM — это устройство, содержащее массив пикселей с некоторыми свойствами ( непрозрачностью , отражательной способностью или оптическим вращением ) отдельных пикселей, которые можно регулировать электронным способом. SLM содержит микроэлектромеханические зеркала или жидкокристаллические компоненты. Изображение обычно получается камерой с зарядовой связью (CCD).
Каждый из этих классов конфокальных микроскопов имеет свои преимущества и недостатки. Большинство систем оптимизированы либо для скорости записи (т. е. захвата видео), либо для высокого пространственного разрешения. Конфокальные лазерные сканирующие микроскопы могут иметь программируемую плотность выборки и очень высокое разрешение, в то время как Nipkow и PAM используют фиксированную плотность выборки, определяемую разрешением камеры. Частота кадров изображения обычно ниже для систем одноточечного лазерного сканирования, чем для систем с вращающимся диском или PAM. Коммерческие конфокальные микроскопы с вращающимся диском достигают частоты кадров более 50 в секунду [6] – желательная функция для динамических наблюдений, таких как визуализация живых клеток.
На практике Нипков и PAM позволяют нескольким точечным отверстиям сканировать одну и ту же область параллельно [7] при условии, что точечные отверстия расположены достаточно далеко друг от друга.
Передовые разработки конфокальной лазерной сканирующей микроскопии теперь позволяют получать изображения со скоростью видеосъемки, превышающей стандартную (60 кадров в секунду), с использованием нескольких микроэлектромеханических сканирующих зеркал.
Конфокальная рентгеновская флуоресцентная визуализация — это новый метод, который позволяет контролировать глубину в дополнение к горизонтальному и вертикальному наведению, например, при анализе скрытых слоев на картине. [8]
CLSM — это метод сканирования изображений, полученное разрешение которого лучше всего объяснить путем сравнения его с другим методом сканирования, например, с использованием сканирующего электронного микроскопа (SEM). Преимущество CLSM заключается в том, что не требуется подвешивать датчик на расстоянии нанометра от поверхности, как, например, в AFM или STM , где изображение получается путем сканирования тонкой иглой по поверхности. Расстояние от объектива до поверхности (называемое рабочим расстоянием ) обычно сравнимо с расстоянием обычного оптического микроскопа. Оно зависит от оптической конструкции системы, но типично рабочее расстояние от сотен микрометров до нескольких миллиметров.
В CLSM образец освещается точечным лазерным источником, и каждому элементу объема соответствует дискретная интенсивность рассеяния или флуоресценции. Здесь размер объема сканирования определяется размером пятна (близкого к дифракционному пределу) оптической системы, поскольку изображение сканирующего лазера представляет собой не бесконечно малую точку, а трехмерную дифракционную картину. Размер этой дифракционной картины и определяемый ею фокальный объем контролируются числовой апертурой объектива системы и длиной волны используемого лазера. Это можно рассматривать как классический предел разрешения обычных оптических микроскопов, использующих широкоугольное освещение. Однако с помощью конфокальной микроскопии можно даже улучшить предел разрешения методов широкопольного освещения, поскольку конфокальную апертуру можно закрыть, чтобы исключить более высокие порядки дифракционной картины . Например, если диаметр точечного отверстия установлен на 1 единицу Эйри , то только первый порядок дифракционной картины проходит через апертуру детектора, в то время как более высокие порядки блокируются, тем самым улучшая разрешение за счет небольшого уменьшения яркости. При флуоресцентных наблюдениях предел разрешения конфокальной микроскопии часто ограничивается соотношением сигнал/шум, вызванным небольшим количеством фотонов, обычно доступных во флуоресцентной микроскопии. Компенсировать этот эффект можно применением более чувствительных фотоприемников или увеличением интенсивности освещающего точечного лазерного источника. Увеличение интенсивности лазерного освещения может привести к чрезмерному обесцвечиванию или другому повреждению интересующего образца, особенно для экспериментов, в которых требуется сравнение яркости флуоресценции. При визуализации тканей с дифференциальной рефракцией, таких как губчатый мезофилл листьев растений или других тканей, содержащих воздушное пространство, часто возникают сферические аберрации, которые ухудшают качество конфокального изображения. Однако такие аберрации можно значительно уменьшить, помещая образцы в оптически прозрачные, нетоксичные перфторуглероды , такие как перфтордекалин , который легко проникает в ткани и имеет показатель преломления, почти идентичный показателю преломления воды. [9]
CLSM широко используется в различных биологических дисциплинах, от клеточной биологии и генетики до микробиологии и биологии развития . [10] Он также используется в квантовой оптике, визуализации нанокристаллов и спектроскопии.
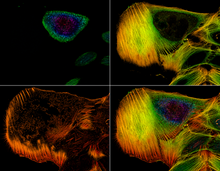
Клинически CLSM используется при оценке различных заболеваний глаз и особенно полезен для визуализации, качественного анализа и количественного определения эндотелиальных клеток роговицы . [11] Он используется для локализации и выявления присутствия нитевидных грибковых элементов в строме роговицы в случаях кератомикоза , что позволяет быстро поставить диагноз и, тем самым, на раннем этапе назначить окончательную терапию. Многообещающими также являются исследования методов CLSM для эндоскопических процедур ( эндомикроскопии ). [12] В фармацевтической промышленности было рекомендовано следить за процессом изготовления тонкопленочных лекарственных форм, чтобы контролировать качество и равномерность распределения лекарств. [13] Конфокальную микроскопию также используют для изучения биопленок — сложных пористых структур, которые являются предпочтительной средой обитания микроорганизмов. Некоторые временные и пространственные функции биопленок можно понять только путем изучения их структуры на микро- и мезо-масштабах. Исследование на микроуровне необходимо для выявления активности и организации одиночных микроорганизмов. [14]
CLSM используется в качестве механизма поиска данных в некоторых системах хранения 3D-оптических данных и помог определить возраст папируса Магдалины .
Система IRENE использует конфокальную микроскопию для оптического сканирования и восстановления поврежденных исторических аудиозаписей. [15]
Лазерные сканирующие конфокальные микроскопы используются для исследования поверхности микроструктурированных материалов, таких как кремниевые пластины, используемые при производстве солнечных элементов . На первых этапах обработки пластины подвергаются мокрому химическому травлению кислотными или щелочными соединениями, придающими текстуру их поверхности. Затем с помощью лазерной конфокальной микроскопии наблюдают за состоянием полученной поверхности на рычаге микрометра. Лазерную конфокальную микроскопию также можно использовать для анализа толщины и высоты пальцев металлизации, напечатанных на верхней части солнечных элементов.
Функция рассеяния точки точечного отверстия представляет собой эллипсоид, длина которого в несколько раз превышает его ширину. Это ограничивает осевое разрешение микроскопа. Одним из методов решения этой проблемы является микроскопия 4Pi , при которой падающий и/или излучаемый свет может интерферировать как сверху, так и снизу образца, чтобы уменьшить объем эллипсоида. Альтернативный метод — конфокальная тета-микроскопия . В этом методе конус освещающего света и обнаруженный свет располагаются под углом друг к другу (лучшие результаты, когда они перпендикулярны). Пересечение двух точечных функций распределения дает гораздо меньший эффективный объем выборки. В результате появился микроскоп с одноплоскостным освещением . Кроме того , можно использовать деконволюцию с использованием экспериментально полученной функции рассеяния точки для удаления не сфокусированного света, улучшая контраст как в осевой, так и в боковой плоскостях.
Существуют конфокальные варианты, которые достигают разрешения ниже дифракционного предела, такие как микроскопия истощения стимулированного излучения (STED). Помимо этого метода, доступен широкий спектр других (не конфокальных) методов сверхразрешения, таких как PALM, (d)STORM , SIM и так далее. Все они имеют свои преимущества, такие как простота использования, разрешение и необходимость специального оборудования, буферов или флуорофоров.
Для изображения образцов при низких температурах использовались два основных подхода, оба основанные на архитектуре лазерной сканирующей конфокальной микроскопии . Один из подходов заключается в использовании криостата непрерывного потока : только образец находится при низкой температуре и оптически обрабатывается через прозрачное окно. [16] Другой возможный подход — разместить часть оптики (особенно объектива микроскопа) в криогенном хранилище Дьюара . [17] Этот второй подход, хотя и более громоздкий, гарантирует лучшую механическую стабильность и позволяет избежать потерь из-за окна.
Для изучения молекулярных взаимодействий с использованием CLSM можно использовать резонансный перенос энергии Фёрстера (FRET), чтобы подтвердить, что два белка находятся на определенном расстоянии друг от друга.

В 1940 году Ганс Гольдманн, офтальмолог из Берна , Швейцария, разработал систему щелевой лампы для документирования осмотров глаз. [18] Некоторые более поздние авторы считают эту систему первой конфокальной оптической системой. [19] [20]
В 1943 году Зюн Коана опубликовал конфокальную систему. [21] [19]
В 1951 году Хирото Наора, коллега Коана, описал в журнале Science конфокальный микроскоп для спектрофотометрии . [22]
Первый конфокальный сканирующий микроскоп был построен Марвином Мински в 1955 году, а патент был подан в 1957 году. Сканирование точки освещения в фокальной плоскости достигалось за счет перемещения предметного столика. Ни одной научной публикации представлено не было, и никаких изображений, сделанных с ее помощью, не сохранилось. [2] [23]

В 1960-х годах чехословацкий Моймир Петрань с медицинского факультета Карлова университета в Пльзене разработал тандемный сканирующий микроскоп, первый коммерческий конфокальный микроскоп. Он продавался небольшой компанией в Чехословакии и в США компанией Tracor-Northern (позже Noran) и использовал вращающийся диск Нипкова для создания множества точечных отверстий возбуждения и излучения. [20] [24]
Чехословацкий патент был подан в 1966 году Петраном и Миланом Хадравским, чехословацким коллегой. Первая научная публикация с данными и изображениями, полученными с помощью этого микроскопа, была опубликована в журнале Science в 1967 году под авторством М. Дэвида Эггера из Йельского университета и Петрана. [25] В примечании к этой статье упоминается, что Петрань спроектировал микроскоп и руководил его конструкцией, а также что он частично был «научным сотрудником» в Йельском университете. Во второй публикации 1968 года описывалась теория и технические детали прибора, а дополнительными авторами были Хадравский и Роберт Галамбос , руководитель группы в Йельском университете. [26] В 1970 году был выдан патент США. Оно было подано в 1967 году. [27]
В 1969 и 1971 годах М. Дэвид Эггер и Пол Давидовиц из Йельского университета опубликовали две статьи, описывающие первый конфокальный лазерный сканирующий микроскоп. [28] [29] Это был точечный сканер, то есть генерировалось только одно пятно освещения. Для наблюдения за нервной тканью использовалась микроскопия с отражением эпи-освещения. Гелий-неоновый лазер мощностью 5 мВт и длиной волны 633 нм отражался полупрозрачным зеркалом в сторону объектива. Объектив представлял собой простую линзу с фокусным расстоянием 8,5 мм. В отличие от всех более ранних и наиболее поздних систем, образец сканировался движением этой линзы (объективное сканирование), приводящим к перемещению точки фокуса. Отраженный свет возвращался к полупрозрачному зеркалу, прошедшая часть фокусировалась другой линзой на детектирующем отверстии, за которым располагался фотоумножитель. Сигнал визуализировался ЭЛТ осциллографа, катодный луч перемещался одновременно с объективом. Специальное устройство позволило сделать фотографии Polaroid , три из которых были показаны в публикации 1971 года.
Авторы размышляют о флуоресцентных красителях для исследований in vivo . Они цитируют патент Мински, благодарят Стива Баера, в то время аспиранта Медицинской школы Альберта Эйнштейна в Нью-Йорке, где он разработал конфокальный линейный сканирующий микроскоп, [30] за предложение использовать лазер с «микроскопом Минского» и Благодарим Галамбоса, Хадравского и Петрана за обсуждения, приведшие к разработке их микроскопа. Мотивацией для их разработки было то, что в тандемном сканирующем микроскопе только часть 10 -7 света освещения участвует в формировании изображения в окуляре. Таким образом, качество изображения было недостаточным для большинства биологических исследований. [19] [31]
В 1977 году Колин Дж. Р. Шеппард и Амарджиоти Чоудхури из Оксфорда , Великобритания, опубликовали теоретический анализ конфокальных и лазерных сканирующих микроскопов. [32] Вероятно, это первая публикация, в которой используется термин «конфокальный микроскоп». [19] [31]
В 1978 году братья Кристоф Кремер и Томас Кремер опубликовали конструкцию конфокального лазерного сканирующего микроскопа, использующего флуоресцентное возбуждение с электронной автофокусировкой. Они также предложили лазерную подсветку точек с использованием «4π-точечной голограммы ». [31] [33] Эта конструкция CLSM впервые объединила метод лазерного сканирования с 3D-обнаружением биологических объектов, меченных флуоресцентными маркерами .
В 1978 и 1980 годах Оксфордская группа во главе с Колином Шеппардом и Тони Уилсоном описала конфокальный микроскоп с эпилазерной подсветкой, предметным сканированием и фотоумножителями в качестве детекторов. Платформа могла перемещаться вдоль оптической оси (ось Z), позволяя получать последовательные оптические срезы. [31]
В 1979 году Фред Бракенхофф и его коллеги продемонстрировали, что теоретические преимущества оптического секционирования и улучшения разрешения действительно достижимы на практике. В 1985 году эта группа стала первой, кто опубликовал убедительные изображения, полученные с помощью конфокального микроскопа и способные ответить на биологические вопросы. [34] Вскоре после этого многие другие группы начали использовать конфокальную микроскопию для ответа на научные вопросы, которые до тех пор оставались загадкой из-за технологических ограничений.
В 1983 году И. Дж. Кокс и К. Шеппард из Оксфорда опубликовали первую работу, в которой конфокальный микроскоп управлялся компьютером. Первый коммерческий лазерный сканирующий микроскоп, столик-сканер SOM-25, был предложен Oxford Optoelectronics (после нескольких поглощений, приобретенных BioRad), начиная с 1982 года. Он был основан на разработке Оксфордской группы. [20] [35]
В середине 1980-х годов Уильям Брэдшоу Амос и Джон Грэм Уайт и их коллеги, работавшие в Лаборатории молекулярной биологии в Кембридже , построили первый сканирующий конфокальный лучевой микроскоп. [36] [37] Стол с образцом не двигался, вместо этого двигалось пятно освещения, что позволяло быстрее получать изображения: четыре изображения в секунду по 512 строк каждое. Чрезвычайно увеличенные промежуточные изображения благодаря длине пути луча 1–2 метра позволили использовать обычную ирисовую диафрагму в качестве «обскуры» диаметром ~ 1 мм. Первые микрофотографии были сделаны с длительной экспозицией на пленку до того, как была добавлена цифровая камера. Дальнейшее усовершенствование позволило впервые приблизиться к подготовке. Zeiss , Leitz и Cambridge Instruments не были заинтересованы в коммерческом производстве. [38] Совет медицинских исследований (MRC) наконец спонсировал разработку прототипа. Конструкция была приобретена Bio-Rad , дополнена компьютерным управлением и коммерциализирована как «MRC 500». Преемник MRC 600 позже стал основой для разработки первого двухфотонного флуоресцентного микроскопа , разработанного в 1990 году в Корнельском университете . [34]
Примерно в то же время разработки в Королевском технологическом институте KTH в Стокгольме привели к созданию коммерческого CLSM, распространяемого шведской компанией Sarastro. [39] Предприятие было приобретено в 1990 году компанией Molecular Dynamics, [40] но в конечном итоге деятельность CLSM была прекращена. В Германии компания Heidelberg Instruments, основанная в 1984 году, разработала CLSM, который изначально предназначался для промышленного применения, а не для биологии. Этот инструмент был приобретен в 1990 году компанией Leica Lasertechnik . Zeiss уже имел на рынке неконфокальный лазерный сканирующий микроскоп с летающим пятном, который был модернизирован до конфокального. В отчете 1990 года [41] упоминались некоторые производители конфокальных линз: Sarastro, Technical Instruments, Meridian Instruments, Bio-Rad, Leica, Tracor-Northern и Zeiss. [34]
В 1989 году Фриц Карл Прейкшат вместе со своим сыном Экхардом Прейкшатом изобрел сканирующий лазерный диодный микроскоп для анализа размеров частиц. [42] [43] и стал соучредителем Lasentec для его коммерциализации. В 2001 году компания Lasentec была приобретена Mettler Toledo . [44] Они используются в основном в фармацевтической промышленности для обеспечения контроля процесса кристаллизации на месте в крупных системах очистки.
В стандартных конфокальных инструментах второе или «выходное» отверстие используется для фильтрации излучаемого или рассеянного света. Традиционно это отверстие представляет собой пассивный компонент, который блокирует свет для его оптической фильтрации. Однако в новых разработках эту фильтрацию пытались выполнить в цифровом виде.
Недавние подходы заменили пассивную обскуру составным детекторным элементом. Обычно после цифровой обработки этот подход приводит к лучшему разрешению и фотонному бюджету, поскольку предел разрешения может приближаться к пределу бесконечно малого отверстия. [45]
Другие исследователи попытались в цифровом виде перефокусировать свет от точечного источника возбуждения, используя глубокие сверточные нейронные сети. [46]
{{cite journal}}: Отсутствует или пусто |title=( помощь ) Статья доступна на сайте журнала. PDF-файл с пометкой «P359 - 402» имеет размер 19 020 килобайт и содержит также соседние статьи из того же номера. На рис. 1б статьи показана схема конфокального пути прохождения луча.