
Культура клеток или тканей — это процесс, при котором клетки выращиваются в контролируемых условиях, как правило, за пределами их естественной среды. После того, как интересующие клетки были выделены из живой ткани , их можно впоследствии поддерживать в тщательно контролируемых условиях. Их необходимо содержать при температуре тела (37 °C) в инкубаторе. [1] Эти условия различаются для каждого типа клеток, но, как правило, состоят из подходящего сосуда с субстратом или богатой средой , которая поставляет необходимые питательные вещества ( аминокислоты , углеводы , витамины , минералы ), факторы роста , гормоны и газы ( CO2 , O2 ) и регулирует физико-химическую среду ( буфер pH , осмотическое давление , температура ) . Большинству клеток требуется поверхность или искусственный субстрат для формирования адгезивной культуры в виде монослоя (толщиной в одну клетку), тогда как другие можно выращивать свободно плавающими в среде в качестве суспензионной культуры . [2] Обычно это облегчается с помощью жидкой, полутвердой или твердой среды для роста , такой как бульон или агар . Под культурой тканей обычно понимают культуру клеток и тканей животных, а для растений используется более конкретный термин « культура растительных тканей ». Продолжительность жизни большинства клеток генетически определена, но некоторые клетки клеточной культуры были «преобразованы» в бессмертные клетки, которые будут размножаться бесконечно, если будут созданы оптимальные условия.
На практике термин «культура клеток» теперь относится к культивированию клеток, полученных из многоклеточных эукариот , особенно животных клеток, в отличие от других типов культуры, которые также выращивают клетки, таких как культура растительных тканей , культура грибов и микробиологическая культура ( микробов ). Историческое развитие и методы культивирования клеток тесно взаимосвязаны с таковыми в культуре тканей и органной культуре . Вирусная культура также связана с клетками в качестве хозяев вирусов.
Лабораторная техника поддержания живых клеточных линий (популяции клеток, произошедших от одной клетки и содержащих одинаковый генетический состав), отделенных от их исходного источника ткани, стала более надежной в середине 20-го века. [ 3 ] [4]
Английский физиолог XIX века Сидней Рингер разработал солевые растворы, содержащие хлориды натрия, калия, кальция и магния, подходящие для поддержания биения изолированного сердца животного вне тела. [5] В 1885 году Вильгельм Ру удалил часть мозговой пластинки эмбриона цыпленка и поддерживал ее в теплом солевом растворе в течение нескольких дней, установив основной принцип культивирования тканей. В 1907 году зоолог Росс Грэнвилл Харрисон продемонстрировал рост эмбриональных клеток лягушки, которые давали начало нервным клеткам в среде свернувшейся лимфы . В 1913 году Э. Стейнхардт, К. Израэли и Р. А. Ламберт вырастили вирус коровьей оспы во фрагментах роговичной ткани морской свинки. [6] В 1996 году впервые регенеративная ткань была использована для замены небольшого участка уретры, что привело к пониманию того, что метод получения образцов ткани, выращивания ее вне тела без каркаса и повторного применения может быть использован только для небольших расстояний менее 1 см. [7] [8] [9] Росс Грэнвилл Харрисон , работавший в Медицинской школе Джонса Хопкинса , а затем в Йельском университете , опубликовал результаты своих экспериментов с 1907 по 1910 год, установив методологию культивирования тканей . [10]
Готтлиб Хаберландт первым указал на возможности культуры изолированных тканей, культуры растительных тканей . [11] Он предположил, что потенциальные возможности отдельных клеток через культуру тканей, а также взаимное влияние тканей друг на друга могут быть определены этим методом. После первоначальных утверждений Хаберландта были реализованы методы культивирования тканей и клеток, что привело к значительным открытиям в биологии и медицине. Он представил свою оригинальную идею тотипотенциальности в 1902 году, заявив, что «Теоретически все растительные клетки способны дать начало полноценному растению». [12] [13] [14] Термин «культура тканей » был придуман американским патологом Монтроузом Томасом Берроузом . [15]
Методы культивирования клеток были значительно усовершенствованы в 1940-х и 1950-х годах для поддержки исследований в области вирусологии . Выращивание вирусов в клеточных культурах позволило подготовить очищенные вирусы для производства вакцин . Инъекционная вакцина против полиомиелита, разработанная Джонасом Солком, была одним из первых продуктов, массово производимых с использованием методов культивирования клеток. Эта вакцина стала возможной благодаря исследованиям в области культивирования клеток Джона Франклина Эндерса , Томаса Хакла Уэллера и Фредерика Чепмена Роббинса , которые были удостоены Нобелевской премии за открытие метода выращивания вируса в культурах клеток почек обезьян . Культура клеток внесла вклад в разработку вакцин от многих заболеваний. [1]

В современном использовании «культура ткани» обычно относится к росту клеток из ткани многоклеточного организма in vitro . Эти клетки могут быть клетками, выделенными из организма-донора ( первичные клетки ) или бессмертной клеточной линией . Клетки купаются в культуральной среде, которая содержит основные питательные вещества и источники энергии, необходимые для выживания клеток. [16] Таким образом, в более широком смысле «культура ткани» часто используется взаимозаменяемо с «культурой клеток». С другой стороны, строгое значение «культуры ткани» относится к культивированию кусочков ткани, т. е. культуре эксплантатов .
Культура тканей является важным инструментом для изучения биологии клеток многоклеточных организмов. Она обеспечивает in vitro модель ткани в четко определенной среде, которой можно легко манипулировать и анализировать. В культуре тканей животных клетки могут выращиваться в виде двумерных монослоев (обычная культура) или внутри волокнистых каркасов или гелей для достижения более натуралистичных трехмерных тканеподобных структур (3D-культура). Эрик Саймон в отчете по гранту NIH SBIR 1988 года показал, что электропрядение может использоваться для производства нано- и субмикронных полимерных волокнистых каркасов, специально предназначенных для использования в качестве субстратов клеток и тканей in vitro . Это раннее использование электропрядильных волокнистых решеток для клеточной культуры и тканевой инженерии показало, что различные типы клеток будут прилипать к поликарбонатным волокнам и размножаться на них. Было отмечено, что в отличие от уплощенной морфологии, обычно наблюдаемой в двумерной культуре, клетки, выращенные на электропрядильных волокнах, демонстрируют более округлую трехмерную морфологию, обычно наблюдаемую в тканях in vivo . [17]
В частности, культура растительной ткани занимается выращиванием целых растений из небольших кусочков растительной ткани, культивируемых в среде. [18]
Клетки могут быть выделены из тканей для культивирования ex vivo несколькими способами. Клетки можно легко очистить от крови; однако только белые клетки способны к росту в культуре. Клетки могут быть выделены из твердых тканей путем переваривания внеклеточного матрикса с использованием таких ферментов , как коллагеназа , трипсин или проназа , перед перемешиванием ткани для высвобождения клеток в суспензию. [19] [20] В качестве альтернативы, кусочки ткани можно поместить в питательную среду , и вырастающие клетки доступны для культивирования. Этот метод известен как культура эксплантатов .
Клетки, которые культивируются непосредственно от субъекта, известны как первичные клетки. За исключением некоторых, полученных из опухолей, большинство первичных клеточных культур имеют ограниченную продолжительность жизни.
Установленная или бессмертная клеточная линия приобрела способность размножаться неограниченно либо посредством случайной мутации, либо преднамеренной модификации, такой как искусственная экспрессия гена теломеразы . Многочисленные клеточные линии хорошо известны как представители определенных типов клеток .
Большинство изолированных первичных клеток подвергаются процессу старения и прекращают делиться после определенного числа удвоений популяции, в целом сохраняя при этом свою жизнеспособность (это называется пределом Хейфлика ).

Помимо температуры и газовой смеси, наиболее часто изменяемым фактором в системах культивирования является среда для роста клеток . Рецепты сред для роста могут различаться по pH , концентрации глюкозы, факторам роста и наличию других питательных веществ. Факторы роста, используемые для дополнения сред, часто получают из сыворотки крови животных, такой как сыворотка плода крупного рогатого скота (FBS), сыворотка быка, сыворотка лошади и свиная сыворотка. Одним из осложнений этих ингредиентов, полученных из крови, является возможность заражения культуры вирусами или прионами , особенно в медицинских биотехнологических приложениях. Текущая практика заключается в минимизации или исключении использования этих ингредиентов, где это возможно, и использовании лизата тромбоцитов человека (hPL). [21] Это устраняет беспокойство о межвидовом загрязнении при использовании FBS с человеческими клетками. hPL стал безопасной и надежной альтернативой в качестве прямой замены FBS или другой животной сыворотки. Кроме того, химически определенные среды могут использоваться для устранения любых следов сыворотки (человеческой или животной), но это не всегда можно сделать с разными типами клеток. Альтернативные стратегии включают получение крови животных из стран с минимальным риском губчатой энцефалопатии крупного рогатого скота (ГЭКРС) / туберкулёзной энцефалопатии крупного рогатого скота (ТГЭКРС) , таких как США, Австралия и Новая Зеландия [22] , а также использование очищенных питательных концентратов, полученных из сыворотки, вместо цельной сыворотки животных для культивирования клеток [23] .
Плотность посева (количество клеток на объем питательной среды) играет критическую роль для некоторых типов клеток. Например, более низкая плотность посева заставляет гранулезные клетки проявлять продукцию эстрогена, в то время как более высокая плотность посева заставляет их выглядеть как прогестерон -продуцирующие текалютеиновые клетки . [24]
Клетки можно выращивать либо в суспензионных , либо в адгезивных культурах . [25] Некоторые клетки естественным образом живут в суспензии, не будучи прикрепленными к поверхности, например, клетки, которые существуют в кровотоке. Существуют также клеточные линии, которые были модифицированы для того, чтобы иметь возможность выживать в суспензионных культурах, чтобы их можно было выращивать до более высокой плотности, чем позволяют адгезивные условия. Адгезивным клеткам требуется поверхность, например, пластик для тканевой культуры или микроноситель , который может быть покрыт компонентами внеклеточного матрикса (такими как коллаген и ламинин) для повышения адгезионных свойств и предоставления других сигналов, необходимых для роста и дифференциации. Большинство клеток, полученных из твердых тканей, являются адгезивными. Другим типом адгезивной культуры является органотипическая культура , которая включает выращивание клеток в трехмерной (3-D) среде, в отличие от двумерных культуральных чашек. Эта трехмерная культуральная система биохимически и физиологически более похожа на ткань in vivo , но ее технически сложно поддерживать из-за многих факторов (например, диффузии). [26]
Существуют различные виды сред для культивирования клеток, которые обычно используются в биологических науках, включая следующие:
Перекрестное загрязнение клеточных линий может быть проблемой для ученых, работающих с культивируемыми клетками. [27] Исследования показывают, что в 15–20% случаев клетки, используемые в экспериментах, были неправильно идентифицированы или загрязнены другой клеточной линией. [28] [29] [30] Проблемы с перекрестным загрязнением клеточных линий были обнаружены даже в линиях из панели NCI-60 , которые обычно используются для исследований по скринингу лекарственных препаратов. [31] [32] Основные репозитории клеточных линий, включая Американскую коллекцию типовых культур (ATCC), Европейскую коллекцию клеточных культур (ECACC) и Немецкую коллекцию микроорганизмов и клеточных культур (DSMZ), получили от исследователей заявки на клеточные линии, которые были ими неправильно идентифицированы. [31] [33] Такое загрязнение создает проблему для качества исследований, проводимых с использованием линий клеточных культур, и основные репозитории теперь аутентифицируют все заявки на клеточные линии. [34] ATCC использует ДНК-дактилоскопию с короткими тандемными повторами (STR) для аутентификации своих клеточных линий. [35]
Чтобы решить эту проблему перекрестного загрязнения клеточных линий, исследователям рекомендуется аутентифицировать свои клеточные линии на раннем этапе, чтобы установить идентичность клеточной линии. Аутентификацию следует повторять перед замораживанием запасов клеточных линий, каждые два месяца во время активного культивирования и перед любой публикацией исследовательских данных, полученных с использованием клеточных линий. Для идентификации клеточных линий используются многие методы, включая изоферментный анализ, типирование человеческого лимфоцитарного антигена (HLA), хромосомный анализ, кариотипирование, морфологию и анализ STR . [35]
Одним из значительных перекрестных загрязнений клеточных линий является бессмертная клеточная линия HeLa . Загрязнение HeLa было впервые отмечено в начале 1960-х годов в нечеловеческой культуре в США. Внутривидовое загрязнение было обнаружено в девятнадцати клеточных линиях в семидесятых годах. В 1974 году было обнаружено, что пять линий человеческих клеток из Советского Союза были HeLa. Последующее исследование, анализирующее более 50 клеточных линий, показало, что половина имела маркеры HeLa, но загрязняющий HeLa гибридизовался с исходными клеточными линиями. Сообщалось о загрязнении клеток HeLa из воздушных капель . HeLa даже был неосознанно введен людям Джонасом Солком в ходе испытания вакцины в 1978 году. [36]
Поскольку клетки в целом продолжают делиться в культуре, они обычно растут, чтобы заполнить доступную область или объем. Это может вызвать несколько проблем:
Выбор питательной среды может повлиять на физиологическую значимость результатов экспериментов с клеточными культурами из-за различий в составе и концентрации питательных веществ. [38] Систематическое смещение в сгенерированных наборах данных было недавно показано для скрининга подавления генов CRISPR и RNAi , [39] и для метаболического профилирования линий раковых клеток . [38] Использование питательной среды , которая лучше отражает физиологические уровни питательных веществ, может улучшить физиологическую значимость исследований in vitro , и недавно были разработаны такие типы сред, как Plasmax [40] и среда, подобная человеческой плазме (HPLM), [41] .
Среди распространенных манипуляций, проводимых с культуральными клетками, — смена среды, пассирование клеток и трансфекция клеток. Обычно они выполняются с использованием методов культивирования тканей, которые основаны на асептической технике . Асептическая техника направлена на предотвращение загрязнения бактериями, дрожжами или другими клеточными линиями. Манипуляции обычно проводятся в боксе биологической безопасности или ламинарном боксе, чтобы исключить попадание загрязняющих микроорганизмов. Антибиотики (например, пенициллин и стрептомицин ) и противогрибковые препараты (например, амфотерицин В и раствор антибиотика-антимикотика ) также могут быть добавлены в питательную среду.
Поскольку клетки подвергаются метаболическим процессам, вырабатывается кислота и pH снижается. Часто в среду добавляют индикатор pH для измерения истощения питательных веществ.
В случае адгезивных культур среда может быть удалена непосредственно путем аспирации, а затем заменена. Смена среды в неадгезивных культурах включает центрифугирование культуры и ресуспендирование клеток в свежей среде.
Пассирование (также известное как субкультура или разделение клеток) подразумевает перенос небольшого количества клеток в новый сосуд. Клетки можно культивировать в течение более длительного времени, если их регулярно разделять, так как это позволяет избежать старения, связанного с длительной высокой плотностью клеток. Суспензионные культуры легко пассируются с небольшим количеством культуры, содержащей несколько клеток, разведенных в большем объеме свежей среды. Для адгезивных культур клетки сначала необходимо отсоединить; это обычно делается с помощью смеси трипсина - ЭДТА ; однако в настоящее время для этой цели доступны другие смеси ферментов. Затем небольшое количество отсоединенных клеток можно использовать для засевания новой культуры. Некоторые клеточные культуры, такие как клетки RAW, механически соскабливаются с поверхности их сосуда резиновыми скребками.
Другой распространенный метод манипуляции клетками включает введение чужеродной ДНК путем трансфекции . Это часто выполняется для того, чтобы заставить клетки экспрессировать интересующий ген . Совсем недавно трансфекция конструкций РНК-интерференции была реализована как удобный механизм подавления экспрессии определенного гена/белка. ДНК также может быть введена в клетки с помощью вирусов, методами, называемыми трансдукцией , инфекцией или трансформацией . Вирусы, как паразитические агенты, хорошо подходят для введения ДНК в клетки, поскольку это является частью их нормального хода размножения.
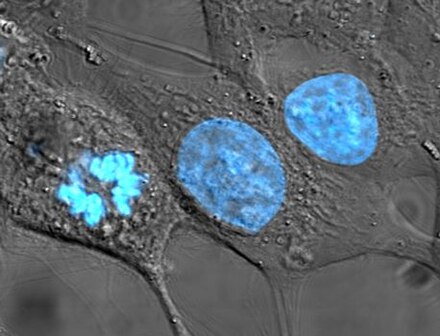
Клеточные линии, которые происходят от людей, были несколько спорными в биоэтике , поскольку они могут пережить свой родительский организм и позже использоваться для открытия прибыльных медицинских методов лечения. В новаторском решении в этой области Верховный суд Калифорнии постановил в деле Мур против Регентов Калифорнийского университета , что пациенты-люди не имеют права собственности на клеточные линии, полученные из органов, удаленных с их согласия. [42]
Можно слить нормальные клетки с бессмертной клеточной линией . Этот метод используется для получения моноклональных антител . Вкратце, лимфоциты, выделенные из селезенки (или, возможно, крови) иммунизированного животного, объединяются с бессмертной клеточной линией миеломы (линия В-клеток) для получения гибридомы , которая имеет специфичность антител первичного лимфоцита и бессмертие миеломы. Селективная питательная среда (HA или HAT) используется для отбора против не слитых миеломных клеток; первичные лимфоциты быстро погибают в культуре, и выживают только слитые клетки. Их проверяют на выработку требуемых антител, как правило, в пулах для начала, а затем после одиночного клонирования.
Клеточный штамм получается либо из первичной культуры, либо из клеточной линии путем отбора или клонирования клеток, имеющих определенные свойства или характеристики, которые должны быть определены. Клеточные штаммы — это клетки, которые были адаптированы к культуре, но, в отличие от клеточных линий, имеют конечный потенциал деления. Неиммортализованные клетки прекращают делиться после 40–60 удвоений популяции [43] , и после этого они теряют способность к пролиферации (генетически обусловленное событие, известное как старение). [44]
Массовая культура линий клеток животных имеет основополагающее значение для производства вирусных вакцин и других продуктов биотехнологии. Культура стволовых клеток человека используется для увеличения числа клеток и дифференциации клеток в различные типы соматических клеток для трансплантации. [45] Культура стволовых клеток также используется для сбора молекул и экзосом, которые стволовые клетки выделяют в целях терапевтической разработки. [46]
Биологические продукты, полученные с помощью технологии рекомбинантной ДНК (рДНК) в культурах клеток животных, включают ферменты , синтетические гормоны , иммунобиологические препараты ( моноклональные антитела , интерлейкины , лимфокины ) и противораковые агенты . Хотя многие более простые белки могут быть получены с использованием рДНК в бактериальных культурах, более сложные белки, которые гликозилированы (модифицированы углеводами), в настоящее время должны быть получены в клетках животных. Важным примером такого сложного белка является гормон эритропоэтин . Стоимость выращивания культур клеток млекопитающих высока, поэтому ведутся исследования по получению таких сложных белков в клетках насекомых или высших растений, использование отдельных эмбриональных клеток и соматических эмбрионов в качестве источника для прямого переноса генов посредством бомбардировки частицами, транзитной экспрессии генов и наблюдения с помощью конфокальной микроскопии является одним из его применений. Он также позволяет подтвердить одноклеточное происхождение соматических эмбрионов и асимметрию первого деления клеток, которое запускает процесс.
Культивирование клеток также является ключевым методом клеточного сельского хозяйства , которое направлено на предоставление как новых продуктов, так и новых способов производства существующих сельскохозяйственных продуктов, таких как молоко, (культивированное) мясо , ароматизаторы и рог носорога из клеток и микроорганизмов. Поэтому оно считается одним из средств достижения сельского хозяйства без животных . Оно также является центральным инструментом для обучения клеточной биологии. [47]
Исследования в области тканевой инженерии , стволовых клеток и молекулярной биологии в первую очередь включают в себя культуры клеток на плоских пластиковых чашках. Эта техника известна как двумерная (2D) клеточная культура и была впервые разработана Вильгельмом Ру , который в 1885 году удалил часть мозговой пластинки эмбриона цыпленка и поддерживал ее в теплом солевом растворе в течение нескольких дней на плоской стеклянной пластине. Благодаря прогрессу полимерной технологии возникла сегодняшняя стандартная пластиковая чашка для 2D клеточной культуры, обычно известная как чашка Петри . Юлиус Рихард Петри , немецкий бактериолог , как правило, приписывают это изобретение, когда он работал помощником Роберта Коха . Различные исследователи сегодня также используют лабораторные колбы для культивирования , конические колбы и даже одноразовые пакеты, подобные тем, которые используются в одноразовых биореакторах .
Помимо чашек Петри, ученые уже давно выращивают клетки в биологически полученных матрицах, таких как коллаген или фибрин, а в последнее время и на синтетических гидрогелях, таких как полиакриламид или ПЭГ. Они делают это для того, чтобы вызвать фенотипы, которые не экспрессируются на традиционно жестких субстратах. Растет интерес к контролю жесткости матрицы [48] , концепция, которая привела к открытиям в таких областях, как:
Клеточная культура в трех измерениях была разрекламирована как «Новое измерение биологии». [63] В настоящее время практика клеточной культуры по-прежнему основана на различных комбинациях одиночных или множественных клеточных структур в 2D. [64] В настоящее время наблюдается рост использования 3D-клеточных культур в таких областях исследований, как открытие лекарств , биология рака, регенеративная медицина , оценка наноматериалов и фундаментальные исследования в области естественных наук . [65] [66] [67] 3D-клеточные культуры можно выращивать с использованием каркаса или матрицы, или без каркаса. Культуры на основе каркаса используют бесклеточную 3D-матрицу или жидкую матрицу. Методы без каркаса обычно генерируются в суспензиях. [68] Существует множество платформ, используемых для облегчения роста трехмерных клеточных структур, включая системы каркасов, такие как гидрогелевые матрицы [69] и твердые каркасы, а также системы без каркасов, такие как пластины с низкой адгезией, магнитная левитация с использованием наночастиц , [70] пластины с висячей каплей, [71] [72] и вращающаяся клеточная культура. Культивирование клеток в 3D приводит к широкому изменению сигнатур экспрессии генов и частично имитирует ткани в физиологических состояниях. [73] Модель 3D-клеточной культуры показала рост клеток, аналогичный росту in vivo, чем монослойная культура, и все три культуры были способны поддерживать рост клеток. [74] Поскольку 3D-культивирование было разработано, оно, как оказалось, имеет большой потенциал для проектирования моделей опухолей и исследования злокачественной трансформации и метастазов, 3D-культуры могут предоставить преувеличенный инструмент для понимания изменений, взаимодействий и клеточной сигнализации. [75]
Эрик Саймон в отчете о гранте NIH SBIR 1988 года показал, что электропрядение может использоваться для производства нано- и субмикронных полистирольных и поликарбонатных волокнистых каркасов, специально предназначенных для использования в качестве клеточных субстратов in vitro . Это раннее использование электропрядильных волокнистых решеток для клеточной культуры и тканевой инженерии показало, что различные типы клеток, включая фибробласты крайней плоти человека (HFF), трансформированную карциному человека (HEp-2) и эпителий легких норки (MLE), будут прилипать к поликарбонатным волокнам и размножаться на них. Было отмечено, что в отличие от уплощенной морфологии, обычно наблюдаемой в 2D-культуре, клетки, выращенные на электропрядильных волокнах, демонстрируют более гистотипическую округлую 3-мерную морфологию, обычно наблюдаемую in vivo . [17]
Поскольку естественный внеклеточный матрикс (ECM) важен для выживания, пролиферации, дифференциации и миграции клеток, различные матрицы гидрогелевых культур, имитирующие естественную структуру ECM, рассматриваются как потенциальные подходы к культивированию клеток in vivo. [76] Гидрогели состоят из взаимосвязанных пор с высокой степенью удержания воды, что обеспечивает эффективную транспортировку веществ, таких как питательные вещества и газы. Для 3D-культуры клеток доступно несколько различных типов гидрогелей из природных и синтетических материалов, включая гидрогели из экстрактов ECM животных, белковые гидрогели, пептидные гидрогели, полимерные гидрогели и гидрогель на основе наноцеллюлозы древесины .
Метод 3D-клеточного культивирования с помощью магнитной левитации (MLM) представляет собой применение выращивания 3D-ткани путем индукции клеток, обработанных магнитными сборками наночастиц, в пространственно-переменных магнитных полях с использованием неодимовых магнитных драйверов и стимулирования взаимодействия клеток путем левитации клеток до поверхности раздела воздух/жидкость стандартной чашки Петри. Сборки магнитных наночастиц состоят из магнитных наночастиц оксида железа, золотых наночастиц и полимера полилизина. 3D-клеточное культивирование масштабируемо, с возможностью культивирования от 500 клеток до миллионов клеток или от одной чашки до высокопроизводительных систем малого объема.
Культура клеток является фундаментальным компонентом культуры тканей и тканевой инженерии , поскольку она устанавливает основы выращивания и поддержания клеток in vitro . Основное применение культуры человеческих клеток — в индустрии стволовых клеток, где мезенхимальные стволовые клетки можно культивировать и криоконсервировать для будущего использования. Тканевая инженерия потенциально предлагает кардинальные улучшения в области недорогой медицинской помощи для сотен тысяч пациентов ежегодно.
Вакцины от полиомиелита , кори , эпидемического паротита , краснухи и ветряной оспы в настоящее время производятся в клеточных культурах. Из-за угрозы пандемии H5N1 исследования по использованию клеточной культуры для вакцин от гриппа финансируются правительством США . Новые идеи в этой области включают вакцины на основе рекомбинантной ДНК , например, вакцину, созданную с использованием человеческого аденовируса (вируса простуды) в качестве вектора, [77] [78] и новые адъюванты. [79]
Методика совместного культивирования используется для изучения перекрестных контактов между двумя или более типами клеток на пластине или в трехмерной матрице. Выращивание различных стволовых клеток и взаимодействие иммунных клеток можно исследовать в модели in vitro, аналогичной биологической ткани. Поскольку большинство тканей содержат более одного типа клеток, важно оценить их взаимодействие в трехмерной культуральной среде, чтобы лучше понять их взаимодействие и ввести миметические ткани. Существует два типа совместного культивирования: прямое и непрямое. В то время как прямое взаимодействие подразумевает, что клетки находятся в прямом контакте друг с другом в одной и той же культуральной среде или матрице, непрямое взаимодействие подразумевает разные среды, что позволяет сигнальным и растворимым факторам участвовать. [15] [80]
Дифференциация клеток в моделях тканей во время взаимодействия между клетками может изучаться с помощью системы совместного культивирования для моделирования раковых опухолей, оценки влияния лекарств на терапевтические испытания и изучения влияния лекарств на терапевтические испытания. Система совместного культивирования в 3D-моделях может предсказать реакцию на химиотерапию и эндокринную терапию, если микросреда определяет биологическую ткань для клеток.
Метод совместного культивирования используется в тканевой инженерии для создания тканей с несколькими клетками, взаимодействующими напрямую. [81]

Микрофлюидная техника — это разработанные системы, которые могут выполнять процесс в потоке, который обычно находится в масштабе микрона. Микрофлюидные чипы также известны как Lab-on-a-chip, и они способны иметь непрерывные процедуры и этапы реакции с запасным количеством реагентов и пространства. Такие системы позволяют идентифицировать и изолировать отдельные клетки и молекулы при сочетании с соответствующими биологическими анализами и высокочувствительными методами обнаружения. [82] [83]
Системы OoC имитируют и контролируют микросреду клеток, выращивая ткани в микрофлюидике. Объединяя тканевую инженерию, изготовление биоматериалов и клеточную биологию, она дает возможность создания биомиметической модели для изучения заболеваний человека в лабораторных условиях. В последние годы наука о 3D-культуре клеток достигла значительного прогресса, что привело к разработке OoC. OoC рассматривается как доклинический шаг, который приносит пользу фармацевтическим исследованиям, разработке лекарств и моделированию заболеваний. [84] [85] OoC является важной технологией, которая может преодолеть разрыв между испытаниями на животных и клиническими исследованиями, а также благодаря достижениям, достигнутым наукой, может заменить исследования in vivo для доставки лекарств и патофизиологические исследования. [86]
Помимо культивирования хорошо известных бессмертных клеточных линий, клетки из первичных эксплантатов множества организмов можно культивировать в течение ограниченного периода времени до наступления старения (см. предел Хейфлика). Культивируемые первичные клетки широко использовались в исследованиях, как в случае с кератоцитами рыб в исследованиях миграции клеток. [87] [47] [88]
Культуры растительных клеток обычно выращиваются как культуры суспензии клеток в жидкой среде или как культуры каллуса на твердой среде. Культивирование недифференцированных растительных клеток и каллюсов требует надлежащего баланса гормонов роста растений ауксина и цитокинина . [ необходима цитата ]
Клетки, полученные от Drosophila melanogaster (в первую очередь, клетки Schneider 2 ), можно использовать для экспериментов, которые трудно проводить на живых мухах или личинках, например, для биохимических исследований или исследований с использованием siRNA . Клеточные линии, полученные от гусеницы Spodoptera frugiperda , включая Sf9 и Sf21 , и от капустной пяденицы Trichoplusia ni , клетки High Five , обычно используются для экспрессии рекомбинантных белков с использованием бакуловируса . [89]
Для бактерий и дрожжей небольшие количества клеток обычно выращивают на твердой подложке, содержащей внедренные в нее питательные вещества, обычно это гель, такой как агар, в то время как крупномасштабные культуры выращивают с использованием клеток, суспендированных в питательном бульоне. [ необходима ссылка ]
Культура вирусов требует культуры клеток млекопитающих, растений, грибков или бактерий в качестве хозяев для роста и репликации вируса. Целые вирусы дикого типа , рекомбинантные вирусы или вирусные продукты могут быть получены в типах клеток, отличных от их естественных хозяев, при правильных условиях. В зависимости от вида вируса, инфекция и вирусная репликация могут привести к лизису клетки-хозяина и образованию вирусной бляшки . [ необходима цитата ]