
В координационной химии лиганд [a] представляет собой ион или молекулу с функциональной группой , которая связывается с центральным атомом металла, образуя координационный комплекс . Связывание с металлом обычно включает формальную передачу одной или нескольких электронных пар лиганда , часто через основания Льюиса . [1] Природа связи металл-лиганд может варьироваться от ковалентной до ионной . Кроме того, порядок связи металл-лиганд может варьироваться от одного до трех. Лиганды рассматриваются как основания Льюиса, хотя известны редкие случаи, когда в них участвуют кислотные «лиганды» Льюиса . [2] [3]
Металлы и металлоиды связаны с лигандами почти во всех случаях, хотя газообразные «голые» ионы металлов могут быть получены в высоком вакууме. Лиганды в комплексе определяют реакционную способность центрального атома, включая скорости замещения лигандов, реакционную способность самих лигандов и окислительно-восстановительный потенциал . Выбор лиганда требует критического рассмотрения во многих практических областях, включая бионеорганическую и медицинскую химию , гомогенный катализ и химию окружающей среды .
Лиганды классифицируются по многим признакам, включая: заряд, размер (объем), идентичность координирующего атома(ов) и количество электронов, отданных металлу ( дентатность или тактильность ). Размер лиганда указывается углом его конуса .
Состав координационных комплексов был известен с начала 1800-х годов, например, берлинская лазурь и медный купорос . Ключевой прорыв произошел, когда Альфред Вернер примирил формулы и изомеры . Он показал, среди прочего, что формулы многих соединений кобальта(III) и хрома(III) можно понять, если металл имеет шесть лигандов в октаэдрической геометрии . Первыми, кто использовал термин «лиганд», были Альфред Вернер и Карл Сомиески в отношении химии кремния. Теория позволяет понять разницу между координированным и ионным хлоридом в хлоридах аммиака кобальта и объяснить многие ранее необъяснимые изомеры. Он разделил первый координационный комплекс, называемый гексолом, на оптические изомеры, опрокинув теорию о том, что хиральность обязательно связана с углеродными соединениями. [4] [5]
В общем, лиганды рассматриваются как доноры электронов, а металлы как акцепторы электронов, т.е., соответственно, основания Льюиса и кислоты Льюиса . Это описание было полуколичественно определено многими способами, например, моделью ECW . Связывание часто описывается с использованием формализмов теории молекулярных орбиталей. [6] [7]
Лиганды и ионы металлов можно упорядочить многими способами; одна система ранжирования фокусируется на «жёсткости» лиганда (см. также теорию жёсткой/мягкой кислоты/основания ). Ионы металлов предпочтительно связывают определённые лиганды. В общем, «жёсткие» ионы металлов предпочитают лиганды слабого поля, тогда как «мягкие» ионы металлов предпочитают лиганды сильного поля. Согласно теории молекулярных орбиталей, HOMO (высшая занятая молекулярная орбиталь) лиганда должна иметь энергию, которая перекрывается с LUMO (низшая незанятая молекулярная орбиталь) металла, предпочтительного. Ионы металлов, связанные с лигандами сильного поля, следуют принципу Ауфбау , тогда как комплексы, связанные с лигандами слабого поля, следуют правилу Хунда .
Связывание металла с лигандами приводит к набору молекулярных орбиталей, где металл может быть идентифицирован с новыми HOMO и LUMO (орбиталями, определяющими свойства и реакционную способность полученного комплекса) и определенным порядком 5 d-орбиталей (которые могут быть заполнены или частично заполнены электронами). В октаэдрической среде 5 в противном случае вырожденных d-орбиталей расщепляются на наборы из 3 и 2 орбиталей (для более подробного объяснения см. теорию кристаллического поля ):
Разница энергий между этими 2 наборами d-орбиталей называется параметром расщепления, Δ o . Величина Δ o определяется силой поля лиганда: лиганды сильного поля, по определению, увеличивают Δ o больше, чем лиганды слабого поля. Теперь лиганды можно отсортировать по величине Δ o (см. таблицу ниже). Такое упорядочение лигандов практически неизменно для всех ионов металлов и называется спектрохимическим рядом .
Для комплексов с тетраэдрическим окружением d-орбитали снова разделяются на два набора, но на этот раз в обратном порядке:
Разница в энергии между этими 2 наборами d-орбиталей теперь называется Δ t . Величина Δ t меньше, чем для Δ o , потому что в тетраэдрическом комплексе только 4 лиганда влияют на d-орбитали, тогда как в октаэдрическом комплексе на d-орбитали влияют 6 лигандов. Когда координационное число не является ни октаэдрическим, ни тетраэдрическим, расщепление становится соответственно более сложным. Однако для целей ранжирования лигандов основной интерес представляют свойства октаэдрических комплексов и результирующее Δ o .
Расположение d-орбиталей на центральном атоме (определяемое «силой» лиганда) оказывает сильное влияние практически на все свойства полученных комплексов. Например, различия в энергии d-орбиталей оказывают сильное влияние на оптические спектры поглощения комплексов металлов. Оказывается, что валентные электроны, занимающие орбитали со значительным 3 d-орбитальным характером, поглощают в области спектра 400–800 нм ( УФ–видимый диапазон). Поглощение света (то, что мы воспринимаем как цвет ) этими электронами (то есть возбуждение электронов с одной орбитали на другую орбиталь под воздействием света) можно соотнести с основным состоянием комплекса металла, которое отражает связывающие свойства лигандов. Относительное изменение (относительной) энергии d-орбиталей как функции напряженности поля лигандов описывается на диаграммах Танабе–Сугано .
В случаях, когда лиганд имеет низкоэнергетическую LUMO, такие орбитали также участвуют в связывании. Связь металл-лиганд может быть дополнительно стабилизирована формальным донорством электронной плотности обратно лиганду в процессе, известном как обратное связывание . В этом случае заполненная орбиталь на основе центрального атома отдает плотность в LUMO (координированного) лиганда. Окись углерода является выдающимся примером лиганда, который взаимодействует с металлами посредством обратного донорства. Дополнительно, лиганды с низкоэнергетическими заполненными орбиталями пи-симметрии могут служить пи-донором.

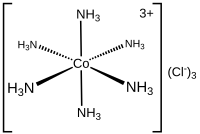
Лиганды классифицируются в соответствии с числом электронов, которые они «отдают» металлу. Лиганды L являются основаниями Льюиса . Лиганды L представлены аминами , фосфинами , CO , N2 и алкенами . Примеры лигандов L включают дигидроген и углеводороды, которые взаимодействуют посредством агостических взаимодействий . Лиганды X являются галогенидами и псевдогалогенидами . Лиганды X обычно получают из анионных предшественников, таких как хлорид, но включают лиганды, в которых соли аниона на самом деле не существуют, такие как гидрид и алкил. [8] [9]
Особенно в области металлоорганической химии лиганды классифицируются в соответствии с «методом CBC» для классификации ковалентных связей, популяризированным MLH Green , и «основанным на представлении о том, что существует три основных типа [лигандов]... представленных символами L, X и Z, которые соответствуют нейтральным лигандам с 2, 1 и 0 электронами соответственно». [10] [11]
Многие лиганды способны связывать ионы металлов через несколько сайтов, обычно потому, что лиганды имеют неподеленные пары на более чем одном атоме. Такие лиганды являются полидентатными. [12] Лиганды, которые связываются через более чем один атом, часто называют хелатирующими . Лиганд, который связывается через два сайта, классифицируется как бидентатный , а через три сайта как тридентатный . « Угол укуса » относится к углу между двумя связями бидентатного хелата. Хелатирующие лиганды обычно образуются путем связывания донорных групп через органические линкеры. Классический бидентатный лиганд — этилендиамин , который получается путем связывания двух аммиачных групп с линкером этилена (−CH 2 CH 2 −). Классическим примером полидентатного лиганда является гексадентатный хелатирующий агент EDTA , который способен связываться через шесть сайтов, полностью окружая некоторые металлы. Число раз, когда полидентатный лиганд связывается с металлическим центром, обозначается как " κ n ", где n указывает число участков, с помощью которых лиганд присоединяется к металлу. EDTA 4− , когда он является гексидентатным, связывается как κ 6 -лиганд, амины и атомы кислорода карбоксилата не являются смежными. На практике значение n лиганда не указывается явно, а скорее предполагается. Сродство связывания хелатирующей системы зависит от угла хелатирования или угла укуса .
Дентативность (обозначается как κ ) — это номенклатура, описывающая число несмежных атомов лиганда, связанных с металлом. Этот дескриптор часто опускается, поскольку дентатность лиганда часто очевидна. Комплекс трис(этилендиамин)кобальт(III) можно описать как [Co(κ 2 -en) 3 ] 3+ .
Комплексы полидентатных лигандов называются хелатными комплексами. Они, как правило, более стабильны, чем комплексы, полученные из монодентатных лигандов. Эта повышенная стабильность, называемая хелатным эффектом , обычно объясняется эффектами энтропии , которая способствует замещению многих лигандов одним полидентатным лигандом.
С хелатным эффектом связан макроциклический эффект . Макроциклический лиганд — это любой большой лиганд, который хотя бы частично окружает центральный атом и связывается с ним, оставляя центральный атом в центре большого кольца. Чем жестче и выше его дентатность, тем более инертным будет макроциклический комплекс. Гем — это пример, в котором атом железа находится в центре порфиринового макроцикла, связанного с четырьмя атомами азота тетрапиррольного макроцикла. Очень стабильный диметилглиоксиматный комплекс никеля — это синтетический макроцикл, полученный из диметилглиоксима .
Гаптичность (обозначенная греческой буквой η ) относится к числу смежных атомов, которые составляют донорный участок и присоединяются к металлическому центру. η-обозначение применяется, когда координируются несколько атомов. Например, η 2 является лигандом, который координируется через два смежных атома. Бутадиен образует как комплексы η 2 , так и η 4 в зависимости от числа атомов углерода, которые связаны с металлом. [13] [14] [15]
Транс-охватывающие лиганды – это бидентатные лиганды, которые могут охватывать координационные позиции на противоположных сторонах координационного комплекса. [16]
В отличие от полидентатных лигандов, амбидентатные лиганды могут присоединяться к центральному атому в одном из двух (или более) мест, но не в обоих. Примером является тиоцианат , SCN − , который может присоединяться как к атому серы, так и к атому азота. Такие соединения приводят к изомерии связей .
Полидентатные и амбидентатные лиганды, следовательно, являются двумя различными типами полифункциональных лигандов (лигандов с более чем одной функциональной группой ), которые могут связываться с металлическим центром через различные атомы лиганда, образуя различные изомеры. Полидентатные лиганды могут связываться через один атом И другой (или несколько других) одновременно, тогда как амбидентатные лиганды связываются через один атом ИЛИ другой. Белки являются сложными примерами полифункциональных лигандов, обычно полидентатных.
Мостиковый лиганд связывает два или более металлических центров. Практически все неорганические твердые вещества с простыми формулами являются координационными полимерами , состоящими из металлических ионных центров, связанных мостиковыми лигандами. Эта группа материалов включает все безводные бинарные галогениды и псевдогалогениды металлических ионов. Мостиковые лиганды также сохраняются в растворе. Многоатомные лиганды, такие как карбонат, являются амбидентатными и, таким образом, часто связываются с двумя или тремя металлами одновременно. Атомы, которые связывают металлы, иногда обозначаются префиксом « μ ». Большинство неорганических твердых веществ являются полимерами в силу наличия нескольких мостиковых лигандов. Мостиковые лиганды, способные координировать несколько ионов металлов, привлекают значительный интерес из-за их потенциального использования в качестве строительных блоков для изготовления функциональных мультиметаллических сборок. [17]
Бинуклеирующие лиганды связывают два иона металла. [18] Обычно бинуклеирующие лиганды содержат мостиковые лиганды, такие как феноксид, пиразолат или пиразин, а также другие донорные группы, которые связываются только с одним из двух ионов металла.
Некоторые лиганды могут связываться с металлическим центром через тот же атом, но с разным числом неподеленных пар . Порядок связи металлического лиганда можно частично различить через угол связи металлического лиганда (M−X−R). Этот угол связи часто называют линейным или изогнутым с дальнейшим обсуждением относительно степени изгиба угла. Например, имидолиганд в ионной форме имеет три неподеленные пары. Одна неподеленная пара используется как донор сигма X, другие две неподеленные пары доступны как доноры пи L-типа. Если обе неподеленные пары используются в пи-связях, то геометрия M−N−R является линейной. Однако, если одна или обе эти неподеленные пары являются несвязывающими, то связь M−N−R изогнута, и степень изгиба говорит о том, сколько может быть пи-связей. η 1 -Оксид азота может координироваться с металлическим центром линейным или изогнутым образом.
Лиганд-спектатор — это плотно координирующий полидентатный лиганд, который не участвует в химических реакциях, но удаляет активные центры на металле. Лиганды-спектаторы влияют на реакционную способность металлического центра, с которым они связаны.
Объемные лиганды используются для управления стерическими свойствами металлического центра. Они используются по многим причинам, как практическим, так и академическим. С практической стороны, они влияют на селективность металлических катализаторов, например, при гидроформилировании . Академический интерес представляют объемные лиганды, стабилизирующие необычные координационные центры, например, реакционноспособные колиганды или низкие координационные числа. Часто объемные лиганды используются для имитации стерической защиты, предоставляемой белками металлсодержащим активным центрам. Конечно, чрезмерный стерический объем может помешать координации определенных лигандов.
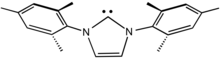
Хиральные лиганды полезны для создания асимметрии в координационной сфере. Часто лиганд используется как оптически чистая группа. В некоторых случаях, например, вторичных аминов, асимметрия возникает при координации. Хиральные лиганды используются в гомогенном катализе , например, асимметричном гидрировании .
Гемилабильные лиганды содержат по крайней мере две электронно-различимые координирующие группы и образуют комплексы, в которых одна из них легко вытесняется из металлического центра, а другая остается прочно связанной. Было обнаружено, что такое поведение повышает реакционную способность катализаторов по сравнению с использованием более традиционных лигандов.
Неинноцентные лиганды связываются с металлами таким образом, что распределение электронной плотности между металлическим центром и лигандом неясно. Описание связывания неинноцентных лигандов часто включает в себя написание множественных резонансных форм , которые имеют частичные вклады в общее состояние.
Практически каждая молекула и каждый ион могут служить лигандом для (или «координироваться с») металлов. Монодентатные лиганды включают практически все анионы и все простые основания Льюиса. Таким образом, галогениды и псевдогалогениды являются важными анионными лигандами, тогда как аммиак , оксид углерода и вода являются особенно распространенными лигандами с нейтральным зарядом. Простые органические виды также очень распространены, будь то анионные ( RO − и RCO−
2) или нейтральные ( R 2 O , R 2 S , R 3− x NH x и R 3 P ). Стерические свойства некоторых лигандов оцениваются в терминах их углов конуса .
Помимо классических оснований Льюиса и анионов, все ненасыщенные молекулы также являются лигандами, использующими свои пи-электроны для формирования координационной связи. Кроме того, металлы могут связываться с σ-связями, например, в силанах , углеводородах и дигидрогене (см. также: Агостическое взаимодействие ).
В комплексах неинноцентных лигандов лиганд связан с металлами посредством обычных связей, но лиганд также является окислительно-восстановительно-активным.
В следующей таблице лиганды отсортированы по напряженности поля [ требуется ссылка ] (сначала лиганды со слабым полем):
Записи в таблице отсортированы по силе поля, связываясь через указанный атом (т.е. как терминальный лиганд). «Сила» лиганда изменяется, когда лиганд связывается в альтернативном режиме связывания (например, когда он образует мостик между металлами) или когда конформация лиганда искажается (например, линейный лиганд, который вынужден через стерические взаимодействия связываться нелинейным образом).
В этой таблице в алфавитном порядке перечислены другие распространённые лиганды.
Обмен лигандами (также называемый заменой лигандов ) — это химическая реакция , в которой лиганд в соединении заменяется другим. Признаются два общих механизма: ассоциативная замена или диссоциативная замена .

Ассоциативное замещение очень похоже на механизм S N 2 в органической химии. Обычно меньший лиганд может присоединяться к ненасыщенному комплексу с последующей потерей другого лиганда. Обычно скорость замещения является первой порядком при вхождении лиганда L и ненасыщенного комплекса. [19]

Диссоциативное замещение является обычным для октаэдрических комплексов. Этот путь очень похож на механизм S N 1 в органической химии. Идентичность входящего лиганда не влияет на скорость. [19]
BioLiP [20] — это комплексная база данных лиганд-белковых взаимодействий с трехмерной структурой лиганд-белковых взаимодействий, взятой из Protein Data Bank . MANORAA — это веб-сервер для анализа консервативного и дифференциального молекулярного взаимодействия лиганда в комплексе с гомологами белковой структуры из Protein Data Bank. Он обеспечивает связь с белковыми мишенями, такими как его местоположение в биохимических путях, однонуклеотидные полиморфизмы (SNP) и базовая экспрессия белка/РНК в органе-мишени. [21]