В органической химии гиперконъюгация ( σ -конъюгация или резонанс без связи ) относится к делокализации электронов с участием связей преимущественно σ -характера . Обычно гиперконъюгация включает взаимодействие электронов на сигма-орбитали (σ) (например, C–H или C–C) с соседней незаселенной несвязывающей p- или антисвязывающей σ*- или π*-орбиталью , чтобы дать пару расширенных молекулярных орбиталей . Однако иногда низколежащие антисвязывающие σ*-орбитали могут также взаимодействовать с заполненными орбиталями характера неподеленной пары (n) в том, что называется отрицательной гиперконъюгацией . [1] Повышенная делокализация электронов, связанная с гиперконъюгацией, увеличивает стабильность системы. [2] [3] В частности, стабилизируется новая орбиталь со связывающим характером, что приводит к общей стабилизации молекулы. [4] Только электроны в связях, которые находятся в β-положении, могут иметь такой прямой стабилизирующий эффект — отдавая от сигма-связи атома орбиталь в другом атоме, непосредственно присоединенном к нему. Однако расширенные версии гиперконъюгации (такие как двойная гиперконъюгация [5] ) также могут быть важны. Эффект Бейкера-Натана , иногда используемый как синоним гиперконъюгации, [6] является его конкретным применением к определенным химическим реакциям или типам структур. [7]
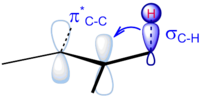
Гиперконъюгация может быть использована для рационализации различных химических явлений, включая аномерный эффект , гош-эффект , вращательный барьер этана , эффект бета-кремния , частоту колебаний экзоциклических карбонильных групп и относительную стабильность замещенных карбокатионов и замещенных углерод-центрированных радикалов , а также термодинамическое правило Зайцева для стабильности алкенов. Более спорно, гиперконъюгация предлагается квантово-механическим моделированием как лучшее объяснение предпочтения ступенчатой конформации , а не старого учебника по понятию стерических препятствий . [8] [9]
Гиперконъюгация влияет на несколько свойств. [6] [10]
Гиперконъюгация была предложена как причина повышенной стабильности двойных связей углерод-углерод по мере увеличения степени замещения. Ранние исследования гиперконъюгации были выполнены в исследовательской группе Джорджа Кистяковского . Их работа, впервые опубликованная в 1937 году, была задумана как предварительный отчет о ходе термохимических исследований изменений энергии во время реакций присоединения различных ненасыщенных и циклических соединений. Важность гиперконъюгации в учете этого эффекта получила поддержку квантово-химических расчетов. [12] Считается, что ключевым взаимодействием является передача электронной плотности от соседней σ-связи C–H на π*-антисвязывающую орбиталь алкена (σ C–H → π*). Эффект почти на порядок слабее, чем в случае алкильного замещения на карбокатионах (σ C –H → p C ), поскольку незаполненная p-орбиталь имеет более низкую энергию и, следовательно, лучше энергетически согласована с σ-связью. Когда этот эффект проявляется в образовании более замещенного продукта в термодинамически контролируемых реакциях E1, он известен как правило Зайцева , хотя во многих случаях кинетический продукт также следует этому правилу. ( См. правило Хофмана для случаев, когда кинетический продукт является менее замещенным. )
Один из наборов экспериментов Кистяковского включал в себя собранные данные о теплоте гидрирования во время газофазных реакций ряда соединений, содержащих одну алкеновую единицу. При сравнении ряда моноалкилзамещенных алкенов они обнаружили, что любая алкильная группа заметно увеличивала стабильность, но что выбор различных конкретных алкильных групп не имел практически никакого эффекта. [13]
Часть работы Кистяковского включала сравнение других ненасыщенных соединений в форме CH 2 =CH(CH 2 )n-CH=CH 2 (n = 0,1,2). Эти эксперименты выявили важный результат: когда n = 0, существует эффект конъюгации с молекулой, где значение ΔH снижается на 3,5 ккал . Это сравнимо с добавлением двух алкильных групп в этилен. Кистяковский также исследовал системы с открытой цепью, где было обнаружено наибольшее значение выделяемого тепла во время добавления к молекуле в 1,4-положении. Циклические молекулы оказались наиболее проблематичными, поскольку было обнаружено, что необходимо учитывать напряжение молекулы. Напряжение пятичленных колец увеличивалось с уменьшением степени ненасыщенности. Это был удивительный результат, который был дополнительно исследован в более поздней работе с циклическими ангидридами кислот и лактонами . Также изучались циклические молекулы, такие как бензол и его производные, поскольку их поведение отличалось от поведения других ненасыщенных соединений. [13]
Несмотря на тщательность работы Кистяковского, она не была полной и требовала дополнительных доказательств для подкрепления его выводов. Его работа стала решающим первым шагом к началу идей гиперконъюгации и эффектов конъюгации.
Конъюгация 1,3- бутадиена была впервые оценена Кистяковским, конъюгативный вклад в 3,5 ккал/моль был найден на основе энергетического сравнения гидрирования между конъюгированными видами и неконъюгированными аналогами. [13] Роджерс , который использовал метод, впервые примененный Кистяковским, сообщил, что конъюгационная стабилизация 1,3-бутадиина была равна нулю, поскольку разница Δ hyd H между первым и вторым гидрированием была равна нулю. Теплоты гидрирования (Δ hyd H) были получены с помощью вычислительного метода квантовой химии G3(MP2). [14]
Другая группа под руководством Хоука [15] предположила, что методы, используемые Роджерсом и Кистяковским, не подходят, поскольку сравнение теплот гидрирования оценивает не только эффекты сопряжения, но и другие структурные и электронные различия. Они получили -70,6 ккал/моль и -70,4 ккал/моль для первого и второго гидрирования соответственно с помощью расчета ab initio , что подтвердило данные Роджерса. Однако они интерпретировали данные по-другому, приняв во внимание стабилизацию гиперконъюгации. Для количественной оценки эффекта гиперконъюгации они разработали следующие изодесмические реакции в 1-бутине и 1-бутене .
Удаление гиперконъюгативных взаимодействий дает виртуальные состояния, которые имеют энергии, которые на 4,9 и 2,4 ккал/моль выше, чем у 1-бутина и 1-бутена , соответственно. Использование этих виртуальных состояний приводит к конъюгативной стабилизации 9,6 ккал/моль для 1,3-бутадиина и 8,5 ккал/моль для 1,3-бутадиена.
Относительно недавняя работа (2006) Фернандеса и Френкинга (2006) суммировала тенденции в гиперконъюгации среди различных групп ациклических молекул, используя анализ разложения энергии или EDA. Фернандес и Френкинг определяют этот тип анализа как «...метод, который использует только pi-орбитали взаимодействующих фрагментов в геометрии молекулы для оценки pi-взаимодействий. [16] «Для этого типа анализа образование связей между различными молекулярными фрагментами является комбинацией трехкомпонентных членов. ΔE elstat представляет то, что Фернандес и Френкинг называют «квазиклассическим электростатическим притяжением» молекулы. [16] «Второй член, ΔE Pauli , представляет отталкивание Паули молекулы. ΔE orb , третий член, представляет стабилизирующие взаимодействия между орбиталями и определяется как сумма ΔE pi и ΔE sigma . Полная энергия взаимодействия, ΔE int , является результатом суммы трех членов. [16]
Группа, значения ΔE pi которой были очень тщательно проанализированы, представляла собой группу енонов , различающихся заместителями.

Фернандес и Френкинг сообщили, что заместители метил , гидроксил и амино привели к уменьшению ΔE pi от исходного 2-пропеналя . Наоборот, галогенидные заместители с увеличивающейся атомной массой привели к увеличению ΔE pi . Поскольку и исследование енонов, и анализ Хаммета изучают эффекты заместителей (хотя и в разных видах), Фернандес и Френкинг посчитали, что сравнение этих двух исследований для изучения возможных тенденций может дать существенное представление об их собственных результатах. Они наблюдали линейную зависимость между значениями ΔE pi для замещенных енонов и соответствующими константами Хаммета. Наклон графика оказался равным -51,67 с коэффициентом корреляции -0,97 и стандартным отклонением 0,54. [16] Фернандес и Френкинг делают вывод из этих данных, что ..."электронные эффекты заместителей R на пи-сопряжении в гомо- и гетеросопряженных системах схожи и, таким образом, кажутся довольно независимыми от природы сопряженной системы". [16] [17]
Примером того, как гиперконъюгация может быть упущена из виду как возможное химическое объяснение, является рационализация вращательного барьера этана (C 2 H 6 ). Еще в 1930-х годах было принято считать, что заторможенные конформации этана более стабильны, чем заслоненная конформация . Уилсон доказал, что энергетический барьер между любой парой заслоненных и заторможенных конформаций составляет приблизительно 3 ккал/моль, и общепринятым обоснованием этого были неблагоприятные стерические взаимодействия между атомами водорода.

Однако в своей статье 2001 года Пофристик и Гудман [8] показали, что это объяснение может быть слишком упрощенным. [18] Гудман сосредоточился на трех основных физических факторах: гиперконъюгативные взаимодействия, обменное отталкивание, определяемое принципом исключения Паули , и электростатические взаимодействия ( кулоновские взаимодействия ). Сравнивая традиционную молекулу этана и гипотетическую молекулу этана со всеми удаленными обменными отталкиваниями, были подготовлены потенциальные кривые путем построения графика угла кручения в зависимости от энергии для каждой молекулы. Анализ кривых определил, что ступенчатая конформация не имела никакой связи с количеством электростатических отталкиваний внутри молекулы. Эти результаты показывают, что кулоновские силы не объясняют предпочтительные ступенчатые конформации, несмотря на тот факт, что растяжение центральной связи уменьшает электростатические взаимодействия. [8]
Гудман также провел исследования, чтобы определить вклад вицинальных (между двумя метильными группами) и геминальных (между атомами в одной метильной группе) взаимодействий в гиперконъюгацию. В отдельных экспериментах геминальные и вицинальные взаимодействия были удалены, и был выведен наиболее стабильный конформер для каждого взаимодействия. [8]
Из этих экспериментов можно сделать вывод, что гиперконъюгативные эффекты делокализации заряда и стабилизации молекулы. Кроме того, именно вицинальные гиперконъюгативные эффекты удерживают молекулу в ступенчатых конформациях. [8] Благодаря этой работе, следующая модель стабилизации ступенчатых конформаций этана теперь более принята:

Гиперконъюгация может также объяснить несколько других явлений, объяснения которых также могут быть не столь интуитивными, как для вращательного барьера этана. [18]
Вопрос вращательного барьера этана не решен в научном сообществе. Анализ в рамках количественной теории молекулярных орбиталей показывает, что 2-орбитальные-4-электронные (стерические) отталкивания доминируют над гиперконъюгацией. [19] Исследование теории валентных связей также подчеркивает важность стерических эффектов. [20]