
Ион ( / ˈ aɪ . ɒ n , - ən / ) [1] — это атом или молекула с суммарным электрическим зарядом . Заряд электрона по соглашению считается отрицательным, и этот заряд равен и противоположен заряду протона , который по соглашению считается положительным. Суммарный заряд иона не равен нулю, поскольку его общее число электронов не равно его общему числу протонов.
Катион — это положительно заряженный ион с меньшим количеством электронов, чем протонов [2] (например, K + ( ион калия)), тогда как анион — это отрицательно заряженный ион с большим количеством электронов, чем протонов. [3] (например, Cl - (хлорид-ион) и OH - (гидроксид-ион)). Противоположные электрические заряды притягиваются друг к другу электростатической силой , поэтому катионы и анионы притягиваются друг к другу и легко образуют ионные соединения .
Если присутствует только + или -, это указывает на заряд +1 или -1 (2+ указывает на заряд +2, 2- указывает на заряд -2). [4]
Заряды +2 и -2 выглядят так: Li 2- (отрицательный заряд) He 2+ (положительный заряд).
Ионы, состоящие только из одного атома, называются атомарными или одноатомными ионами , в то время как два или более атомов образуют молекулярные ионы или многоатомные ионы . В случае физической ионизации в жидкости (газе или жидкости) «ионные пары» создаются спонтанными столкновениями молекул, где каждая образованная пара состоит из свободного электрона и положительного иона. [ 5] Ионы также создаются химическими взаимодействиями, такими как растворение соли в жидкостях, или другими способами, такими как пропускание постоянного тока через проводящий раствор, растворение анода посредством ионизации .
Слово ion произошло от среднего рода настоящего причастия греческого ἰέναι ( ienai ), что означает «идти». Катион — это то, что движется вниз ( греч . κάτω , kato , что означает «вниз»), а анион — это то, что движется вверх ( греч . ἄνω , ano , что означает «вверх»). Они так называются, потому что ионы движутся к электроду с противоположным зарядом. Этот термин был введен (по предложению английского полимата Уильяма Уэвелла ) [6] английским физиком и химиком Майклом Фарадеем в 1834 году для неизвестных тогда видов, которые переходят от одного электрода к другому через водную среду. [7] [8] Фарадей не знал природу этих видов, но он знал, что поскольку металлы растворяются и входят в раствор на одном электроде, а новый металл выходит из раствора на другом электроде, то некое вещество перемещается через раствор в токе. Это переносит вещество из одного места в другое. В переписке с Фарадеем Уэвелл также придумал слова анод и катод , а также анион и катион как ионы, которые притягиваются к соответствующим электродам. [6]
Сванте Аррениус в своей диссертации 1884 года предложил объяснение того факта, что твердые кристаллические соли при растворении распадаются на парные заряженные частицы, за что он получил Нобелевскую премию по химии 1903 года. [9] Объяснение Аррениуса состояло в том, что при образовании раствора соль распадается на ионы Фарадея, он предположил, что ионы образуются даже при отсутствии электрического тока. [10] [11] [12]
Ионы в газообразном состоянии очень реактивны и быстро взаимодействуют с ионами противоположного заряда, образуя нейтральные молекулы или ионные соли. Ионы также производятся в жидком или твердом состоянии, когда соли взаимодействуют с растворителями (например, водой) для получения сольватированных ионов , которые более стабильны по причинам, связанным с комбинацией изменений энергии и энтропии , когда ионы удаляются друг от друга для взаимодействия с жидкостью. Эти стабилизированные виды чаще встречаются в окружающей среде при низких температурах. Типичным примером являются ионы, присутствующие в морской воде, которые образуются из растворенных солей.
Как заряженные объекты, ионы притягиваются к противоположным электрическим зарядам (положительный к отрицательному и наоборот) и отталкиваются одноименными зарядами. Когда они движутся, их траектории могут отклоняться магнитным полем .
Электроны, из-за их меньшей массы и, следовательно, больших свойств заполнения пространства как материальных волн , определяют размер атомов и молекул, которые вообще обладают электронами. Таким образом, анионы (отрицательно заряженные ионы) больше, чем родительская молекула или атом, так как избыточные электроны отталкиваются друг от друга и добавляются к физическому размеру иона, потому что его размер определяется его электронным облаком . Катионы меньше, чем соответствующий родительский атом или молекула из-за меньшего размера электронного облака. Один конкретный катион (катион водорода) не содержит электронов и, таким образом, состоит из одного протона – намного меньше, чем родительский атом водорода.
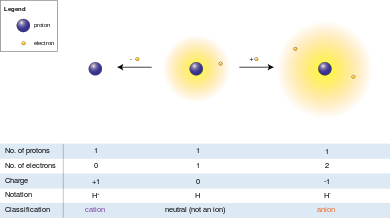
Анион (−) и катион (+) указывают на чистый электрический заряд иона. Ион, у которого больше электронов, чем протонов, что дает ему чистый отрицательный заряд, называется анионом, а обозначение «минус» «анион (−)» указывает на отрицательный заряд. С катионом все наоборот: у него меньше электронов, чем протонов, что дает ему чистый положительный заряд, отсюда и обозначение «катион (+)».
Поскольку электрический заряд протона равен по величине заряду электрона, суммарный электрический заряд иона равен числу протонов в ионе за вычетом числа электронов.
Ананион (−) ( / ˈ æ n ˌ aɪ . ən / ANN -eye-ən , от греческого слова ἄνω ( ánō ), что означает «вверх» [13] ) — это ион с большим количеством электронов, чем протонов, что даёт ему суммарный отрицательный заряд (так как электроны заряжены отрицательно, а протоны — положительно). [14]
Акатион (+) ( / ˈ k æ t ˌ aɪ . ən / KAT -eye-ən , от греческого слова κάτω ( káto ), что означает «вниз» [15] ) — это ион с меньшим количеством электронов, чем протонов, что придает ему положительный заряд. [16]
Существуют дополнительные названия, используемые для ионов с несколькими зарядами. Например, ион с зарядом −2 известен как дианион , а ион с зарядом +2 известен как дикатион . Цвиттерион — это нейтральная молекула с положительными и отрицательными зарядами в разных местах внутри этой молекулы. [17]
Катионы и анионы измеряются по их ионному радиусу , и они различаются по относительному размеру: «Катионы малы, большинство из них имеют радиус менее 10−10 м (10−8 см ). Но большинство анионов большие, как и наиболее распространенный анион Земли, кислород . Из этого факта очевидно, что большую часть пространства кристалла занимает анион, а катионы вписываются в промежутки между ними». [18]
Термины анион и катион (для ионов, которые перемещаются соответственно к аноду и катоду в процессе электролиза) были введены Майклом Фарадеем в 1834 году после консультации с Уильямом Уэвеллом .
Ионы повсеместно распространены в природе и отвечают за разнообразные явления от свечения Солнца до существования ионосферы Земли . Атомы в ионном состоянии могут иметь цвет, отличный от цвета нейтральных атомов, и, таким образом, поглощение света ионами металлов дает цвет драгоценных камней . Как в неорганической, так и в органической химии (включая биохимию) взаимодействие воды и ионов чрезвычайно важно [ требуется ссылка ] ; примером является энергия, которая управляет распадом аденозинтрифосфата ( АТФ ). [ требуется разъяснение ]
Ионы могут быть получены нехимическим путем с использованием различных источников ионов , обычно с высоким напряжением или температурой. Они используются во множестве устройств, таких как масс-спектрометры , оптические эмиссионные спектрометры , ускорители частиц , ионные имплантеры и ионные двигатели .
Как реактивные заряженные частицы, они также используются для очистки воздуха, уничтожая микробы, а также в бытовых приборах, таких как детекторы дыма .
Поскольку сигнализация и метаболизм в организмах контролируются точным ионным градиентом через мембраны , нарушение этого градиента способствует гибели клеток. Это распространенный механизм, используемый природными и искусственными биоцидами , включая ионные каналы грамицидина и амфотерицина ( фунгицида ).
Неорганические растворенные ионы являются компонентом общего количества растворенных твердых веществ , широко известного показателя качества воды .
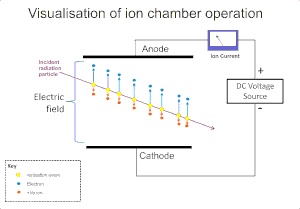
Ионизирующее воздействие излучения на газ широко используется для обнаружения таких видов излучения, как альфа , бета , гамма и рентгеновские лучи . Первоначальное событие ионизации в этих приборах приводит к образованию «ионной пары»: положительного иона и свободного электрона, путем ионного удара излучения о молекулы газа. Ионизационная камера является простейшим из этих детекторов и собирает все заряды, созданные прямой ионизацией внутри газа посредством приложения электрического поля. [5]
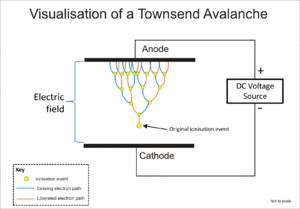
И трубка Гейгера -Мюллера , и пропорциональный счетчик используют явление, известное как лавина Таунсенда, для умножения эффекта первоначального ионизирующего события посредством каскадного эффекта, при котором свободные электроны получают достаточно энергии от электрического поля для высвобождения дополнительных электронов за счет ионного удара.
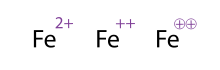
При записи химической формулы иона его суммарный заряд записывается в верхнем индексе сразу после химической структуры молекулы/атома. Суммарный заряд записывается с величиной перед знаком; то есть двухзарядный катион обозначается как 2+ вместо +2 . Однако для однозарядных молекул/атомов величина заряда опускается; например, катион натрия обозначается как Na + , а не Na 1+ .
Альтернативный (и приемлемый) способ показать молекулу/атом с несколькими зарядами — это нарисовать знаки несколько раз, это часто встречается у переходных металлов. Химики иногда обводят знак; это просто украшение и не меняет химического смысла. Все три представления Fe 2+ , Fe ++ и Fe ⊕⊕ , показанные на рисунке, таким образом, эквивалентны.

Одноатомные ионы иногда также обозначаются римскими цифрами , особенно в спектроскопии ; например, пример Fe 2+ (положительно дважды заряженный), показанный выше, обозначается как Fe(III) , Fe III или Fe III (Fe I для нейтрального атома Fe, Fe II для однократно ионизированного иона Fe). Римская цифра обозначает формальную степень окисления элемента, тогда как надстрочные индо-арабские цифры обозначают чистый заряд. Таким образом, эти два обозначения взаимозаменяемы для одноатомных ионов, но римские цифры не могут быть применены к многоатомным ионам. Однако можно смешивать обозначения для отдельного металлического центра с многоатомным комплексом, как показано в примере с ионом уранила.
Если ион содержит неспаренные электроны , он называется ион -радикалом . Так же, как и незаряженные радикалы, ион-радикалы очень реакционноспособны. Многоатомные ионы, содержащие кислород, такие как карбонат и сульфат, называются оксианионами . Молекулярные ионы, которые содержат по крайней мере одну связь углерода с водородом, называются органическими ионами . Если заряд в органическом ионе формально сосредоточен на углероде, он называется карбокатионом (если заряжен положительно) или карбанионом (если заряжен отрицательно).
Одноатомные ионы образуются в результате присоединения или отсоединения электронов к валентной оболочке (внешней электронной оболочке) атома. Внутренние оболочки атома заполнены электронами, которые прочно связаны с положительно заряженным атомным ядром и поэтому не участвуют в этом виде химического взаимодействия. Процесс присоединения или отсоединения электронов от нейтрального атома или молекулы называется ионизацией .
Атомы могут быть ионизированы посредством бомбардировки излучением , но более распространенный процесс ионизации, встречающийся в химии , — это перенос электронов между атомами или молекулами. Этот перенос обычно обусловлен достижением стабильных («закрытых оболочек») электронных конфигураций . Атомы будут получать или терять электроны в зависимости от того, какое действие требует наименьшей энергии.
Например, атом натрия Na имеет один электрон в своей валентной оболочке, окружающий 2 стабильные заполненные внутренние оболочки из 2 и 8 электронов. Поскольку эти заполненные оболочки очень стабильны, атом натрия имеет тенденцию терять свой дополнительный электрон и достигать этой стабильной конфигурации, становясь катионом натрия в процессе
С другой стороны, атом хлора , Cl, имеет 7 электронов в своей валентной оболочке, что на один меньше стабильной заполненной оболочки с 8 электронами. Таким образом, атом хлора стремится получить дополнительный электрон и достичь стабильной конфигурации из 8 электронов , становясь в этом процессе хлорид-анионом:
Эта движущая сила заставляет натрий и хлор вступать в химическую реакцию, в которой «лишний» электрон передается от натрия к хлору, образуя катионы натрия и анионы хлорида. Будучи противоположно заряженными, эти катионы и анионы образуют ионные связи и объединяются, образуя хлорид натрия , NaCl, более известный как поваренная соль.

Многоатомные и молекулярные ионы часто образуются путем получения или потери элементарных ионов, таких как протон, H + , в нейтральных молекулах. Например, когда аммиак , NH 3 , принимает протон, H + — процесс, называемый протонированием — он образует ион аммония , NH+4Аммиак и аммоний имеют одинаковое число электронов в по сути одинаковой электронной конфигурации , но у аммония есть дополнительный протон, который придает ему суммарный положительный заряд.
Аммиак также может потерять электрон, чтобы получить положительный заряд, образуя ион NH+3. Однако этот ион нестабилен, поскольку имеет неполную валентную оболочку вокруг атома азота, что делает его очень реактивным ион -радикалом .
Из-за нестабильности радикальных ионов многоатомные и молекулярные ионы обычно образуются путем приобретения или потери элементарных ионов, таких как H + , а не приобретения или потери электронов. Это позволяет молекуле сохранять свою стабильную электронную конфигурацию, приобретая при этом электрический заряд.
Энергия , необходимая для отрыва электрона в его самом низком энергетическом состоянии от атома или молекулы газа с меньшим чистым электрическим зарядом, называется потенциалом ионизации или энергией ионизации . N -я энергия ионизации атома — это энергия, необходимая для отрыва его n -го электрона после того, как первые n − 1 электронов уже оторвались.
Каждая последующая энергия ионизации заметно больше предыдущей. Особенно большое увеличение происходит после того, как любой данный блок атомных орбиталей исчерпывает электроны. По этой причине ионы имеют тенденцию образовываться способами, которые оставляют их с полными орбитальными блоками. Например, у натрия есть один валентный электрон на его самой внешней оболочке, поэтому в ионизированной форме он обычно находится с одним потерянным электроном, как Na + . С другой стороны периодической таблицы у хлора есть семь валентных электронов, поэтому в ионизированной форме он обычно находится с одним приобретенным электроном, как Cl − . У цезия самая низкая измеренная энергия ионизации из всех элементов, а у гелия самая большая. [19] В целом, энергия ионизации металлов намного ниже, чем энергия ионизации неметаллов , поэтому, как правило, металлы будут терять электроны, образуя положительно заряженные ионы, а неметаллы будут приобретать электроны, образуя отрицательно заряженные ионы.
Ионная связь — это вид химической связи , возникающей из-за взаимного притяжения противоположно заряженных ионов. Ионы с одинаковым зарядом отталкиваются друг от друга, а ионы с противоположным зарядом притягиваются. Поэтому ионы обычно не существуют сами по себе, а связываются с ионами с противоположным зарядом, образуя кристаллическую решетку . Полученное соединение называется ионным соединением , и считается, что оно удерживается вместе ионной связью . В ионных соединениях возникают характерные расстояния между соседними ионами, из которых можно вывести пространственное расширение и ионный радиус отдельных ионов.
Наиболее распространенный тип ионной связи наблюдается в соединениях металлов и неметаллов (за исключением благородных газов , которые редко образуют химические соединения). Металлы характеризуются тем, что имеют небольшое количество электронов сверх стабильной электронной конфигурации с закрытой оболочкой . Таким образом, они имеют тенденцию терять эти дополнительные электроны, чтобы достичь стабильной конфигурации. Это свойство известно как электроположительность . Неметаллы, с другой стороны, характеризуются тем, что имеют электронную конфигурацию, которая всего на несколько электронов меньше стабильной конфигурации. Таким образом, они имеют тенденцию получать больше электронов, чтобы достичь стабильной конфигурации. Эта тенденция известна как электроотрицательность . Когда высокоэлектроположительный металл соединяется с высокоэлектроотрицательным неметаллом, дополнительные электроны от атомов металла переносятся к атомам неметалла с дефицитом электронов. Эта реакция производит катионы металла и анионы неметалла, которые притягиваются друг к другу, образуя соль .
{{cite book}}: |journal=проигнорировано ( помощь )