Макрофаги ( / ˈ m æ k r oʊ f eɪ dʒ / ; сокращенно M φ , MΦ или MP ) представляют собой тип белых кровяных клеток врожденной иммунной системы , которые поглощают и переваривают патогены, такие как раковые клетки , микробы , клеточный детрит и чужеродные вещества, на поверхности которых нет белков, специфичных для здоровых клеток организма. [1] [2] Этот процесс называется фагоцитозом и защищает хозяина от инфекции и травм. [3]
Макрофаги встречаются практически во всех тканях, [4] где они патрулируют потенциальные патогены с помощью амебоидного движения . Они принимают различные формы (с разными названиями) по всему телу (например, гистиоциты , клетки Купфера , альвеолярные макрофаги , микроглия и другие), но все они являются частью системы мононуклеарных фагоцитов . Помимо фагоцитоза, они играют важную роль в неспецифической защите ( врожденный иммунитет ), а также помогают инициировать специфические защитные механизмы ( адаптивный иммунитет ), привлекая другие иммунные клетки, такие как лимфоциты . Например, они важны как антигенпрезентаторы для Т-клеток . У людей дисфункциональные макрофаги вызывают тяжелые заболевания, такие как хроническая гранулематозная болезнь , которая приводит к частым инфекциям.
Помимо усиления воспаления и стимуляции иммунной системы, макрофаги также играют важную противовоспалительную роль и могут снижать иммунные реакции посредством высвобождения цитокинов . Макрофаги, которые стимулируют воспаление, называются макрофагами M1, тогда как те, которые уменьшают воспаление и стимулируют восстановление тканей, называются макрофагами M2. [5] Это различие отражается в их метаболизме; макрофаги M1 обладают уникальной способностью метаболизировать аргинин в «убийственную» молекулу оксида азота , тогда как макрофаги M2 обладают уникальной способностью метаболизировать аргинин в «ремонтную» молекулу орнитин . [6] Однако эта дихотомия недавно была подвергнута сомнению, поскольку была обнаружена дополнительная сложность. [7]
Человеческие макрофаги имеют диаметр около 21 микрометра (0,00083 дюйма) [8] и производятся путем дифференциации моноцитов в тканях. Их можно идентифицировать с помощью проточной цитометрии или иммуногистохимического окрашивания по их специфической экспрессии белков, таких как CD14 , CD40 , CD11b , CD64 , F4/80 (мыши)/ EMR1 (человек), лизоцим M, MAC-1 /MAC-3 и CD68 . [9]
Макрофаги были впервые обнаружены и названы Ильей Мечниковым , зоологом Российской империи, в 1884 году. [10] [11]
Большинство макрофагов размещены в стратегических точках, где вероятна микробная инвазия или накопление чужеродных частиц. Эти клетки вместе как группа известны как система мононуклеарных фагоцитов и ранее были известны как ретикулоэндотелиальная система. Каждый тип макрофагов, определяемый его местоположением, имеет определенное название:
Исследования, касающиеся клеток Купфера, затруднены, поскольку у людей клетки Купфера доступны для иммуногистохимического анализа только из биопсий или аутопсий. У крыс и мышей их трудно изолировать, и после очистки из одной мыши можно получить только около 5 миллионов клеток.
Макрофаги могут выражать паракринные функции в органах, которые специфичны для функции этого органа. Например, в яичках макрофаги, как было показано, способны взаимодействовать с клетками Лейдига , секретируя 25-гидроксихолестерин , оксистерин , который может быть преобразован в тестостерон соседними клетками Лейдига. [15] Кроме того, макрофаги яичек могут участвовать в создании иммунно-привилегированной среды в яичках и в опосредовании бесплодия при воспалении яичек.
Резидентные макрофаги сердца участвуют в электрической проводимости посредством щелевых контактов с сердечными миоцитами . [16]
Макрофаги можно классифицировать на основе фундаментальной функции и активации. Согласно этой группировке, существуют классически активированные (M1) макрофаги , макрофаги, заживляющие раны (также известные как альтернативно активированные (M2) макрофаги ) и регуляторные макрофаги (Mregs). [17]
Макрофаги, которые находятся во взрослых здоровых тканях, либо происходят из циркулирующих моноцитов , либо устанавливаются до рождения и затем поддерживаются в течение взрослой жизни независимо от моноцитов. [18] [19] Напротив, большинство макрофагов, которые накапливаются в пораженных участках, обычно происходят из циркулирующих моноцитов. [20] Экстравазация лейкоцитов описывает проникновение моноцитов в поврежденную ткань через эндотелий кровеносных сосудов , когда они становятся макрофагами. Моноциты привлекаются к поврежденному участку химическими веществами через хемотаксис , вызванный рядом стимулов, включая поврежденные клетки, патогены и цитокины, выделяемые макрофагами уже на этом участке. Было показано, что в некоторых участках, таких как яички, макрофаги заселяют орган посредством пролиферации. [21] В отличие от короткоживущих нейтрофилов , макрофаги выживают в организме дольше, до нескольких месяцев.
Макрофаги являются профессиональными фагоцитами и узкоспециализированы в удалении умирающих или мертвых клеток и клеточного мусора. Эта роль важна при хроническом воспалении, поскольку на ранних стадиях воспаления доминируют нейтрофилы, которые поглощаются макрофагами, если они достигают зрелости (см. CD31 для описания этого процесса). [22]
Сначала нейтрофилы притягиваются к месту, где они выполняют свою функцию и погибают, прежде чем они или их нейтрофильные внеклеточные ловушки будут фагоцитированы макрофагами. [22] [23] Когда на месте, первая волна нейтрофилов, после процесса старения и после первых 48 часов, стимулирует появление макрофагов, посредством чего эти макрофаги затем поглотят старые нейтрофилы. [22]
Удаление отмирающих клеток в большей степени осуществляется фиксированными макрофагами , которые остаются в стратегических местах, таких как легкие, печень, нервная ткань , кости, селезенка и соединительная ткань, поглощая инородные материалы, такие как патогены, и привлекая дополнительные макрофаги при необходимости. [24]
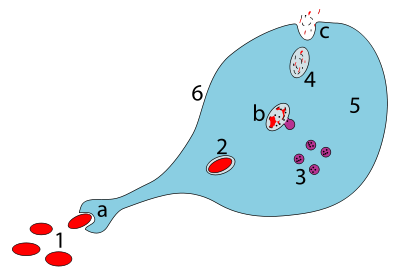
Когда макрофаг поглощает патоген, патоген оказывается в ловушке фагосомы , которая затем сливается с лизосомой . Внутри фаголизосомы ферменты и токсичные пероксиды переваривают патоген. Однако некоторые бактерии, такие как Mycobacterium tuberculosis , стали устойчивыми к этим методам переваривания. Брюшные сальмонеллы вызывают собственный фагоцитоз макрофагами хозяина in vivo и подавляют переваривание лизосомальным действием, тем самым используя макрофаги для собственной репликации и вызывая апоптоз макрофагов. [ 25] Макрофаги могут переварить более 100 бактерий, прежде чем они окончательно умрут из-за своих собственных пищеварительных соединений.
При вторжении патогена макрофаги, находящиеся в тканях, являются одними из первых клеток, которые реагируют. [26] Две основные функции макрофагов, находящихся в тканях, заключаются в фагоцитозе входящего антигена и секреции провоспалительных цитокинов, которые вызывают воспаление и привлекают другие иммунные клетки в этот участок. [27]

Макрофаги могут интернализовать антигены посредством рецептор-опосредованного фагоцитоза. [28] Макрофаги имеют широкий спектр рецепторов распознавания образов (PRR), которые могут распознавать молекулярные образцы, ассоциированные с микробами (MAMP), от патогенов. Многие PRR, такие как толл-подобные рецепторы (TLR), рецепторы-мусорщики (SR), рецепторы лектина C-типа и другие, распознают патогены для фагоцитоза. [28] Макрофаги также могут распознавать патогены для фагоцитоза косвенно через опсонины , которые представляют собой молекулы, которые прикрепляются к патогенам и маркируют их для фагоцитоза. [29] Опсонины могут вызывать более сильную адгезию между макрофагом и патогеном во время фагоцитоза, поэтому опсонины имеют тенденцию усиливать фагоцитарную активность макрофагов. [30] Как белки комплемента , так и антитела могут связываться с антигенами и опсонизировать их. Макрофаги имеют рецепторы комплемента 1 (CR1) и 3 (CR3), которые распознают связанные с патогеном белки комплемента C3b и iC3b соответственно, а также фрагментные кристаллизующиеся γ-рецепторы (FcγR), которые распознают фрагментарно кристаллизующуюся (Fc) область антигенсвязанных антител иммуноглобулина G (IgG). [29] [31] При фагоцитозе и переваривании патогенов макрофаги проходят через респираторный взрыв , при котором потребляется больше кислорода для обеспечения энергии, необходимой для производства активных форм кислорода (ROS) и других антимикробных молекул, которые переваривают потребленные патогены. [27] [32]
Распознавание MAMP рецепторами PRR может активировать макрофаги, находящиеся в тканях, для секреции провоспалительных цитокинов, которые привлекают другие иммунные клетки. Среди PRR TLR играют важную роль в передаче сигнала, приводящей к продукции цитокинов. [28] Связывание MAMP с TLR запускает ряд нисходящих событий, которые в конечном итоге активируют фактор транскрипции NF-κB и приводят к транскрипции генов для нескольких провоспалительных цитокинов, включая IL-1β , IL-6 , TNF-α , IL-12B и интерфероны типа I, такие как IFN-α и IFN-β. [33] Системно IL-1β, IL-6 и TNF-α вызывают лихорадку и инициируют ответ острой фазы, при котором печень секретирует белки острой фазы . [26] [27] [34] Локально ИЛ-1β и ФНО-α вызывают вазодилатацию, при которой расширяются промежутки между эпителиальными клетками кровеносных сосудов, а также повышают регуляцию молекул адгезии клеточной поверхности на эпителиальных клетках, что приводит к экстравазации лейкоцитов . [26] [27]
Нейтрофилы являются одними из первых иммунных клеток, которые макрофаги привлекают для выхода из крови через экстравазацию и достижения места инфекции. [34] Макрофаги секретируют множество хемокинов, таких как CXCL1 , CXCL2 и CXCL8 (IL-8), которые привлекают нейтрофилы к месту инфекции. [26] [34] После того, как нейтрофилы завершают фагоцитоз и выводят антиген в конце иммунного ответа, они подвергаются апоптозу, и макрофаги привлекаются из моноцитов крови, чтобы помочь очистить апоптотический мусор. [35]
Макрофаги также привлекают другие иммунные клетки, такие как моноциты, дендритные клетки, естественные клетки-киллеры, базофилы, эозинофилы и Т-клетки, посредством хемокинов, таких как CCL2 , CCL4 , CCL5 , CXCL8 , CXCL9 , CXCL10 и CXCL11 . [26] [34] Наряду с дендритными клетками макрофаги помогают активировать естественные клетки-киллеры (NK) посредством секреции интерферонов I типа (IFN-α и IFN-β) и IL-12 . IL-12 действует совместно с IL-18, стимулируя выработку провоспалительного цитокина интерферона гамма (IFN-γ) NK-клетками, который служит важным источником IFN-γ до активации адаптивной иммунной системы. [34] [36] IFN-γ усиливает врожденный иммунный ответ, вызывая более агрессивный фенотип в макрофагах, позволяя макрофагам более эффективно убивать патогены. [34]
Некоторые из хемоаттрактантов Т-клеток, секретируемых макрофагами, включают CCL5 , CXCL9 , CXCL10 и CXCL11 . [26]

Макрофаги являются профессиональными антигенпрезентирующими клетками (APC), что означает, что они могут представлять пептиды из фагоцитированных антигенов на молекулах главного комплекса гистосовместимости (MHC) II на своей клеточной поверхности для Т-хелперных клеток. [38] Макрофаги не являются первичными активаторами наивных Т-хелперных клеток, которые никогда ранее не были активированы, поскольку макрофаги, находящиеся в тканях, не перемещаются в лимфатические узлы, где находятся наивные Т-хелперные клетки. [39] [40] Хотя макрофаги также обнаруживаются во вторичных лимфоидных органах, таких как лимфатические узлы, они не находятся в зонах Т-клеток и неэффективны в активации наивных Т-хелперных клеток. [39] Макрофаги в лимфоидных тканях больше вовлечены в поглощение антигенов и предотвращение их попадания в кровь, а также в захват мусора из апоптотических лимфоцитов. [39] [41] Таким образом, макрофаги взаимодействуют в основном с ранее активированными Т-хелперными клетками, которые покинули лимфатический узел и прибыли в место инфекции, или с резидентными Т-клетками памяти тканей. [40]
Макрофаги подают оба сигнала, необходимые для активации Т-хелперных клеток: 1) Макрофаги представляют молекулу MHC II класса, связанную с антигенным пептидом, для распознавания соответствующим рецептором Т-клеток (TCR), и 2) распознавание патогенов PRR побуждает макрофаги повышать уровень костимулирующих молекул CD80 и CD86 (также известных как B7 ), которые связываются с CD28 на Т-хелперных клетках для подачи костимулирующего сигнала. [34] [38] Эти взаимодействия позволяют Т-хелперным клеткам достигать полной эффекторной функции и обеспечивают Т-хелперным клеткам непрерывные сигналы выживания и дифференцировки, предотвращая их апоптоз из-за отсутствия сигнала TCR. [38] Например, сигнализация IL-2 в Т-клетках повышает экспрессию антиапоптотического белка Bcl-2 , но продукция Т-клетками IL-2 и высокоаффинного рецептора IL-2 IL-2RA требуют постоянного сигнала от распознавания TCR антигена, связанного с MHC. [34] [42]
Макрофаги могут достигать различных фенотипов активации посредством взаимодействия с различными подгруппами Т-хелперных клеток, такими как T H 1 и T H 2. [17] Хотя существует широкий спектр фенотипов активации макрофагов, есть два основных фенотипа, которые общепризнаны. [17] Это классически активированные макрофаги, или макрофаги M1, и альтернативно активированные макрофаги, или макрофаги M2. Макрофаги M1 являются провоспалительными, в то время как макрофаги M2 в основном противовоспалительные. [17]
Клетки T H 1 играют важную роль в классической активации макрофагов как части иммунного ответа типа 1 против внутриклеточных патогенов (таких как внутриклеточные бактерии ), которые могут выживать и размножаться внутри клеток-хозяев, особенно тех патогенов, которые размножаются даже после фагоцитоза макрофагами. [43] После того, как TCR клеток T H 1 распознает специфические антигенные пептид-связанные молекулы MHC класса II на макрофагах, клетки T H 1 1) секретируют IFN-γ и 2) повышают экспрессию лиганда CD40 (CD40L), который связывается с CD40 на макрофагах. [44] [34] Эти 2 сигнала активируют макрофаги и усиливают их способность убивать внутриклеточных патогенов за счет увеличения продукции антимикробных молекул, таких как оксид азота (NO) и супероксид (O 2- ). [26] [34] Это усиление антимикробной способности макрофагов клетками T H 1 известно как классическая активация макрофагов, а активированные макрофаги известны как классически активированные макрофаги или макрофаги M1. Макрофаги M1, в свою очередь, повышают регуляцию молекул B7 и презентацию антигена через молекулы MHC класса II, чтобы обеспечить сигналы, которые поддерживают помощь Т-клеток. [44] Активация макрофагов T H 1 и M1 представляет собой положительную обратную связь, при этом IFN-γ из клеток T H 1 повышает экспрессию CD40 на макрофагах; взаимодействие между CD40 на макрофагах и CD40L на Т-клетках активирует макрофаги для секреции IL-12; а IL-12 способствует большей секреции IFN-γ из клеток T H 1. [34] [44] Первоначальный контакт между макрофагальным антигенсвязанным MHC II и TCR служит точкой контакта между двумя клетками, где концентрируется большая часть секреции IFN-γ и CD-40L на Т-клетках, поэтому, скорее всего, будут активированы только макрофаги, напрямую взаимодействующие с клетками T H 1. [34]
В дополнение к активации макрофагов M1, клетки T H 1 экспрессируют лиганд Fas (FasL) и лимфотоксин бета (LT-β), чтобы помочь убить хронически инфицированные макрофаги, которые больше не могут убивать патогены. [34] Убийство хронически инфицированных макрофагов высвобождает патогены во внеклеточное пространство, которые затем могут быть убиты другими активированными макрофагами. [34] Клетки T H 1 также помогают привлечь больше моноцитов, предшественников макрофагов, к месту инфекции. Секреция T H 1 TNF-α и LT-α, чтобы облегчить связывание и выход моноцитов из кровеносных сосудов. [34] Секреция T H 1 CCL2 в качестве хемоаттрактанта для моноцитов. IL-3 и GM-CSF, выделяемые клетками T H 1, стимулируют большее производство моноцитов в костном мозге. [34]
Когда внутриклеточные патогены не могут быть устранены, как в случае Mycobacterium tuberculosis , патоген сдерживается посредством образования гранулемы , скопления инфицированных макрофагов, окруженных активированными Т-клетками. [45] Макрофаги, граничащие с активированными лимфоцитами, часто сливаются, образуя многоядерные гигантские клетки, которые, по-видимому, обладают повышенной антимикробной способностью из-за их близости к клеткам T H 1, но со временем клетки в центре начинают умирать и образовывать некротическую ткань. [40] [45]
Клетки T H 2 играют важную роль в альтернативной активации макрофагов как части иммунного ответа типа 2 против крупных внеклеточных патогенов, таких как гельминты . [34] [46] Клетки T H 2 секретируют IL-4 и IL-13, которые активируют макрофаги, чтобы они стали макрофагами M2, также известными как альтернативно активированные макрофаги. [46] [47] Макрофаги M2 экспрессируют аргиназу-1 , фермент, который превращает аргинин в орнитин и мочевину . [46] Орнитин помогает увеличить сокращение гладких мышц для изгнания червя, а также участвует в заживлении тканей и ран. Орнитин может далее метаболизироваться в пролин , который необходим для синтеза коллагена . [46] Макрофаги M2 также могут уменьшать воспаление, вырабатывая антагониста рецептора IL-1 (IL-1RA) и рецепторы IL-1, которые не приводят к нисходящей воспалительной сигнализации (IL-1RII). [34] [48]
Другая часть активации адаптивного иммунитета включает стимуляцию CD8 + посредством перекрестной презентации антигенных пептидов на молекулах MHC класса I. Исследования показали, что провоспалительные макрофаги способны к перекрестной презентации антигенов на молекулах MHC класса I, но играет ли перекрестная презентация макрофагов роль в активации наивных или памяти CD8 + T-клеток, пока неясно. [27] [49] [41]
Было показано, что макрофаги секретируют цитокины BAFF и APRIL, которые важны для переключения изотипа плазматических клеток. APRIL и IL-6, секретируемые предшественниками макрофагов в костном мозге, помогают поддерживать выживаемость плазматических клеток, размещенных в костном мозге. [50]
Существует несколько активированных форм макрофагов. [17] Несмотря на спектр способов активации макрофагов, существуют две основные группы, обозначенные как M1 и M2 . Макрофаги M1: как упоминалось ранее (ранее называвшиеся классически активированными макрофагами), [52] макрофаги-«киллеры» M1 активируются ЛПС и IFN-гамма и секретируют высокие уровни IL-12 и низкие уровни IL-10 . Макрофаги M1 выполняют провоспалительные, бактерицидные и фагоцитарные функции. [53] Напротив, обозначение M2 «ремонт» (также называемое альтернативно активированными макрофагами) в широком смысле относится к макрофагам, которые функционируют в конструктивных процессах, таких как заживление ран и восстановление тканей, и тем, которые отключают повреждающую активацию иммунной системы, вырабатывая противовоспалительные цитокины, такие как IL-10 . M2 является фенотипом резидентных тканевых макрофагов и может быть дополнительно повышено IL-4 . Макрофаги M2 производят высокие уровни IL-10, TGF-бета и низкие уровни IL-12. Опухолеассоциированные макрофаги в основном имеют фенотип M2 и, по-видимому, активно способствуют росту опухоли. [54]
Макрофаги существуют в различных фенотипах, которые определяются ролью, которую они играют в созревании ран. Фенотипы можно преимущественно разделить на две основные категории: M1 и M2. Макрофаги M1 являются доминирующим фенотипом, наблюдаемым на ранних стадиях воспаления, и активируются четырьмя ключевыми медиаторами: интерфероном-γ (IFN-γ), фактором некроза опухоли (TNF) и молекулярными паттернами, связанными с повреждением (DAMP). Эти молекулы-медиаторы создают провоспалительный ответ, который в свою очередь вырабатывает провоспалительные цитокины, такие как интерлейкин-6 и TNF. В отличие от макрофагов M1, макрофаги M2 секретируют противовоспалительный ответ посредством добавления интерлейкина-4 или интерлейкина-13. Они также играют роль в заживлении ран и необходимы для реваскуляризации и реэпителизации. Макрофаги M2 делятся на четыре основных типа в зависимости от их роли: M2a, M2b, M2c и M2d. То, как определяются фенотипы M2, все еще остается предметом обсуждения, но исследования показали, что их среда позволяет им приспосабливаться к тому фенотипу, который наиболее подходит для эффективного заживления раны. [53]
Макрофаги M2 необходимы для сосудистой стабильности. Они вырабатывают фактор роста эндотелия сосудов-A и TGF-β1 . [53] При острых ранах наблюдается фенотипический сдвиг от макрофагов M1 к макрофагам M2, однако при хронических ранах этот сдвиг нарушен. Эта дисрегуляция приводит к недостаточному количеству макрофагов M2 и соответствующих им факторов роста, которые способствуют заживлению ран. При недостатке этих факторов роста/противовоспалительных цитокинов и переизбытке провоспалительных цитокинов от макрофагов M1 хронические раны не могут заживать своевременно. Обычно после того, как нейтрофилы съедают остатки/патогены, они выполняют апоптоз и удаляются. На этом этапе воспаление не требуется, и M1 переключается на M2 (противовоспалительный). Однако дисрегуляция происходит, поскольку макрофаги M1 неспособны/не фагоцитируют нейтрофилы, которые подверглись апоптозу, что приводит к увеличению миграции макрофагов и воспалению. [53]
Макрофаги M1 и M2 играют роль в развитии атеросклероза . Макрофаги M1 способствуют развитию атеросклероза путем воспаления. Макрофаги M2 могут удалять холестерин из кровеносных сосудов, но когда холестерин окисляется, макрофаги M2 становятся апоптотическими пенистыми клетками, способствующими образованию атероматозных бляшек атеросклероза. [55] [56]
Первый шаг к пониманию важности макрофагов в восстановлении, росте и регенерации мышц заключается в том, что существуют две «волны» макрофагов с началом использования поврежденных мышц — субпопуляции, которые оказывают и не оказывают прямого влияния на восстановление мышц. Первоначальная волна — это фагоцитарная популяция, которая появляется в периоды повышенного использования мышц, достаточного для того, чтобы вызвать лизис мышечной мембраны и воспаление мембраны, которые могут проникать и разрушать содержимое поврежденных мышечных волокон. [57] [58] [59] Эти рано вторгающиеся фагоцитарные макрофаги достигают своей наивысшей концентрации примерно через 24 часа после начала какой-либо формы повреждения мышечной клетки или перезагрузки. [60] Их концентрация быстро снижается через 48 часов. [58] Вторая группа — это нефагоцитарные типы, которые распределяются вблизи регенеративных волокон. Они достигают пика между двумя и четырьмя днями и остаются повышенными в течение нескольких дней, пока восстанавливается мышечная ткань. [58] Первая субпопуляция не имеет прямого преимущества для восстановления мышц, тогда как вторая нефагоцитарная группа имеет.
Считается, что макрофаги выделяют растворимые вещества, которые влияют на пролиферацию, дифференциацию, рост, восстановление и регенерацию мышц, но в настоящее время неизвестен фактор, который вырабатывается для опосредования этих эффектов. [60] Известно, что участие макрофагов в содействии восстановлению тканей не является специфическим для мышц; они накапливаются во многих тканях во время фазы процесса заживления после травмы. [61]
Макрофаги необходимы для заживления ран . [62] Они заменяют полиморфноядерные нейтрофилы в качестве преобладающих клеток в ране на второй день после травмы. [63] Привлеченные к месту раны факторами роста, выделяемыми тромбоцитами и другими клетками, моноциты из кровотока попадают в эту область через стенки кровеносных сосудов. [64] Количество моноцитов в ране достигает пика через один-полтора дня после травмы. Оказавшись в месте раны, моноциты созревают в макрофаги. Селезенка содержит половину моноцитов организма в резерве, готовых к развертыванию в поврежденной ткани. [65] [66]
Основная роль макрофагов заключается в фагоцитировании бактерий и поврежденной ткани, [62] а также они очищают поврежденную ткань, высвобождая протеазы. [67] Макрофаги также секретируют ряд факторов, таких как факторы роста и другие цитокины, особенно в течение третьего и четвертого дня после ранения. Эти факторы привлекают клетки, участвующие в стадии пролиферации заживления, в эту область. [68] Макрофаги также могут сдерживать фазу сокращения. [69] Макрофаги стимулируются низким содержанием кислорода в их окружении для выработки факторов, которые вызывают и ускоряют ангиогенез [70] , и они также стимулируют клетки, которые реэпителизируют рану, создают грануляционную ткань и закладывают новый внеклеточный матрикс . [71] [ нужен лучший источник ] Секретируя эти факторы, макрофаги способствуют продвижению процесса заживления раны в следующую фазу.
Ученые выяснили, что макрофаги не только поедают материальный мусор, но и участвуют в типичной регенерации конечностей у саламандры. [72] [73] Они обнаружили, что удаление макрофагов у саламандры привело к невозможности регенерации конечностей и образованию рубцов. [72] [73]
Как описано выше, макрофаги играют ключевую роль в удалении умирающих или мертвых клеток и клеточного мусора. Эритроциты имеют продолжительность жизни в среднем 120 дней и поэтому постоянно разрушаются макрофагами в селезенке и печени. Макрофаги также поглощают макромолекулы и поэтому играют ключевую роль в фармакокинетике парентерального железа . [ необходима цитата ]
Железо, которое высвобождается из гемоглобина, либо хранится внутри в ферритине , либо высвобождается в кровоток через ферропортин . В случаях, когда системные уровни железа повышаются или когда присутствует воспаление, повышенные уровни гепсидина действуют на каналы ферропортина макрофагов, что приводит к тому, что железо остается внутри макрофагов. [ необходима цитата ]

Меланофаги — это подгруппа макрофагов, находящихся в тканях и способных поглощать пигмент, как собственный для организма, так и экзогенный (например, татуировки ), из внеклеточного пространства. В отличие от дендритных соединительных меланоцитов , которые синтезируют меланосомы и содержат различные стадии своего развития, меланофаги накапливают только фагоцитированный меланин в лизосомоподобных фагосомах. [74] [75] Это происходит неоднократно, поскольку пигмент из мертвых дермальных макрофагов фагоцитируется их преемниками, сохраняя татуировку на том же месте. [76]
Каждая ткань содержит свою собственную специализированную популяцию резидентных макрофагов, которые поддерживают взаимные связи со стромой и функциональной тканью. [77] [78] Эти резидентные макрофаги являются сидячими (немигрирующими), обеспечивают необходимые факторы роста для поддержки физиологической функции ткани (например, перекрестные связи макрофагов и нейронов в кишечнике) [79] и могут активно защищать ткань от воспалительного повреждения. [80]
Нервно-ассоциированные макрофаги или NAM — это макрофаги, которые находятся в тканях и связаны с нервами. Известно, что некоторые из них имеют удлиненную морфологию до 200 мкм [81]
Благодаря своей роли в фагоцитозе макрофаги участвуют во многих заболеваниях иммунной системы. Например, они участвуют в образовании гранулем , воспалительных поражений, которые могут быть вызваны большим количеством заболеваний. Были описаны некоторые нарушения, в основном редкие, неэффективного фагоцитоза и функции макрофагов, например. [82]
В своей роли фагоцитарной иммунной клетки макрофаги отвечают за поглощение патогенов с целью их уничтожения. Некоторые патогены нарушают этот процесс и вместо этого живут внутри макрофага. Это создает среду, в которой патоген скрыт от иммунной системы и позволяет ему размножаться. [ необходима цитата ]
Заболевания с таким типом поведения включают туберкулез (вызываемый Mycobacterium tuberculosis ) и лейшманиоз (вызываемый видами Leishmania ). [ необходима цитата ]
Чтобы свести к минимуму возможность стать хозяином внутриклеточных бактерий, макрофаги выработали защитные механизмы, такие как индукция оксида азота и реактивных кислородных промежуточных продуктов, [83] которые токсичны для микробов. Макрофаги также выработали способность ограничивать подачу питательных веществ микробам и вызывать аутофагию . [84]
После поглощения макрофагом возбудитель туберкулеза, Mycobacterium tuberculosis , [85] избегает клеточной защиты и использует клетку для репликации. Последние данные свидетельствуют о том, что в ответ на легочную инфекцию Mycobacterium tuberculosis периферические макрофаги созревают в фенотип M1. Фенотип макрофага M1 характеризуется повышенной секрецией провоспалительных цитокинов (IL-1β, TNF-α и IL-6) и повышенной гликолитической активностью, необходимой для устранения инфекции. [1]
После фагоцитоза макрофагом паразит Leishmania оказывается в фагоцитарной вакуоли. При нормальных обстоятельствах эта фагоцитарная вакуоль разовьется в лизосому, и ее содержимое будет переварено. Leishmania изменяют этот процесс и избегают уничтожения; вместо этого они устраивают дом внутри вакуоли. [ необходима цитата ]
Инфекция макрофагов в суставах связана с местным воспалением во время и после острой фазы Чикунгуньи (вызванной вирусом CHIKV или Чикунгунья). [86]
Аденовирус (наиболее частая причина конъюнктивита) может оставаться латентным в макрофагах хозяина, при этом выделение вируса продолжается в течение 6–18 месяцев после первичного заражения. [ необходима цитата ]
Brucella spp. может оставаться в латентном состоянии в макрофаге за счет ингибирования слияния фагосомы и лизосомы ; вызывает бруцеллез (волнистую лихорадку). [ необходима цитата ]
Legionella pneumophila , возбудитель болезни легионеров , также поселяется внутри макрофагов. [ необходима цитата ]
Макрофаги являются преобладающими клетками, участвующими в создании прогрессирующих бляшек атеросклероза . [ 87]
Фокальное привлечение макрофагов происходит после начала острого инфаркта миокарда . Эти макрофаги выполняют функцию удаления мусора, апоптотических клеток и подготовки к регенерации тканей . [88] Макрофаги защищают от желудочковой тахикардии, вызванной ишемией, у гипокалиемических мышей. [89]
Макрофаги также играют роль в заражении вирусом иммунодефицита человека (ВИЧ). Как и Т-клетки , макрофаги могут быть инфицированы ВИЧ и даже стать резервуаром для постоянной репликации вируса по всему организму. ВИЧ может проникать в макрофаг через связывание gp120 с CD4 и вторым мембранным рецептором CCR5 (рецептором хемокинов). Как циркулирующие моноциты, так и макрофаги служат резервуаром для вируса. [90] Макрофаги лучше способны противостоять заражению ВИЧ-1, чем CD4+ Т-клетки, хотя восприимчивость к заражению ВИЧ различается среди подтипов макрофагов. [91]
Макрофаги могут способствовать росту и прогрессированию опухоли, способствуя пролиферации и инвазии опухолевых клеток, способствуя ангиогенезу опухоли и подавляя противоопухолевые иммунные клетки. [92] [93] Воспалительные соединения, такие как фактор некроза опухоли (ФНО)-альфа, высвобождаемые макрофагами, активируют генный переключатель ядерного фактора-каппа B. Затем NF-κB проникает в ядро опухолевой клетки и включает выработку белков, которые останавливают апоптоз и способствуют пролиферации клеток и воспалению. [94] Более того, макрофаги служат источником многих проангиогенных факторов, включая сосудистый эндотелиальный фактор (VEGF), фактор некроза опухоли-альфа (ФНО-альфа), макрофагальный колониестимулирующий фактор (M-CSF/CSF1) и IL-1 и IL-6 , [95] способствуя дальнейшему росту опухоли.
Было показано, что макрофаги проникают в ряд опухолей. Их количество коррелирует с плохим прогнозом при некоторых видах рака, включая рак молочной железы, шейки матки, мочевого пузыря, мозга и простаты. [96] [97] Некоторые опухоли также могут продуцировать факторы, включая M-CSF/CSF1, MCP-1/CCL2 и ангиотензин II , которые запускают амплификацию и мобилизацию макрофагов в опухолях. [98] [99] [100] Кроме того, субкапсулярные синусные макрофаги в лимфатических узлах, дренирующих опухоль, могут подавлять прогрессирование рака, сдерживая распространение опухолевых материалов. [101]
Экспериментальные исследования показывают, что макрофаги могут влиять на все терапевтические методы, включая хирургию , химиотерапию , радиотерапию , иммунотерапию и таргетную терапию . [93] [102] [103] Макрофаги могут влиять на результаты лечения как положительно, так и отрицательно. Макрофаги могут быть защитными разными способами: они могут удалять мертвые опухолевые клетки (в процессе, называемом фагоцитозом ) после лечения, которое убивает эти клетки; они могут служить в качестве депо лекарств для некоторых противораковых препаратов; [104] они также могут быть активированы некоторыми видами терапии для повышения противоопухолевого иммунитета. [105] Макрофаги также могут быть вредными разными способами: например, они могут подавлять различные химиотерапии, [106] [107] радиотерапии [108] [109] и иммунотерапии. [110] [111] Поскольку макрофаги могут регулировать прогрессирование опухоли, в настоящее время на онкологических больных тестируются терапевтические стратегии по уменьшению количества этих клеток или манипулированию их фенотипами. [112] [113] Однако макрофаги также участвуют в антитело-опосредованной цитотоксичности (ADCC), и этот механизм, как предполагается, важен для определенных антител иммунотерапии рака. [114]
Было отмечено, что повышенное количество провоспалительных макрофагов в жировой ткани у людей с ожирением способствует развитию осложнений ожирения, включая резистентность к инсулину и диабет 2 типа. [115]
Модуляция воспалительного состояния макрофагов жировой ткани, таким образом, считается возможной терапевтической целью для лечения заболеваний, связанных с ожирением. [116] Хотя макрофаги жировой ткани подвержены противовоспалительному гомеостатическому контролю симпатической иннервацией, эксперименты с использованием мышей с нокаутированным геном ADRB2 показывают, что этот эффект косвенно осуществляется через модуляцию функции адипоцитов, а не через прямую активацию адренергических рецепторов бета-2 , что позволяет предположить, что адренергическая стимуляция макрофагов может быть недостаточной для воздействия на воспаление или функцию жировой ткани при ожирении. [117]
В жировой ( адипозной ) ткани мышей с дефицитом CCR2 наблюдается повышенное количество эозинофилов , большая альтернативная активация макрофагов и склонность к экспрессии цитокинов типа 2. Более того, этот эффект был преувеличен, когда мыши стали тучными из-за диеты с высоким содержанием жиров. [118] Это частично вызвано переключением фенотипа макрофагов, вызванным некрозом жировых клеток ( адипоцитов ). У тучных людей некоторые адипоциты лопаются и подвергаются некротической смерти, что заставляет резидентные макрофаги M2 переключаться на фенотип M1. Это одна из причин слабовыраженного системного хронического воспалительного состояния, связанного с ожирением. [119] [120]
Хотя по структуре они очень похожи на тканевые макрофаги, кишечные макрофаги развили специфические характеристики и функции, учитывая их естественную среду обитания, которая находится в пищеварительном тракте. Макрофаги и кишечные макрофаги обладают высокой пластичностью, что приводит к изменению их фенотипа под воздействием окружающей среды. [121] Как и макрофаги, кишечные макрофаги являются дифференцированными моноцитами, хотя кишечные макрофаги должны сосуществовать с микробиомом в кишечнике. Это сложная задача, учитывая, что бактерии, обнаруженные в кишечнике, не распознаются как «свои» и могут быть потенциальными целями для фагоцитоза макрофагом. [122]
Чтобы предотвратить разрушение кишечных бактерий, кишечные макрофаги выработали ключевые отличия по сравнению с другими макрофагами. Прежде всего, кишечные макрофаги не вызывают воспалительных реакций. В то время как тканевые макрофаги выделяют различные воспалительные цитокины, такие как IL-1, IL-6 и TNF-α, кишечные макрофаги не производят и не секретируют воспалительные цитокины. Это изменение напрямую вызвано средой кишечных макрофагов. Окружающие кишечные эпителиальные клетки выделяют TGF-β , что вызывает изменение от провоспалительного макрофага к невоспалительному макрофагу. [122]
Несмотря на то, что воспалительная реакция подавлена в кишечных макрофагах, фагоцитоз все еще осуществляется. Эффективность фагоцитоза не снижается, поскольку кишечные макрофаги способны эффективно фагоцитировать бактерии, S. typhimurium и E. coli , но кишечные макрофаги все еще не выделяют цитокины, даже после фагоцитоза. Кроме того, кишечные макрофаги не экспрессируют рецепторы липополисахаридов (ЛПС), IgA или IgG. [123] Отсутствие рецепторов ЛПС важно для кишечника, поскольку кишечные макрофаги не обнаруживают связанные с микробами молекулярные паттерны (MAMPS/PAMPS) кишечного микробиома. Они также не экспрессируют рецепторы факторов роста IL-2 и IL-3. [122]
Было показано, что кишечные макрофаги играют роль в воспалительных заболеваниях кишечника (ВЗК), таких как болезнь Крона (БК) и язвенный колит (ЯК). В здоровом кишечнике кишечные макрофаги ограничивают воспалительную реакцию в кишечнике, но в состоянии болезни количество и разнообразие кишечных макрофагов изменяются. Это приводит к воспалению кишечника и симптомам заболевания ВЗК. Кишечные макрофаги имеют решающее значение для поддержания гомеостаза кишечника . Наличие воспаления или патогена изменяет этот гомеостаз и одновременно изменяет кишечные макрофаги. [124] Пока еще не определен механизм изменения кишечных макрофагов путем привлечения новых моноцитов или изменений в уже имеющихся кишечных макрофагах. [123]
Кроме того, новое исследование показывает, что макрофаги ограничивают доступ железа к бактериям, высвобождая внеклеточные везикулы, что улучшает результаты лечения сепсиса. [125]
Макрофаги были впервые обнаружены в конце 19 века Эли Мечниковым . [126] Эли Мечников произвел революцию в области макрофагов, объединив философские идеи и эволюционное изучение жизни. [127] Позднее, в 1960-х годах, Ван Фурт предложил идею о том, что циркулирующие моноциты крови у взрослых позволили возникнуть всем тканевым макрофагам. [128] В последние годы публикации, касающиеся макрофагов, заставили людей поверить, что множественные резидентные тканевые макрофаги независимы от моноцитов крови, поскольку они образуются на эмбриональной стадии развития. [129] В 21 веке все идеи, касающиеся происхождения макрофагов (присутствующих в тканях), были объединены вместе, чтобы предположить, что физиологически сложные организмы образуют макрофаги независимо с помощью механизмов, которые не обязательно зависят от моноцитов крови. [130]
Макрофаги присутствуют по существу во всех тканях, начиная с эмбрионального развития, и, в дополнение к их роли в защите хозяина и в очистке от апоптотических клеток, все больше признаются за их трофическую функцию и роль в регенерации.
= Моноциты/макрофаги. Если в месте раны не сохраняются стимулы для набора нейтрофилов, нейтрофильная инфильтрация прекращается через несколько дней, а израсходованные нейтрофилы сами фагоцитируются макрофагами, которые присутствуют на стороне раны в течение 2 дней после травмы.
Исследователи идентифицировали клетку, которая помогает отрастать конечностям у саламандр. Макрофаги — это тип восстанавливающих клеток, которые пожирают мертвые клетки и патогены и заставляют другие иммунные клетки реагировать на патогены.