
Морфолино , также известный как олигомер морфолино и фосфородиамидатный олигомер морфолино ( PMO ), представляет собой тип молекулы олигомера (в просторечии олиго ), используемой в молекулярной биологии для модификации экспрессии генов . Его молекулярная структура содержит основания ДНК, прикрепленные к остову метиленморфолиновых колец, связанных через фосфородиамидатные группы. Морфолино блокируют доступ других молекул к небольшим (~25 оснований) специфическим последовательностям поверхностей спаривания оснований рибонуклеиновой кислоты (РНК). Морфолино используются в качестве исследовательских инструментов для обратной генетики , вызывая нарушение функции гена.
В этой статье рассматриваются только антисмысловые олигомеры морфолино, которые являются аналогами нуклеиновых кислот . Слово «морфолино» может встречаться в других химических названиях, ссылаясь на химические вещества, содержащие шестичленное морфолиновое кольцо. Чтобы избежать путаницы с другими морфолинсодержащими молекулами, при описании олиго «морфолино» часто пишут с заглавной буквы как торговое название , но такое использование не является единообразным в научной литературе. Морфолино-олиго иногда называют PMO (фосфородиамидат морфолино-олигомер), особенно в медицинской литературе. Vivo-морфолино и PPMO являются модифицированными формами морфолино с химическими группами, ковалентно присоединенными для облегчения проникновения в клетки.
Снижение экспрессии гена достигается путем снижения экспрессии определенного гена в клетке. В случае генов, кодирующих белок, это обычно приводит к снижению количества соответствующего белка в клетке. Снижение экспрессии гена является методом изучения функции определенного белка; аналогичным образом, заставляя определенный экзон быть сплайсингованным из транскрипта РНК, кодирующего белок, может помочь определить функцию белковой части, кодируемой этим экзоном, или иногда может полностью снизить активность белка. Эти молекулы были применены в исследованиях на нескольких модельных организмах , включая мышей , данио-рерио , лягушек и морских ежей . [1] Морфолино также могут изменять сплайсинг пре-мРНК [ 2] или ингибировать созревание и активность микроРНК. [3] Методы нацеливания морфолино на РНК и доставки морфолино в клетки недавно были рассмотрены в журнальной статье [4] и в форме книги. [5]
Морфолино находятся в разработке в качестве фармацевтических терапевтических средств, нацеленных на патогенные организмы, такие как бактерии [6] или вирусы [7] и генетические заболевания . [8] Препарат на основе морфолино этеплирсен от Sarepta Therapeutics получил ускоренное одобрение от Управления по контролю за продуктами и лекарствами США в сентябре 2016 года для лечения некоторых мутаций, вызывающих мышечную дистрофию Дюшенна , [9] хотя процесс одобрения был охвачен спорами. Другие препараты на основе морфолино голодирсен , вилтоларсен и казимерсен (также для мышечной дистрофии Дюшенна) были одобрены FDA в 2019–2021 годах. [10] [11] [12]
Морфолино-олигонуклеотиды были задуманы Саммертоном ( Gene Tools ) в AntiVirals Inc. (теперь Sarepta Therapeutics) и первоначально разрабатывались в сотрудничестве с Уэллером. [13]
Морфолино — это синтетические молекулы , которые являются продуктом перепроектирования структуры природной нуклеиновой кислоты . [14] Обычно длиной 25 оснований, они связываются с комплементарными последовательностями РНК или одноцепочечной ДНК с помощью стандартного спаривания оснований нуклеиновой кислоты . С точки зрения структуры, разница между морфолино и ДНК заключается в том, что, хотя морфолино имеют стандартные основания нуклеиновой кислоты, эти основания связаны с метиленморфолиновыми кольцами , связанными через фосфородиамидатные группы вместо фосфатов . [14] На рисунке сравниваются структуры двух изображенных там нитей, одной из РНК и другой из морфолино. Замена анионных фосфатов незаряженными фосфородиамидатными группами устраняет ионизацию в обычном физиологическом диапазоне pH , поэтому морфолино в организмах или клетках являются незаряженными молекулами. Весь остов морфолино состоит из этих модифицированных субъединиц.
Морфолино не запускают деградацию своих целевых молекул РНК, в отличие от многих антисмысловых структурных типов (например, фосфоротиоатов , siRNA ). Вместо этого морфолино действуют путем «стерического блокирования», связываясь с целевой последовательностью внутри РНК, ингибируя молекулы, которые в противном случае могли бы взаимодействовать с РНК. [15] Олигоморфолино часто используются для исследования роли специфического транскрипта мРНК в эмбрионе . Биологи развития вводят олигоморфолино в яйца или эмбрионы данио-рерио , [16] африканской когтистой лягушки ( Xenopus ), [17] морского ежа [18] и киллифиша ( F. heteroclitus ), производя эмбрионы -морфанты , или электропорируют морфолино в эмбрионы цыплят [19] на более поздних стадиях развития. При наличии соответствующих цитозольных систем доставки морфолино эффективны в клеточной культуре . [20] [21] Vivo-морфолины, в которых олигонуклеотид ковалентно связан с дендримером доставки , проникают в клетки при системном введении взрослым животным или в тканевые культуры. [22]
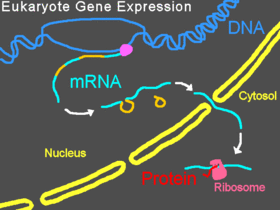
В эукариотических организмах пре-мРНК транскрибируется в ядре, интроны вырезаются , затем зрелая мРНК экспортируется из ядра в цитоплазму . Малая субъединица рибосомы обычно начинает связываться с 5'-концом мРНК и присоединяется там различными другими эукариотическими факторами инициации , образуя комплекс инициации . Комплекс инициации сканирует вдоль цепи мРНК, пока не достигнет стартового кодона , а затем большая субъединица рибосомы присоединяется к малой субъединице, и начинается трансляция белка . Весь этот процесс называется экспрессией гена; это процесс, посредством которого информация в гене , закодированная в виде последовательности оснований в ДНК , преобразуется в структуру белка . Морфолино может модифицировать сплайсинг, блокировать трансляцию или блокировать другие функциональные сайты на РНК в зависимости от последовательности оснований морфолино.

Связанные с 5'-нетранслируемой областью информационной РНК (мРНК), морфолино могут мешать прогрессированию рибосомального инициирующего комплекса от 5'-кэпа до стартового кодона. Это предотвращает трансляцию кодирующей области целевого транскрипта (называемого « выключением » экспрессии гена ). Это полезно экспериментально, когда исследователь хочет узнать функцию конкретного белка; морфолино предоставляют удобный способ выключения экспрессии белка и изучения того, как это выключение изменяет клетки или организм. Некоторые морфолино так эффективно выключают экспрессию, что после деградации уже существующих белков целевые белки становятся необнаружимыми с помощью вестерн-блоттинга .
В 2016 году было обнаружено, что синтетический пептид-конъюгированный PMO (PPMO) подавляет экспрессию металло-бета-лактамазы Нью-Дели , фермента, который многие бактерии, устойчивые к лекарственным препаратам, используют для разрушения карбапенемов. [23] [24]

Морфолино могут вмешиваться в этапы обработки пре-мРНК либо путем предотвращения связывания комплексов малых ядерных рибонуклеопротеинов ( мяРНП ) , направляющих сплайсинг , с их мишенями на границах интронов на нити пре-мРНК, либо путем блокирования нуклеофильного основания аденина и предотвращения его образования структуры лариата сплайсинга, либо путем вмешательства в связывание регуляторных белков сплайсинга, таких как сайленсеры сплайсинга [25] и усилители сплайсинга . [26] Предотвращение связывания мяРНП U1 (в донорском сайте) или U2 / U5 (в полипиримидиновом фрагменте и акцепторном сайте) может вызвать измененный сплайсинг , обычно исключающий экзоны из зрелой мРНК. Нацеливание на некоторые цели сплайсинга приводит к включениям интронов, в то время как активация скрытых сайтов сплайсинга может привести к частичным включениям или исключениям. [27] Цели U11 / U12 snRNP также могут быть заблокированы. [28] Модификацию сплайсинга можно легко проанализировать с помощью полимеразной цепной реакции с обратной транскриптазой ( ОТ-ПЦР ) и увидеть ее как сдвиг полосы после гель-электрофореза продуктов ОТ-ПЦР. [2]
Морфолино использовались для блокирования активности микроРНК [29] [30] и созревания. [3] Флуоресцеин -меченые морфолино в сочетании с флуоресцеин-специфическими антителами могут использоваться в качестве зондов для гибридизации in situ с микроРНК. [31] Морфолино могут блокировать активность рибозима . [32] Функции U2 и U12 snRNP были ингибированы морфолино. [33] Морфолино, нацеленные на «скользкие» последовательности мРНК в кодирующих белка областях, могут вызывать сдвиги рамки трансляции . [34] Морфолино могут блокировать редактирование РНК, [35] поли(А)-хвост [36] и транслокационные последовательности. [37] Активность морфолино против этого разнообразия целей предполагает, что морфолино можно использовать в качестве универсального инструмента для блокирования взаимодействий белков или нуклеиновых кислот с мРНК.
Морфолино стали стандартным инструментом нокдауна в эмбриональных системах животных, которые имеют более широкий диапазон экспрессии генов, чем взрослые клетки , и могут быть сильно затронуты нецелевым взаимодействием. После первоначальных инъекций в эмбрионы лягушек или рыб на одноклеточной или малоклеточной стадии эффекты морфолино можно измерить до пяти дней спустя, [38] после того, как большинство процессов органогенеза и дифференциации уже позади, с наблюдаемыми фенотипами, соответствующими нокдауну целевого гена. Контрольные олигонуклеотиды с нерелевантными последовательностями обычно не вызывают никаких изменений в эмбриональном фенотипе, что свидетельствует о специфичности последовательности олигонуклеотида морфолино и отсутствии неантисмысловых эффектов. Дозу, необходимую для нокдауна, можно уменьшить путем совместной инъекции нескольких олигонуклеотидов морфолино, нацеленных на одну и ту же мРНК, что является эффективной стратегией для снижения или устранения зависимых от дозы нецелевых взаимодействий РНК. [39]
Эксперименты по спасению мРНК иногда могут восстановить фенотип дикого типа у эмбрионов и предоставить доказательства специфичности морфолино. При спасении мРНК морфолино совместно вводят с мРНК, которая кодирует белок морфолино. Однако спасательная мРНК имеет модифицированную 5'-UTR (нетранслируемую область), так что спасательная мРНК не содержит мишени для морфолино. Кодирующая область спасательной мРНК кодирует интересующий белок. Трансляция спасательной мРНК заменяет выработку белка, который был подавлен морфолино. Поскольку спасательная мРНК не повлияет на фенотипические изменения из-за модуляции экспрессии генов вне целевого участка морфолино, этот возврат к фенотипу дикого типа является еще одним доказательством специфичности морфолино. [38] В некоторых случаях эктопическая экспрессия спасательной РНК делает восстановление фенотипа дикого типа невозможным.
В эмбрионах морфолино можно тестировать в нулевых мутантах для проверки неожиданных взаимодействий РНК, а затем использовать в эмбрионе дикого типа для выявления острого фенотипа нокдауна. Фенотип нокдауна часто более экстремальный, чем фенотип мутанта; в мутанте эффекты потери нулевого гена могут быть скрыты генетической компенсацией. [40]
Из-за их совершенно неестественных остовов, Морфолино не распознаются клеточными белками. Нуклеазы не разрушают Морфолино, [41] и они не разрушаются в сыворотке или в клетках. [42]
До 18% морфолино, по-видимому, вызывают нецелевые фенотипы, включая гибель клеток в центральной нервной системе и сомитных тканях эмбрионов данио-рерио. [43] Большинство этих эффектов обусловлены активацией апоптоза, опосредованного p53 , и могут быть подавлены совместной инъекцией анти-p53 морфолино вместе с экспериментальным морфолино. Более того, опосредованный p53 апоптотический эффект нокдауна морфолино был фенокопирован с использованием другого антисмыслового структурного типа, показывающего, что опосредованный p53 апоптоз является следствием потери целевого белка, а не следствием нокдауна олиготипа. [44] Похоже, что эти эффекты являются специфичными для последовательности; как и в большинстве случаев, если морфолино связано с нецелевыми эффектами, 4-основное несоответствие морфолино не вызовет этих эффектов.
Причиной беспокойства при использовании морфолино является потенциал для «внецелевых» эффектов. Является ли наблюдаемый фенотип морфанта следствием предполагаемого нокдауна или взаимодействия с нецелевой РНК, часто можно решить на эмбрионах, проведя другой эксперимент, чтобы подтвердить, что наблюдаемый фенотип морфанта является результатом нокдауна ожидаемой цели. Это можно сделать, повторив фенотип морфанта со вторым, неперекрывающимся морфолино, нацеленным на ту же мРНК, [38] путем подтверждения наблюдаемых фенотипов путем сравнения с мутантным штаммом (хотя компенсация скроет фенотип у некоторых мутантов), путем тестирования морфолино на нулевом мутантном фоне для обнаружения дополнительных фенотипических изменений или с помощью доминантно-негативных методов. Как упоминалось выше, спасение наблюдаемых фенотипов путем коинъекции спасательной мРНК является, когда это осуществимо, надежным тестом специфичности морфолино. [38] [40]
Чтобы морфолино было эффективным, его необходимо доставить через клеточную мембрану в цитозоль клетки. Попав в цитозоль, морфолино свободно диффундируют между цитозолем и ядром, о чем свидетельствует ядерная сплайсинг-модифицирующая активность морфолино, наблюдаемая после микроинъекции в цитозоль клеток. Для доставки в эмбрионы, в культивируемые клетки или во взрослых животных используются различные методы. Для доставки в эмбрион обычно используется аппарат для микроинъекций , причем инъекции чаще всего выполняются на стадии одной клетки или нескольких клеток; [45] альтернативным методом эмбриональной доставки является электропорация , которая может доставлять олигонуклеотиды в ткани на более поздних эмбриональных стадиях. [46] Обычные методы доставки в культивируемые клетки включают пептид Эндо-Портера (который заставляет морфолино высвобождаться из эндосом ), [21] Специальную систему доставки (больше не доступна для приобретения, использовала гетеродуплекс морфолино-ДНК и этоксилированный полиэтилениминовый реагент доставки), [20] электропорацию, [47] или загрузку соскобом. [48]
Доставка во взрослые ткани обычно затруднена, хотя существует несколько систем, позволяющих эффективно поглощать немодифицированные олигоморфолино (включая поглощение мышечными клетками при мышечной дистрофии Дюшенна [49] или эндотелиальными клетками сосудов, подвергающимися стрессу во время баллонной ангиопластики [50] ). Хотя они эффективно проникают через межклеточные пространства в тканях, неконъюгированные PMO имеют ограниченное распространение в цитозольных и ядерных пространствах в здоровых тканях после внутривенного введения. Системная доставка во многие клетки во взрослых организмах может быть достигнута с помощью ковалентных конъюгатов олигоморфолино с проникающими в клетки пептидами , и, хотя токсичность была связана с умеренными дозами пептидных конъюгатов, [51] [52] они использовались in vivo для эффективной доставки олиго в дозах ниже тех, которые вызывают наблюдаемую токсичность. [7] [53] Октагуанидиновый дендример, прикрепленный к концу морфолино, может доставлять модифицированный олиго (называемый Vivo-морфолино) из крови в цитозоль. [22] [54] Морфолино с возможностью доставки, такие как пептидные конъюгаты и Vivo-морфолино, показывают перспективность в качестве терапевтических средств для вирусных и генетических заболеваний. [55]
{{cite book}}: |journal=проигнорировано ( помощь )